гидроксид аммония NH4OH
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Типичные реакции оснований
Содержание
- 1. Типичные реакции оснований
- 2. Химические свойства оснований обусловлены наличием у них гидроксо-ионов ОН- .
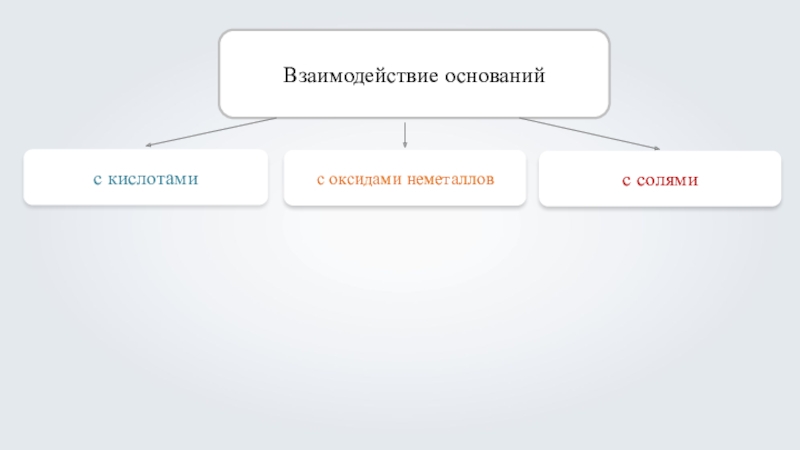
- 3. Взаимодействие оснований
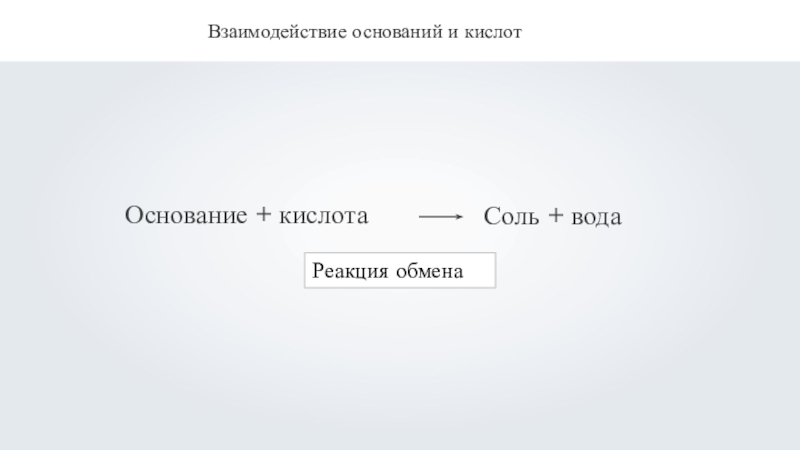
- 4. Взаимодействие оснований и кислотОснование + кислотаСоль + водаРеакция обмена
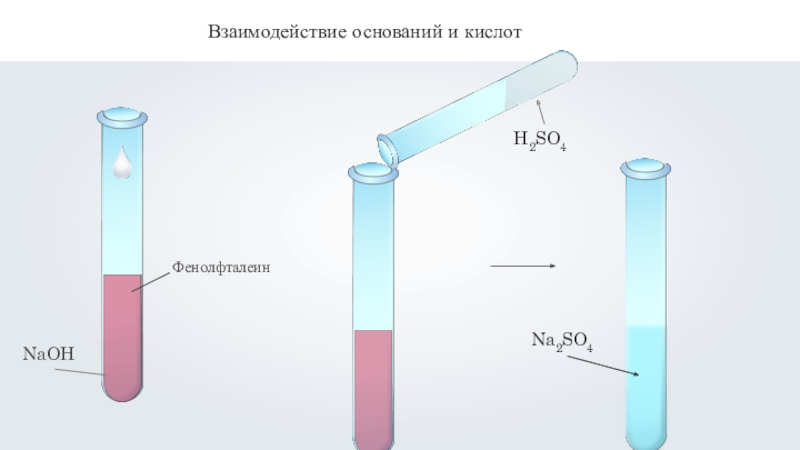
- 5. Взаимодействие оснований и кислот
- 6. H2SO4 + 2NaOH = Na2SO4 + 2H2OВзаимодействие оснований и кислотН+ + ОН- = H2OсольводаРеакция нейтрализации
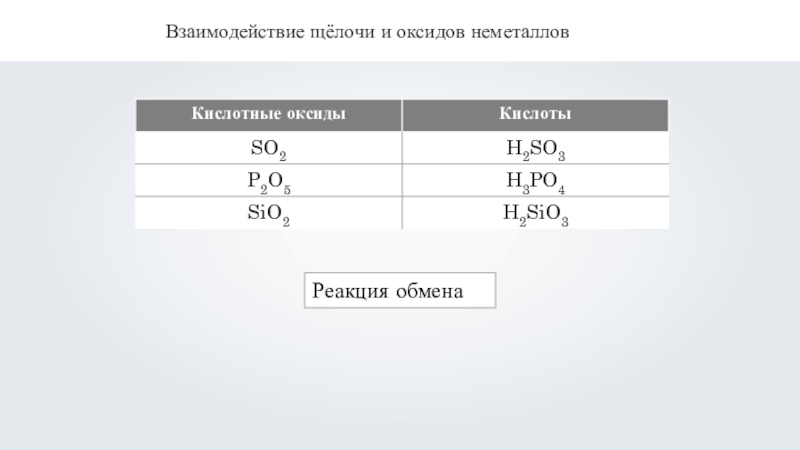
- 7. Взаимодействие щёлочи и оксидов неметаллов Щёлочь + оксид неметаллаСоль + вода
- 8. Взаимодействие щёлочи и оксидов неметаллов Реакция обмена
- 9. Взаимодействие щёлочи и оксидов неметаллов
- 10. Взаимодействие щёлочи и оксидов неметаллов Са(ОН)2 + СО2 = СаСО3↓ + Н2О соль (осадок) вода
- 11. Взаимодействие щёлочи и солиСа(ОН)2 + СО2 = СаСО3↓ + Н2О соль (осадок) вода
- 12. Взаимодействие щёлочи и солиПротекание реакции взаимодействия щелочей
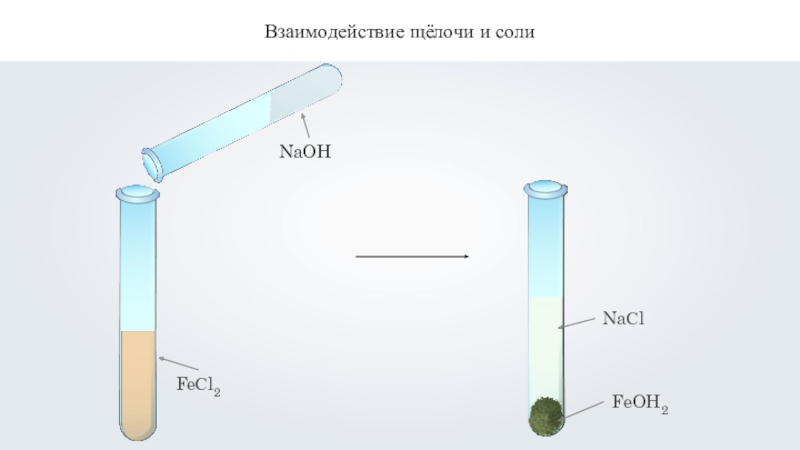
- 13. Взаимодействие щёлочи и солиFeСl2
- 14. Взаимодействие щёлочи и соли2NaOH + FeCl2 =
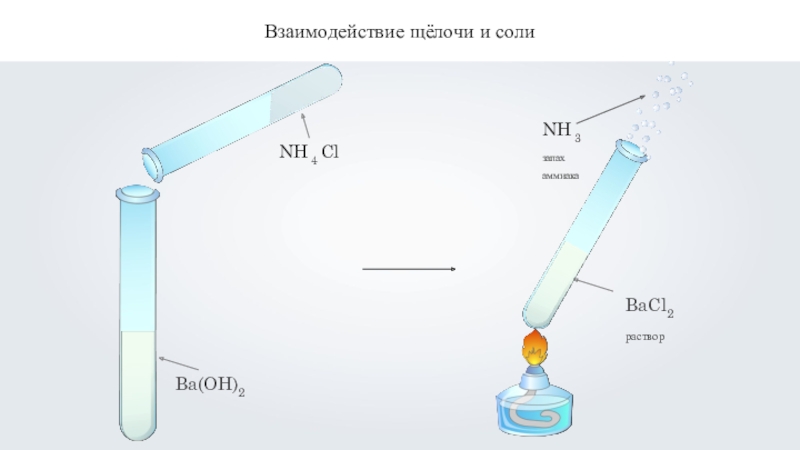
- 15. Ba(OH)2Взаимодействие щёлочи и соли
- 16. Взаимодействие щёлочи и солиBa(OH)2 + 2NH4Cl =
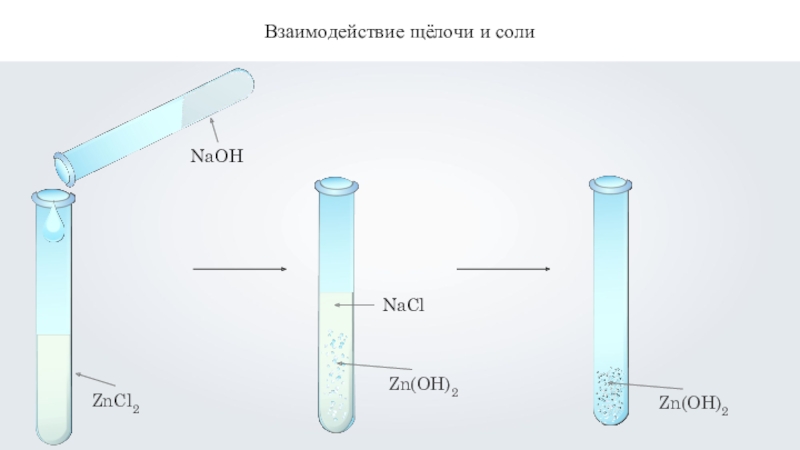
- 17. ZnCl2Взаимодействие щёлочи и соли
- 18. Взаимодействие щёлочи и соли
- 19. Взаимодействие щёлочи и соли2NaOH + ZnCl2 =
- 20. Основания взаимодействуют с кислотами, оксидами металлов и
Химические свойства оснований обусловлены наличием у них гидроксо-ионов ОН- .
Слайд 1
Основания – это сложные вещества, состоящие из ионов металлов и связанных
с ними гидроксид-ионов.
Слайд 6H2SO4 + 2NaOH = Na2SO4 + 2H2O
Взаимодействие оснований и кислот
Н+ +
ОН- = H2O
соль
вода
Реакция нейтрализации
Слайд 12
Взаимодействие щёлочи и соли
Протекание реакции взаимодействия щелочей и солей происходит только
в случае образования нерастворимого осадка или газа.
Реакция ионного обмена
Слайд 14
Взаимодействие щёлочи и соли
2NaOH + FeCl2 = 2NaCl + Fe(OH)2↓
хлорид
натрия
гидроксид железа
2OH- + Fe2+ = Fe(OH)2↓
Слайд 16
Взаимодействие щёлочи и соли
Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3↑ +
2Н2О
хлорид
бария
аммиак
вода
2OH- + 2NH4+ = 2NH3↑ + 2Н2О
Слайд 19
Взаимодействие щёлочи и соли
2NaOH + ZnCl2 = 2NaCl + Zn(OH)2↓
2OH-
+ Zn2+ = Zn(OH)2↓
Zn(OH)2t= ZnO + H2O
Слайд 20Основания взаимодействуют с кислотами, оксидами металлов и солями, а также разлагаются
под воздействием температуры на оксид и воду.