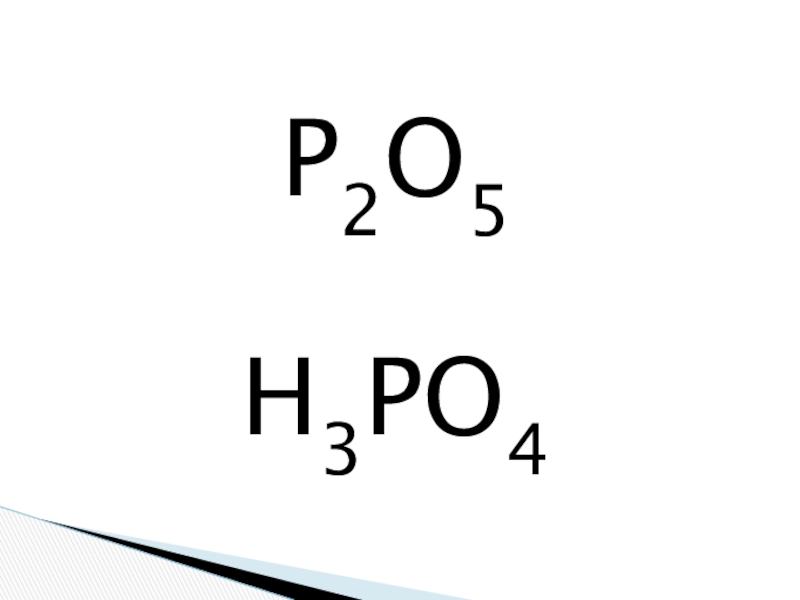
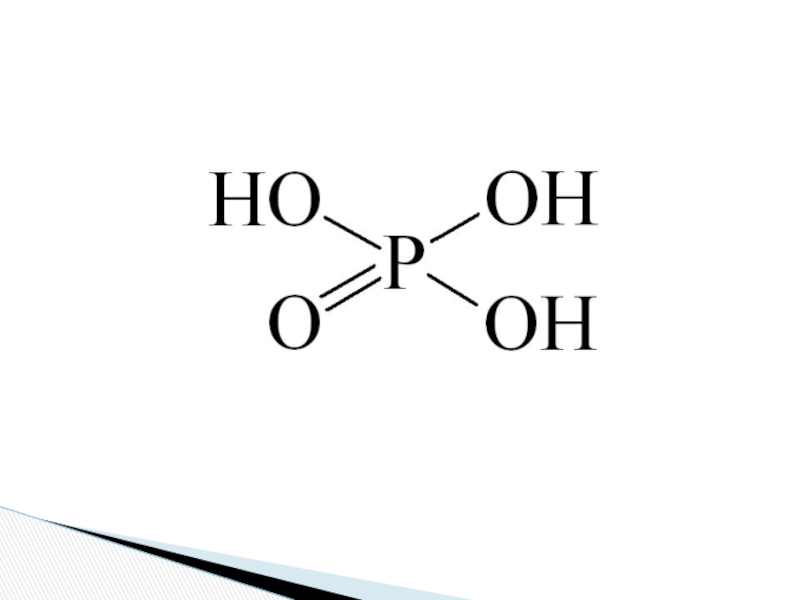
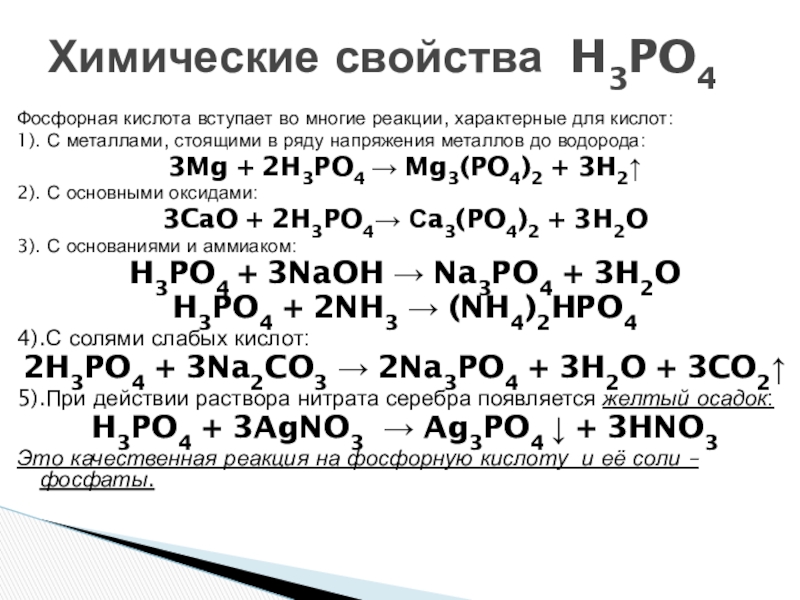
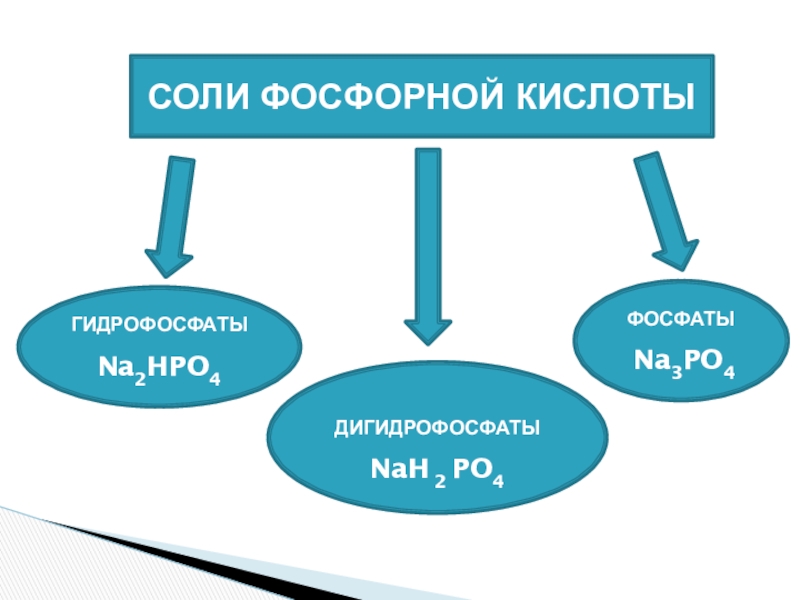
Сколько электронов на внешнем энергетическом уровне находится у атома фосфора?
Заряд ядра атома фосфора?
Назовите высшую и низшую степени окисления фосфора?
В виде каких аллотропных модификаций встречается фосфор?
Чем отличается белый фосфор от красного?
Какие свойства фосфор проявляет в реакциях?
Где применяется фосфор?
Подумай и ответь на вопросы: