- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Электронная природа химических связей в органических соединениях
Содержание
- 1. Презентация по химии Электронная природа химических связей в органических соединениях
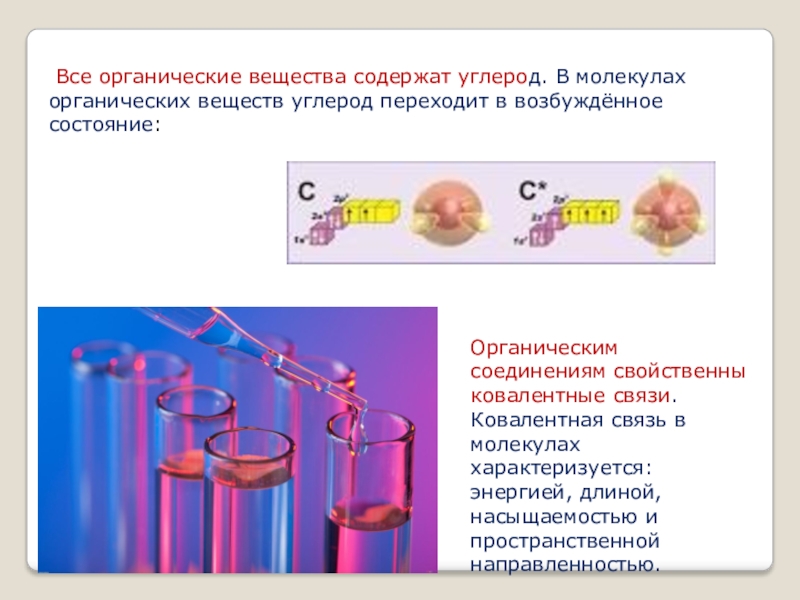
- 2. Все органические вещества содержат углерод. В молекулах
- 3. а) Из курса химии 8 класса вы
- 4. в) Под насыщаемостью связи понимают способность образовывать строго определённое
- 5. Вы уже знаете, что атом углерода содержит
- 6. В 1931 г. американский учёный Л. Полинг
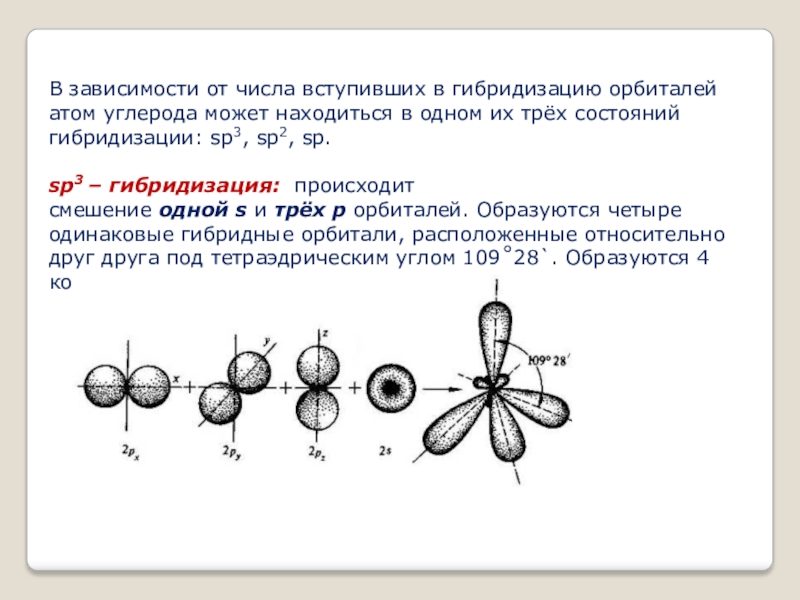
- 7. В зависимости от числа вступивших в гибридизацию
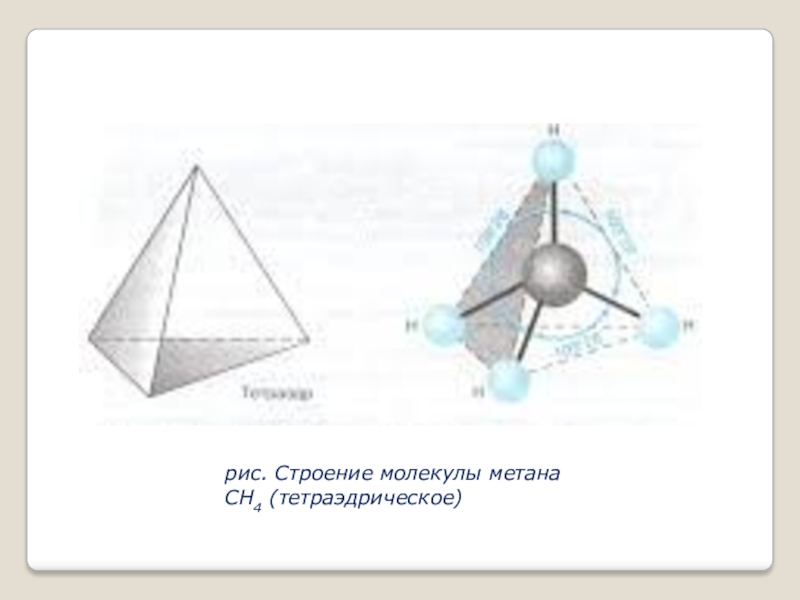
- 8. рис. Строение молекулы метана СН4 (тетраэдрическое)
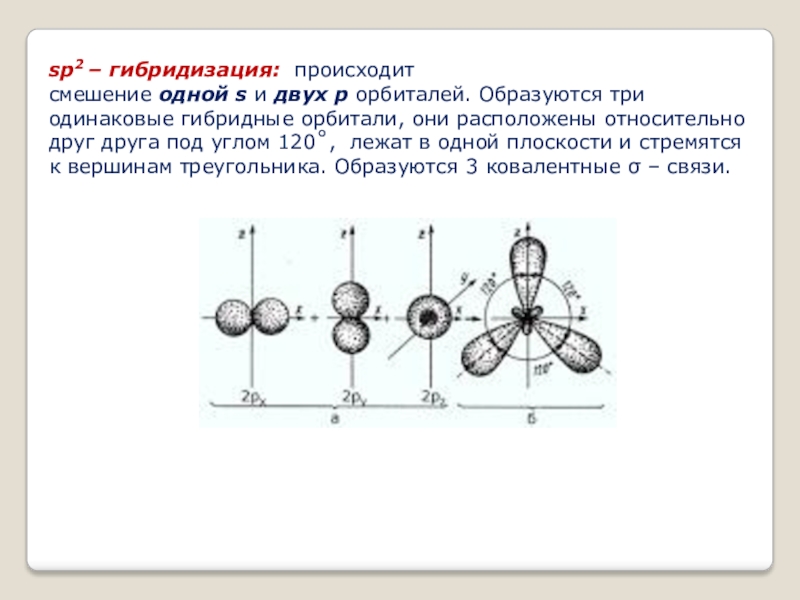
- 9. sp2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные
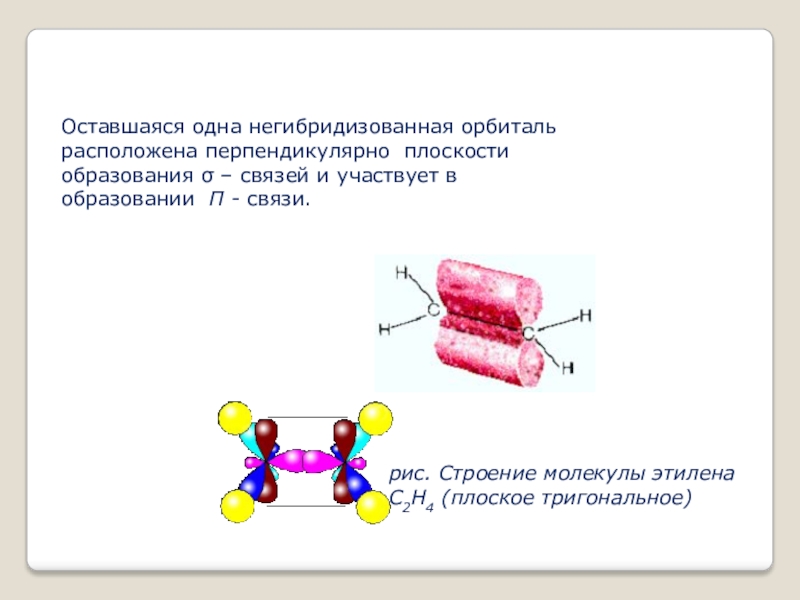
- 10. Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ –
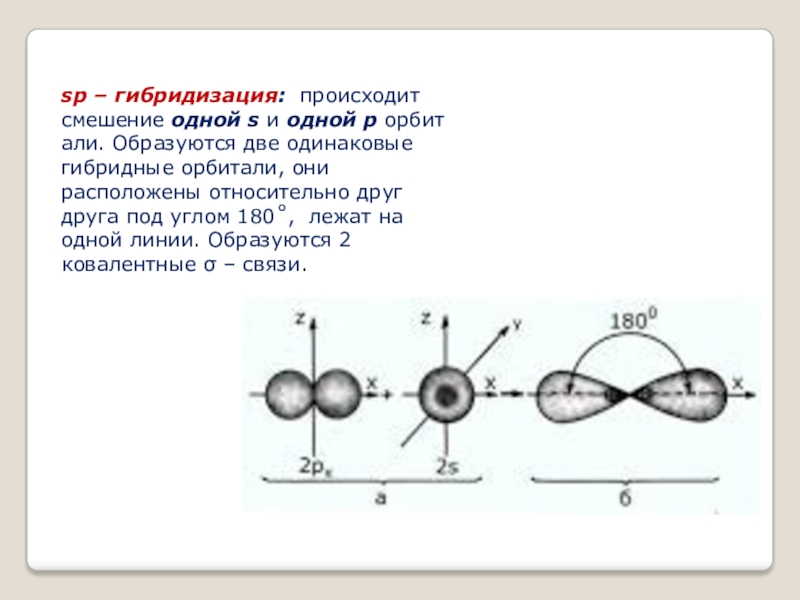
- 11. sp – гибридизация: происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные
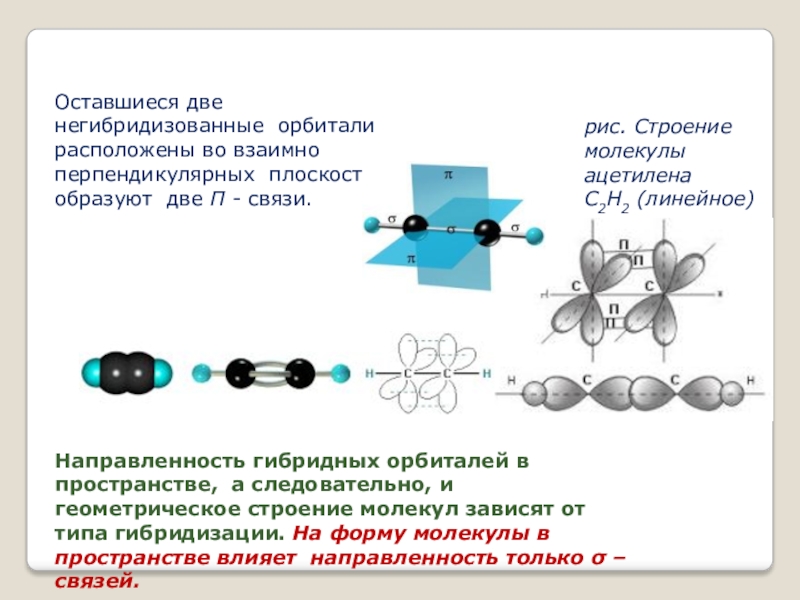
- 12. Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях
- 13. Простая и кратная ковалентные связиСпособность атома углерода
- 14. Слайд 14
Слайд 1Электронная природа химических связей в органических соединениях.
Выполнила : Вишнякова Настя ученица
Слайд 2 Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит
Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
Слайд 3а) Из курса химии 8 класса вы знаете, что ковалентная связь
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании:
σ(s – s) < σ(s – p) < σ (p – p)
б) Длина связи определяется
расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10-9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше:
(С – С) < (C = C) < (C ≡ C)
Слайд 4в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
г) Направленность ковалентной связи
Слайд 5Вы уже знаете, что атом углерода содержит на внешнем уровне четыре
1 электрон на s – орбитали сферической формы
3 электрона на трёх p – орбиталях, орбитали имеют форму гантели и расположены под углом 90˚.
Таким образом можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
Слайд 6В 1931 г. американский учёный Л. Полинг доказал, что в молекуле
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
Слайд 7В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может
sp3 – гибридизация: происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Слайд 9sp2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно
Слайд 10Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
Слайд 11sp – гибридизация: происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно
Слайд 12Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П - связи.
Направленность гибридных
рис. Строение молекулы ацетилена С2Н2 (линейное)
Слайд 13Простая и кратная ковалентные связи
Способность атома углерода иметь разные степени окисления
СН3 – СН3 (1 σ – сигма связь С-С)
CH2=CH2 (1 σ – сигма связь С-С и 1 П – пи связь С-С)
CH ≡ CH (1 σ – сигма связь С-С и 2 П – пи связи С-С)