- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему ТЕМА: Важнейшие окислители и восстановители. Окислительно-восстановительные реакции. Задачи на нахождение формул веществ по массовым долям элементов.
Содержание
- 1. ТЕМА: Важнейшие окислители и восстановители. Окислительно-восстановительные реакции. Задачи на нахождение формул веществ по массовым долям элементов.
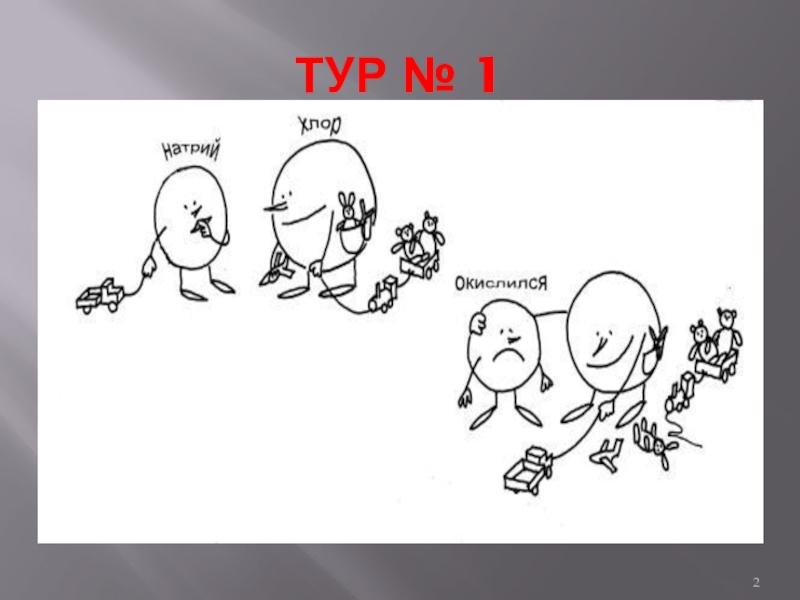
- 2. ТУР № 1
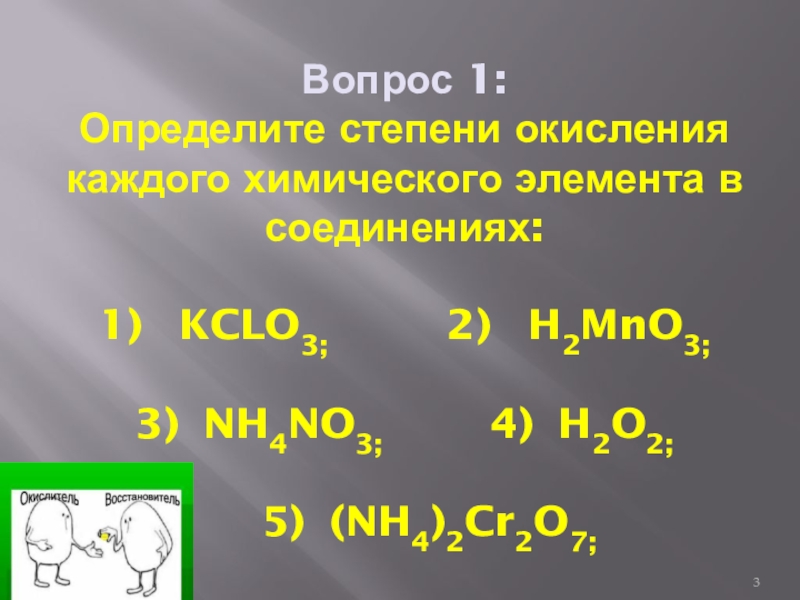
- 3. Вопрос 1: Определите степени окисления каждого химического
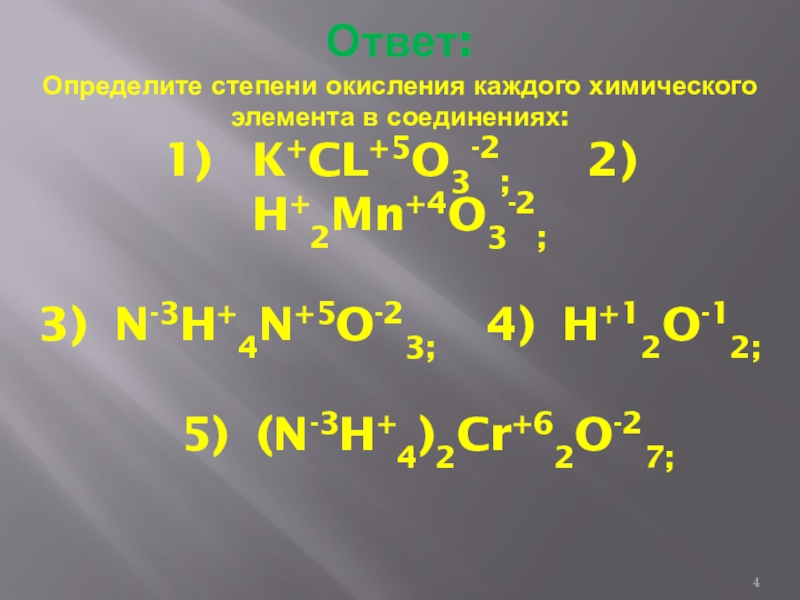
- 4. Ответ: Определите степени окисления каждого химического элемента
- 5. Вопрос 2: В каком соединении хлор
- 6. Ответ: В каком соединении хлор проявляет только
- 7. Вопрос 3: Фосфор проявляет окислительные свойства
- 8. Ответ: Фосфор проявляет окислительные свойства в реакции
- 9. Вопрос 4: Процессу восстановления соответствует схема:
- 10. Ответ: Процессу восстановления соответствует схема:
- 11. Вопрос 5: В реакции железа с хлором
- 12. Ответ: В реакции железа с хлором восстановителем
- 13. Вопрос 6: Изменению степени окисления серы S0
- 14. Ответ: Изменению степени окисления серы S0 —>S+4
- 15. Вопрос 7: В перечне уравнений А) P2O5+2KOH+H2O
- 16. Ответ: В перечне уравнений А) P2O5+2KOH+H2O =
- 17. ТУР № 2
- 18. Нобелевские премии, присужденные за исследование окислительно-восстановительных реакцийГенри
- 19. 1.Используя метод электронного баланса расставьте коэффициенты в
- 20. Слайд 20
- 21. 2.В окислительно-восстановительной реакции, схема которой KI+NaNO2+H2SO4
- 22. 2.Ответ: В окислительно-восстановительной реакции, схема которой 2KI+2NaNO2+2H2SO4
- 23. 3. Установите соответствие между схемой химической реакции и изменением степени окисления восстановителя в ней.
- 24. Ответ: 3. Установите соответствие между схемой химической
- 25. Тур № 3. Для газообразных
- 26. ..Задача № 1: В оксиде на
- 27. ..
- 28. Задача № 2: Аскорбиновая кислота (витамин С)
- 29. Аскорбиновая кислота (витамин С) имеет
- 30. Задача № 3: Соединение содержит
- 31. Соединение содержит водород
- 32. ЭТО ИНТЕРЕСНООкислительно-восстановительные реакции на космическом кораблеКонструкторы
- 33. Окисление. В области научной терминологии широко и наглядно
Слайд 1 Интеллектуальная игра по химии среди учащихся 9 классов ТЕМА: « Важнейшие окислители
Слайд 3Вопрос 1: Определите степени окисления каждого химического элемента в соединениях: 1) KCLO3;
Слайд 4Ответ: Определите степени окисления каждого химического элемента в соединениях: 1) K+CL+5O3-2;
Слайд 5Вопрос 2: В каком соединении хлор проявляет только восстановительные свойства? 1) KCLO
Слайд 6Ответ: В каком соединении хлор проявляет только восстановительные свойства? 1) KCLO ;
Слайд 7Вопрос 3: Фосфор проявляет окислительные свойства в реакции с 1) кальцием;
Слайд 8Ответ: Фосфор проявляет окислительные свойства в реакции с 1) кальцием; 2) серой; 3)хлором;
Слайд 9Вопрос 4: Процессу восстановления соответствует схема: 1) SO2 —>SO32- ;
Слайд 10Ответ: Процессу восстановления соответствует схема: 1) SO2 —>SO32- ; 2) NH3
Слайд 13Вопрос 6: Изменению степени окисления серы S0 —>S+4 —>S+6 соответствует схема превращений 1)S —> SO2
Слайд 14Ответ: Изменению степени окисления серы S0 —>S+4 —>S+6 соответствует схема превращений 1)S —> SO2 —>
Слайд 15Вопрос 7: В перечне уравнений А) P2O5+2KOH+H2O = 2KH2PO4 Б) SO2+2H2S = 3S +2H2O В)
Слайд 16Ответ: В перечне уравнений А) P2O5+2KOH+H2O = 2KH2PO4 Б) SO2+2H2S = 3S +2H2O В) CO2+CaCO3+H2O
Слайд 18Нобелевские премии, присужденные за исследование окислительно-восстановительных реакций
Генри ТАУБЕ
1983
«за его работу
Рудольф А. МАРКУС
1992
«за его вклад в теорию реакций электронного переноса в химических системах»
Слайд 191.Используя метод электронного баланса расставьте коэффициенты в уравнении реакции, схема которой NiCL2
Слайд 20
Слайд 212.
В окислительно-восстановительной реакции,
схема которой
KI+NaNO2+H2SO4 -> I2+NO+K2SO4+Na2SO4+H2O
сумма
1)7 ; 2)9 ; 3)11 ; 4)14.
Слайд 222.
Ответ:
В окислительно-восстановительной реакции,
схема которой
2KI+2NaNO2+2H2SO4 -> I2+2NO+K2SO4+Na2SO4+2H2O
сумма коэффициентов перед формулами продуктов реакции равна:
1)7 ; 2)9 ; 3)11 ; 4)14.
Слайд 233. Установите соответствие между схемой химической реакции и изменением степени окисления
Слайд 24Ответ: 3. Установите соответствие между схемой химической реакции и изменением степени окисления
Слайд 25Тур № 3.
Для газообразных веществ помимо массы измеряли
С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов.
Слайд 26.
.
Задача № 1:
В оксиде на 128 частей меди приходится
Назовите его.
Слайд 27.
.
Задача: В оксиде на 128 частей меди приходится 16 частей кислорода. Найдите формулу оксида. Назовите его.
Решение:
Закон кратных отношений:
X :Y = m(X) : m(Y)
Ar Ar CuxOy
X :Y = 128 : 16 = 2 :1
64 16
Получаем соотношение:
n(Cu) : n(O) = 2:1
Cu2O –формула оксида
Ответ: Cu2O – оксид меди (I).
Слайд 28Задача № 2:
Аскорбиновая кислота (витамин С) имеет молекулярную массу 176 и
Найдите молекулярную формулу этой кислоты.
Слайд 29 Аскорбиновая кислота (витамин С) имеет молекулярную массу 176 и
Решение.
Пусть числа атомов натрия, углерода и кислорода в эмпирической формуле равны соответственно х, у и z — C xHyOz Атомные массы C, H и О равны 12, 1 и 16
x:y:z=40,91/12:4,55/1:54,54/16=3,41:4,55:3,41 (делим на наименьшее число)
x:y:z=3,41/3,41:4,55/3,41:3,41/3,41=1:1,32:1
Поскольку индексы не могут быть дробными числами, поэтому умножаем все члены последнего отношения на 3 и получаем:
х: у: z = 3 : 4 : 3 Следовательно, аскорбиновая кислота имеет эмпирическую формулу С3Н4О3. Молекулярная масса, соответствующая этой формуле, равна Мr(С3Н4О3) = 12·3 + 1 ·4 + 16·3 = 88.
По условию задачи известно, что молекулярная масса аскорбиновой кислоты в 2 раза больше (176 : 88 = 2). Следовательно, все индексы в эмпирической формуле нужно умножить на 2, и в результате мы получим молекулярную формулу аскорбиновой кислоты: С6Н8О6.
Ответ: Молекулярная формула аскорбиновой кислоты С6Н8О6
Слайд 30Задача № 3:
Соединение содержит водород (массовая доля –
Определите, что это за соединение (назовите) и к какому классу оно относится.
Слайд 31 Соединение содержит водород (массовая доля – 6,33%),
Решение
Обозначим неизвестный элемент буквой X. Массовая доля неизвестного элемента будет равна
w(X) = 100 – (6,33 + 15,19 + 60,76)% = 17,72%, Находим отношение числа атомов элементов:
а : b : c = 6,33 / 1 : 15,19 / 12 : 60,76 / 16 = 6,33 : 1,27 : 3,8
Меньшее число (1,27) принимаем за единицу и находим следующее отношение: а : b : c =5:1:3
Находим неизвестный элемент. По условию задачи число атомов элемента X равно числу атомов углерода, значит:
17,72 / Ar(X) = 15,19 / 12 , откуда Ar(X) = 14
Неизвестный элемент – азот.
Простейшая формула вещества запишется следующим образом: NH5CO3, или NH4HCO3 – гидрокарбонат аммония (кислая соль).
Слайд 32ЭТО ИНТЕРЕСНО
Окислительно-восстановительные реакции на космическом корабле
Конструкторы первых космических кораблей и
4КО2 + 2СО2 = 2К2СО3 + 3О2 С помощью этого уравнения можно вычислить, что для связывания 1 кг (0,51 м3) углекислого газа — а именно столько выдыхает человек за сутки — расходуется 3,2 кг KО2 при этом выделяется 1,1 кг (0,77 м3) кислорода
Слайд 33Окисление. В области научной терминологии широко и наглядно сказалась огромная словообразующая роль
Известно, что Ломоносов создал химический термин кислота Термин окисление (обозначающий: `химический процесс, при котором происходит соединение какого-нибудь тела с кислородом') введен в конце XVIII — в начале XIX в. акад. В. М. Севергиным. Акад. М. И. Сухомлинов заметил: «Некоторые из употребляемых Севергиным русских терминов, как, например, окисление и т. п., также усвоены языком науки, как введенное знаменитым современником Севергина словопромышленность усвоено языком литературным» (Сухомлинов, вып. 4, с. 16).
В «Словаре химическом, содержащем в себе теорию и практику химии... сочинение Шарль-Луи Кадета, обработанном на российском языке трудами Василия Севергина» (1810, ч. 1, с. 8—14), в числе слов, вновь образованных в процессе перевода иноязычной терминологии, указаны: кислец — oxidule, окисление, окислотворение — oxidation, oxigenation;раскислять, рискисление — debruler, desoxidation и пр. (там же, с. 30). Те же термины окисление, окислотворение,окись, окисл, окисленный, откисление (desoxidation) откислять (desoxider, debruler) были определены акад. Севергиным для «Словаря Академии Российской» (там же, с. 174—175). Термин окисление прочно вошел в язык русской химической науки. Таким образом, была создана целая система внутренне — по смыслу — и словообразовательно объединенных терминов на базе слова основного словарного фонда.