- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Сюжетно - ролевой урок по теме: Путешествие в мир кислот
Содержание
- 1. Сюжетно - ролевой урок по теме: Путешествие в мир кислот
- 2. Маршрут путешествия:Станция ИнформационнаяСтанция ИсторическаяСтанция ДегустационнаяСтанция «Стоп! Красный свет!»Станция ЭкспериментальнаяСтанция Индикаторная
- 3. Станция информационная Кислоты постоянно присутствуют вокруг нас
- 4. Станция информационная Если в состав кислотного остатка
- 5. Получение азотной кислоты.4NH3 + 5O2 = 4NO
- 6. Кислоты - это сложные вещества, в состав
- 7. Полезно знать:нерастворимая — кремниевая (H2SiO3); нестойкие —
- 8. Опорный конспект «Путешествие в мир кислот» кислота
- 9. Опорный конспект «Путешествие в мир кислот»
- 10. Пример: С какими из перечисленных веществ вступает
- 11. Станция Экспериментальная Задание №1Исследуйте раствор угольной кислоты.
- 12. Л.О.№1.(Учащиеся 1 ряда исследуют действие на индикаторы
- 13. Станция Индикаторная Хочу все знать!
- 14. Химический кроссворд По горизонтали: 1. Вещества, в
- 15. Задание №1 Напишите уравнения реакций, позволяющих осуществить
Слайд 1 Сюжетно-ролевой урок
Учитель химии, МКОУ «Центр образования» г. Михайловск, Ставропольский край
«Путешествие
Слайд 2Маршрут путешествия:
Станция Информационная
Станция Историческая
Станция Дегустационная
Станция «Стоп! Красный свет!»
Станция Экспериментальная
Станция Индикаторная
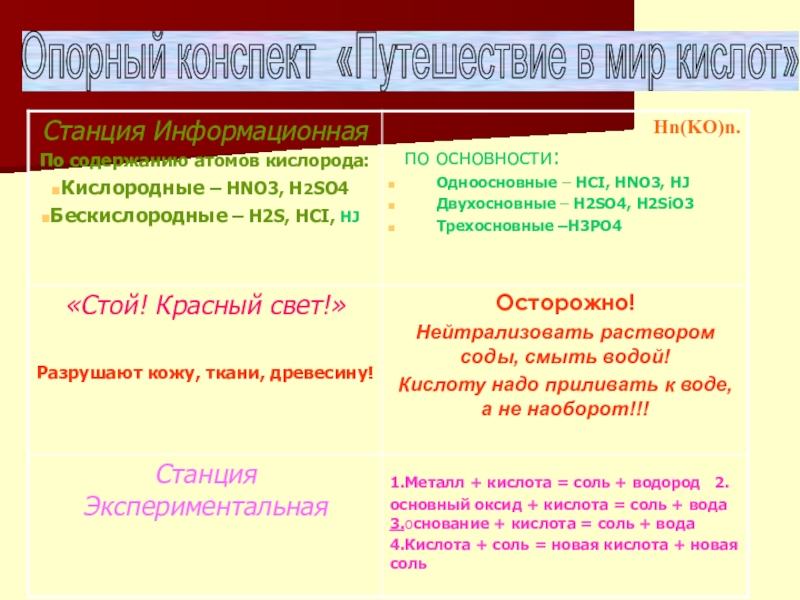
Слайд 3Станция информационная
Кислоты постоянно присутствуют вокруг нас – это и дождевая
Общая схема кислоты :Нn(KO)n.
Слайд 4Станция информационная
Если в состав кислотного остатка входит кислород, такая кислота
Слайд 5
Получение азотной кислоты.
4NH3 + 5O2 = 4NO + 6H2O
4NO + 2O2
4NO2 + O2 + 2Н2О = 4HNO3
HNO3- бесцветная, очень едкая жидкость. Концентрированная кислота, 69,2%-ная HNO3 с плотностью 1,41 г/м3, относительно легко отдает кислород.
Соберем установку, изображенную на рисунке. Для того, чтобы приготовить катализатор, добавим по каплям раствор хлорида железа(III) к раствору гидроксида аммония. При этом выпадает коричневый осадок гидроксида железа(III). Отфильтруем его, промоем на фильтре холодной водой, смешаем сырую еще массу с асбестом (можно отщипнуть волокна от подставки под утюг, использовать кусочек асбестового шнура и т.п.) и сильно прокалим массу. При этом на асбесте выделится оксид железа(III).
Пропустим сначала через установку поток воздуха (кран I открыт, кран II закрыт) с помощью водоструйного насоса (в крайнем случае достаточно применить для отсоса воздуха резиновый вентилятор) и сильно нагреем катализатор. Затем закроем кран I и откроем кран II. Поток воздуха увлекает аммиак, который после сушки в U-образной трубке с негашеной известью СаО окисляется на катализаторе с образованием оксида азота.
А он, взаимодействуя в конической колбе (так называемая колба Эрленмейера) с кислородом воздуха, превращается в диоксид азота.
Наконец, в пробирке с боковой насадкой образуется азотная кислота. Хотя она очень разбавлена, мы можем обнаружить кислую среду с помощью лакмусовой бумажки. Смотри далее…
Станция историческая
Слайд 6
Кислоты - это сложные вещества, в состав которых обязательно входят атомы
Например:
Станция дегустационная
Большинство кислот кислые на вкус.
Вывод:
HCl, HBr, H2S, H2SO3, HF, H2CO3, НNО3,HI, H2SiO3
Я расскажу вам о пользе кислот,
Может, не знает о них наш народ.
Если ты проглотил аскорбинку,
Твой организм получил витаминку.
Она закрывает болезням врата –
Аскорбиновая кислота
Вы простудились – болит голова,
Вас аспирин выручает всегда.
Ну и, бесспорно, полезен лимон,
Кислотою лимонной наполнен он.
Жуйте лимон, если горло болит,
Сок чудотворный вас исцелит.
Яблоко ешь — кислый вкус, красота,
В яблоке – яблочная кислота.
Яблочный уксус по ложке пейте,
Вы обязательно похудеете.
Уксус столовый на кухне хранится –
Для консервации он пригодится.
Какая кислота находится в желудке у человека?
(Соляная кислота-HCl.)
Слайд 7
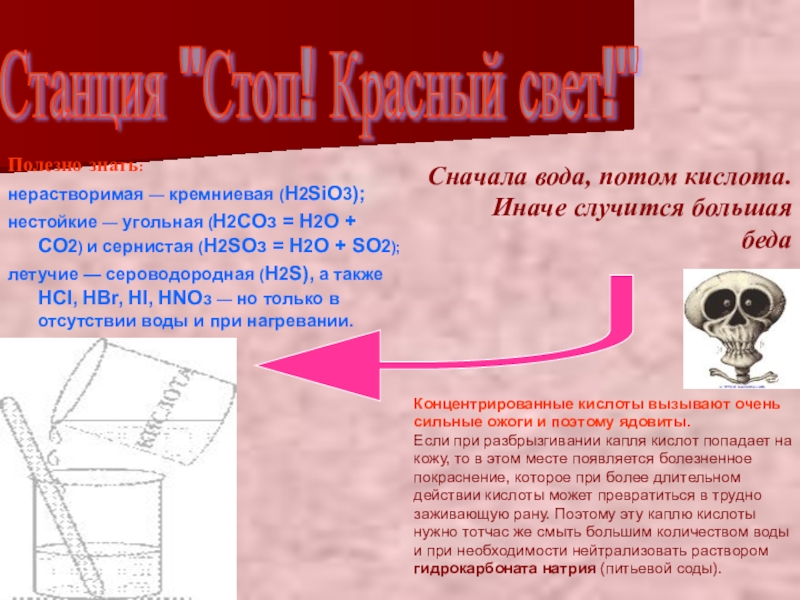
Полезно знать:
нерастворимая — кремниевая (H2SiO3);
нестойкие — угольная (Н2СОз = H2O
летучие — сероводородная (H2S), а также НСl, HBr, HI, НNОз — но только в отсутствии воды и при нагревании.
Сначала вода, потом кислота. Иначе случится большая беда
Станция "Стоп! Красный свет!"
Концентрированные кислоты вызывают очень сильные ожоги и поэтому ядовиты.
Если при разбрызгивании капля кислот попадает на кожу, то в этом месте появляется болезненное покраснение, которое при более длительном действии кислоты может превратиться в трудно заживающую рану. Поэтому эту каплю кислоты нужно тотчас же смыть большим количеством воды и при необходимости нейтрализовать раствором гидрокарбоната натрия (питьевой соды).
Слайд 10
Пример: С какими из перечисленных веществ вступает в реакцию НCI (соляная)
Определяем принадлежность заданных в условий веществ к соответствуюцим классам и тут же проверяем, реагируют ли они с кислотами. Получается:
Na2О — основный оксид — реагирует (получается соль и вода);
Ag — металл, находящийся в ряду активности после водорода, — не реагирует;
SOз — кислотный оксид — не реагирует;
Zn — металл, находящийся в ряду активности до водорода, — реагирует (получается соль и водород). 2. Чтобы составить уравнения реакций, определим валентность металлов (натрий — I, цинк — II) и составим формулы солей учитывая, что валентность кислотного остатка Сl составляет I. Осталось записать уравнения реакций:
Na2О + 2НСl = 2NaCl + Н2О; Zn + 2НСl= ZnCl2 + H2.
Станция Экспериментальная
кислоты реагируют с цинком
кислоты не реагируют с медью
Запомните: При составлении уравнений реакций не забывать, что водород выделяется в виде двухатомных молекул Н2
Металл + кислота = соль + водород
AI+HCI=AICI3+H2
Слайд 11Станция Экспериментальная
Задание №1
Исследуйте раствор угольной кислоты. Для этого:
Налейте в
В каждую добавьте по 1 капле лакмуса.
Получите СО2.
В одну пробирку с лакмусом пропускайте полученный газ, вторую оставьте для сравнения.
Что наблюдаете?
Как изменяется окраска лакмуса?
Почему?
Какой вывод о силе угольной кислоты можно сделать?
Составьте уравнения реакций, подтверждающие ваши выводы.
Вывод: угольная кислота является слабой, что подтверждает розовая окраска лакмуса, а не красная, как в растворах сильных кислот.
Задание №2
Проделайте качественную реакцию для солей угольной кислоты.
Для этого:
1. Налейте в пробирку 2 мл раствора K2CO3.
2. Добавьте по каплям HCl.
3. Что наблюдаете?
4. Составьте уравнения реакций в ионном виде.
5. Проделайте то же самое для NaHCO3
Вывод: соли угольной кислоты легко можно определить при помощи сильных кислот. Будучи одной из самых слабых кислот она легко вытесняется из солей более сильными кислотами.
Слайд 12
Л.О.№1.
(Учащиеся 1 ряда исследуют действие на индикаторы раствора HCl, 2 ряда
Станция Индикаторная
Загадка.
Попасть в кислоту – есть ли горше удача?
Но он перетерпит без вздохов, без плача.
Зато в щелочах у …………….
Начнется не жизнь, а сплошная малина.
(Фенолфталеин.) фильм.
Слайд 13Станция Индикаторная
Хочу все знать!
Кусочек природного мела
Это явление известное: кальций, входящий в состав мела, делает пламя красным. Но зачем кислота? Она, реагируя с мелом, образует растворимый хлорид кальция CaCl2, его брызги уносятся газами и попадают непосредственно в пламя - от этого опыт становится эффектнее.
К сожалению, такой опыт с прессованным школьным мелом не удается - в нем есть примесь соды (соли натрия), и пламя окрашивается в оранжевый цвет. Лучше всего опыт получается с кусочком белого мрамора, смоченного той же кислотой.
А убедиться в том, что соли натрия окрашивают пламя в интенсивный желтый цвет, вы сможете, внеся в пламя крупинку соли NaCl (или просто слегка "посолив" огонь). Смотрите далее….
Слайд 14Химический кроссворд
По горизонтали: 1. Вещества, в состав которых входит кислотный остаток.
По вертикали: 1. Газ, поддерживающий горение. 2. Соединения, состоящие из двух элементов, один из которых кислород. 4. Вещества, изменяющие цвет под действием кислот и щелочей.
7. Название реакции между кислотой и щелочью. 8. Смесь газов, в состав которой входят кислород, азот и некоторые другие.
Ответы на химический кроссворд
По горизонтали: 1. Кислоты. 3. Соли. 5. Вода. 6. Основания.
8. Водород. 9. Азот.
По вертикали: 1. Кислород. 2. Оксиды. 4. Индикаторы.
7. Нейтрализация. 8. Воздух.
Слайд 15
Задание №1 Напишите уравнения реакций, позволяющих осуществить превращения по схемам:
Задание
Вопросы для дискуссии
Что же такое кислотный дождь?
Неужели только человек – виновник кислотного дождя?
А может быть человек все-таки виноват в образовании кислотных дождей?
Насколько же велика вина человека? Вывод…
Закрепление
Домашнее задание: выучить кислоты.