Турканова К.Ч.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему строение атома
Содержание
- 1. строение атома
- 2. АтомЭлементарлық бөлшектің төзімді микрожүйесі ядролық аяда салмақты оқтаулы ядродан және электрондерден құралады
- 3. Атомның ядросы протоннан және нейтрондардан құралады Протонның
- 4. Элементарлық бөлшектің ұяшықтарыБөлшек
- 5. A = Z + NA –атом
- 6. ХЛОР ИЗОТОПЫ
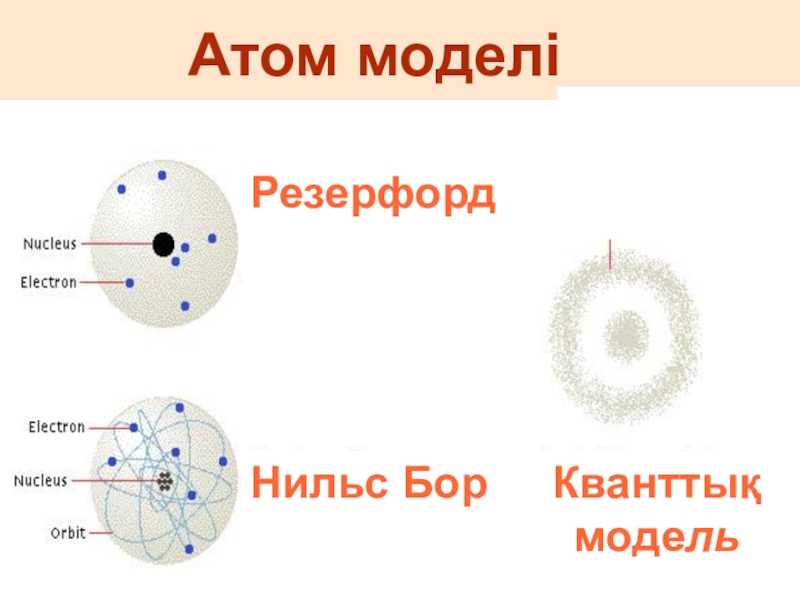
- 7. Атом моделіРезерфордНильс БорКванттық модель
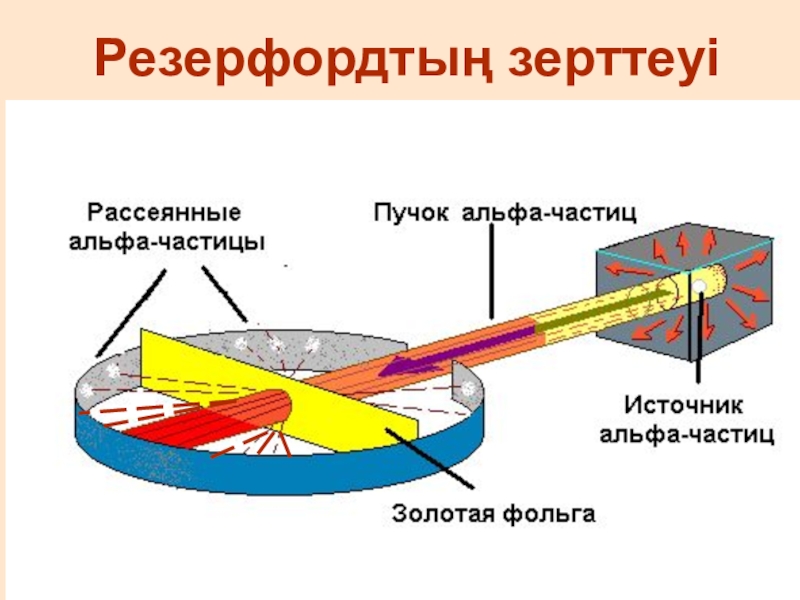
- 8. Резерфордтың зерттеуі
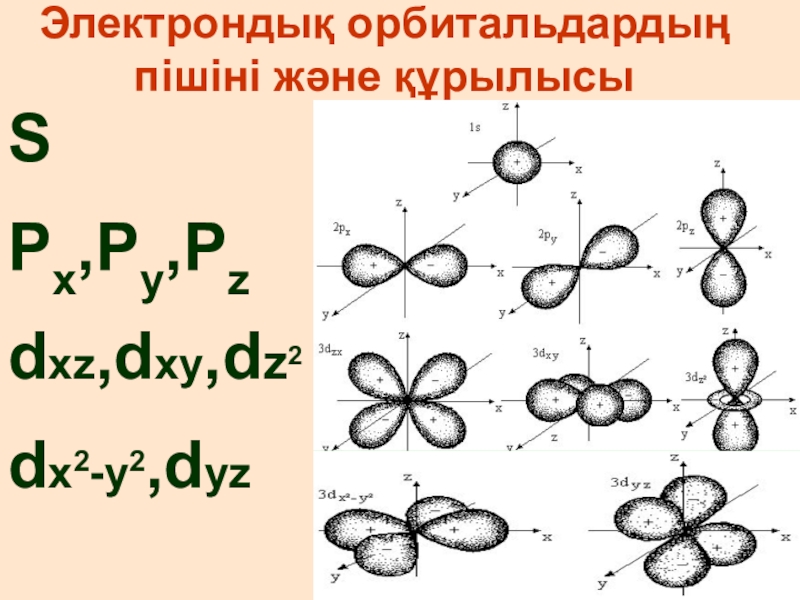
- 9. Электрондық орбитальдардың пішіні және құрылысы SPx,Py,Pz dxz,dxy,dz2 dx2-y2,dyz
- 10. Квант сандарыБас квант саныОрбиталь квант саны
- 11. Магниттік квант саны (ml) Орбитальдардың кеңістікте орналасуымен
- 12. Спин квант саны (ms). Электрондардың осінде қарама-қарсы
- 13. Электрондық құрылымның қалыптасу заңдылығыПаули ұстанымы:атомда квант саны
- 14. Клечковский ережесі бойынша электрон қабаттары
- 15. Атомдағы электрондардың орналасу тәртібі:Электрондық формулаГрафиктік-электрондық формулаларЭнергетикалық диаграмма
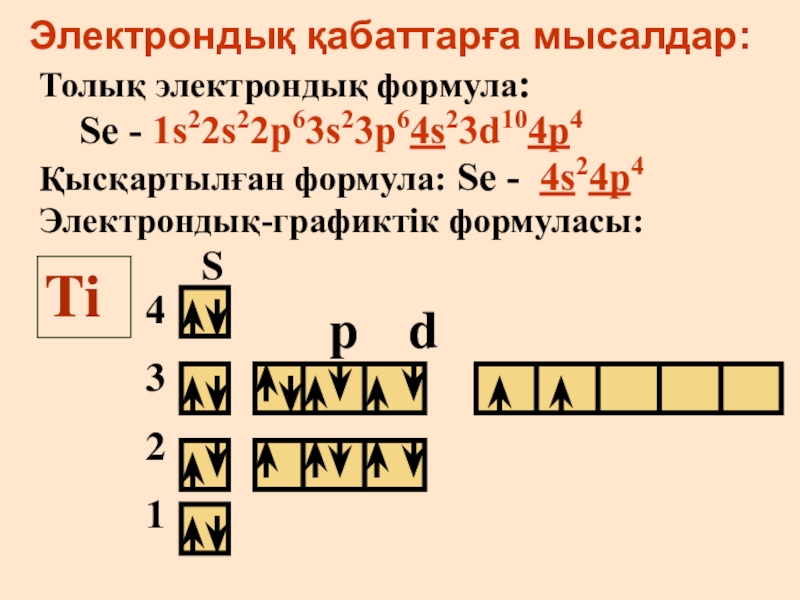
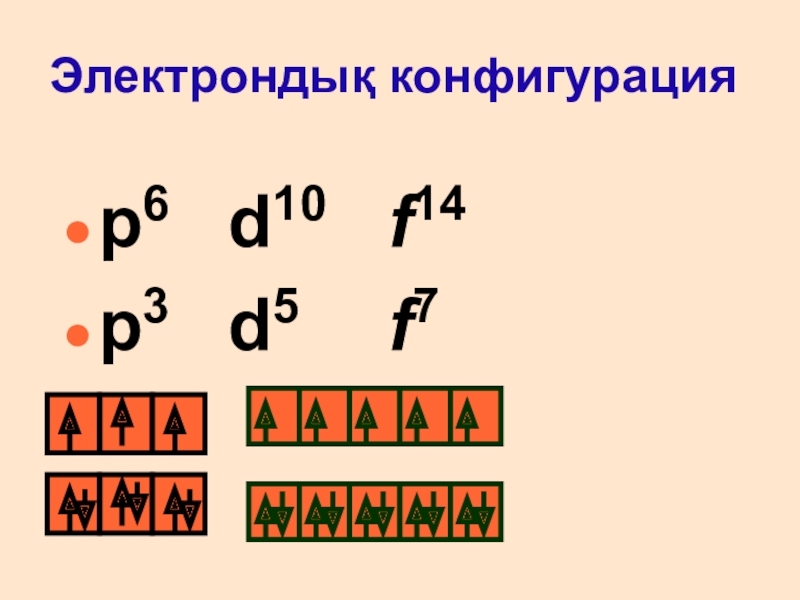
- 16. Электрондық қабаттарға мысалдар:Толық электрондық формула: Se - 1s22s22p63s23p64s23d104p4
- 17. Электрондық конфигурацияp6 d10 f14p3 d5 f7
- 18. Д.И. Менделеевтың (1869 ж.) периодтық жүйедегі элементтеріЭлементтердің
- 19. Қіші периодтар1 период (n=1): (2n2)2 элемент (1s2)2
- 20. Үлкен периодтар4 период (n=4): (2n2 -2*7)18 элемент
- 21. Период- сілтілік металдан басталып инертті газдардан аяқталатын
- 22. Топтар-қассиеттері ұқсас элементтер біріктіріліп тігінен орналасқан.Топтар негізгі(А)
- 23. Слайд 23
- 24. Элементтің периодты түрде өзгеретін қасиеттеріАтом радиусыИондану энергиясыЭлектрон тартқыштықэлектротерістілікЭлементтердің валенттілігі
- 25. R кішірейеді R үлкейеді
- 26. Катион мен анионның радиусыАтомның катионға айналуы -
- 27. Элементтің реттік нөміріне тәуелді атомдардың радиустарының өзгеруі
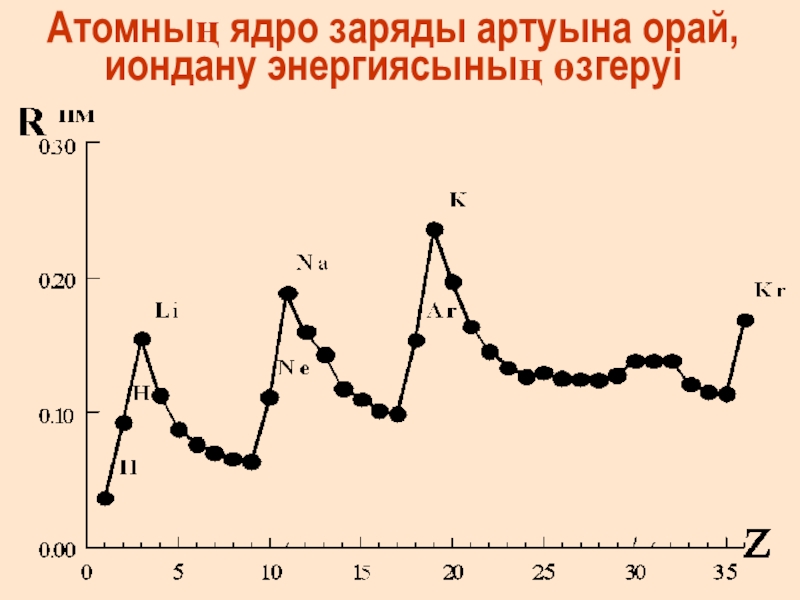
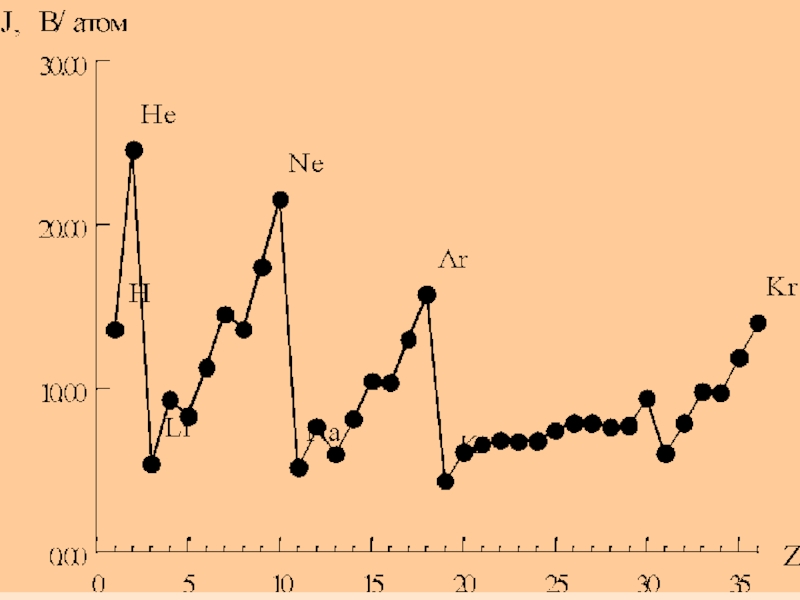
- 28. Атомның ядро заряды артуына орай, иондану энергиясының өзгеруі
- 29. Слайд 29
- 30. Валенттілік Валенттілік-бір элемент атомының басқа элемент
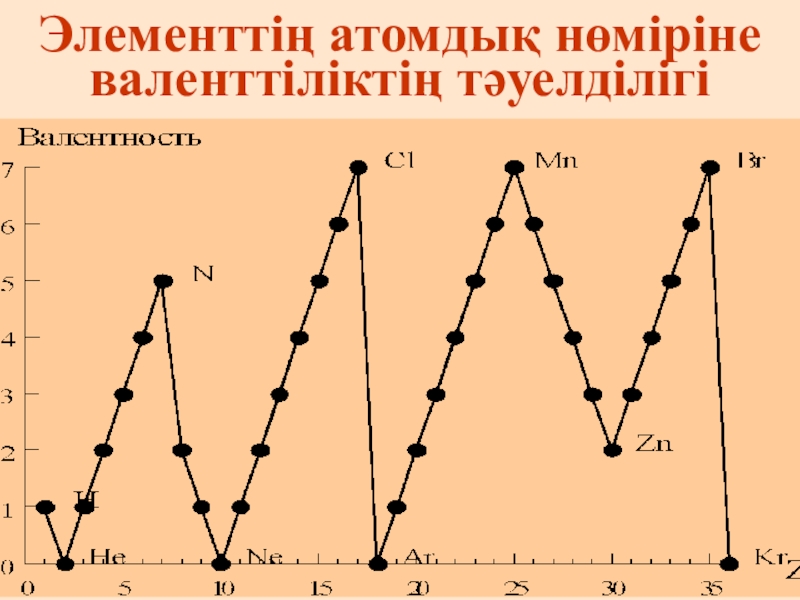
- 31. Элементтің атомдық нөміріне валенттіліктің тәуелділігі
- 32. Қышқылдық-негіздік қасиеттеріВ-к Қышқылдық қасиеттері ІІ
- 33. Жай заттар мен біртектік қосылыстардың қышқылдық қасиеттері:Периодта үлкейедіТопта кішірейеді
АтомЭлементарлық бөлшектің төзімді микрожүйесі ядролық аяда салмақты оқтаулы ядродан және электрондерден құралады
Слайд 1Тақырыбы:
Атомның құрылымы
«Серебрянск қаласының №4 орта мектебі» КММ
.
химия пәнінің мұғалімі:
Слайд 2Атом
Элементарлық бөлшектің төзімді микрожүйесі ядролық аяда салмақты оқтаулы ядродан және электрондерден
құралады
Слайд 3Атомның ядросы протоннан және нейтрондардан құралады
Протонның саны ядрода элементтің атомды
нөміріне және электроннің санының атомда тең
Атом- бейтарапты
Атом- бейтарапты
Слайд 4Элементарлық бөлшектің ұяшықтары
Бөлшек жағдай заряд масса
(у.е.)
Протон (p) ядро +1 1,00728
Нейтрон (n) ядро 0 1,00867
Позитрон (е) ядро +1 0,00055
Электрон(е) қабат-1 0,00055
Протон (p) ядро +1 1,00728
Нейтрон (n) ядро 0 1,00867
Позитрон (е) ядро +1 0,00055
Электрон(е) қабат-1 0,00055
Слайд 11Магниттік квант саны (ml)
Орбитальдардың кеңістікте орналасуымен сипатталады.
ml ауысыды –l-дан +l-ға
дейін, = 2l + 1
Мысалы:l = 0 (s); ml = 0
l = 1 (p); ml = 0, +1, -1
Мысалы:l = 0 (s); ml = 0
l = 1 (p); ml = 0, +1, -1
Слайд 12Спин квант саны (ms).
Электрондардың осінде қарама-қарсы бағытта ұрщық тәрізді айналу
қабілеті бар.Ол екі мәнді қабылдауы мүмкін.
ms S=+1/2 немесе-1/2
ms S=+1/2 немесе-1/2
Слайд 13Электрондық құрылымның қалыптасу заңдылығы
Паули ұстанымы:атомда квант саны бірдей екі электронның болуы
мүмкін емес.Әрбір орбитальда қарама-қарсы спинді 2e ғана болуы мүмкін.
N=2n2
N=2n2
Слайд 14
Клечковский ережесі бойынша электрон қабаттары мынадай қатарда орналасу керек:
1sι 2s2pι 3s3pι
4s3d4pι 5s4d5pι 6s4f5d6pι 7s5f6d7p
Слайд 15Атомдағы электрондардың орналасу тәртібі:
Электрондық формула
Графиктік-электрондық формулалар
Энергетикалық диаграмма
Слайд 16Электрондық қабаттарға мысалдар:
Толық электрондық формула:
Se - 1s22s22p63s23p64s23d104p4
Қысқартылған формула:
Se - 4s24p4
Электрондық-графиктік формуласы:
Электрондық-графиктік формуласы:
Ti
p d
S
4
3
2
1
Слайд 18Д.И. Менделеевтың (1869 ж.) периодтық жүйедегі элементтері
Элементтердің қасиеттері, сонымен қатар құрылымы
және олардың қосылу қасиеттері олардың атомдық салмақтарына байланысты периодтық тәуелділікте орналасқан
Слайд 19Қіші периодтар
1 период (n=1): (2n2)
2 элемент (1s2)
2 период (n=2): (2n2)
8 элемент
(2s22p6)
3 период (n=3): (2n2 – 2*5)
8 элемент (3s23p6)
3 период (n=3): (2n2 – 2*5)
8 элемент (3s23p6)
Слайд 20Үлкен периодтар
4 период (n=4): (2n2 -2*7)
18 элемент (4s23d104p6)
5 период (n=5): (2n2
-2(7 + 9) )
18 элемент (5s24d105p6)
6 период (n=6): (2n2 -2(9 + 11) )
32 элемент (6s24f145d106p6)
7 период (n=7): (2n2 -2(9 + 11 + 13) )
32 элемент (7s25f146d107p6), аяқталмаған
18 элемент (5s24d105p6)
6 период (n=6): (2n2 -2(9 + 11) )
32 элемент (6s24f145d106p6)
7 период (n=7): (2n2 -2(9 + 11 + 13) )
32 элемент (7s25f146d107p6), аяқталмаған
Слайд 21Период- сілтілік металдан басталып инертті газдардан аяқталатын көлденең қатар,онда элементтер Ar-ның
арту ретімен орналастырылған.
Периодтық жүйеде 7период бар.
Периодтық жүйеде 7период бар.
Слайд 22Топтар-қассиеттері ұқсас элементтер біріктіріліп тігінен орналасқан.Топтар негізгі(А) және қосымша(В) болып 2
бөлінеді:негізгі топшада кіші де, үлкен де периодтардың элементтері;қосымша топшаларда-тек қана үлкен периодтардың элементтері орналасады.
Слайд 24Элементтің периодты түрде өзгеретін қасиеттері
Атом радиусы
Иондану энергиясы
Электрон тартқыштық
электротерістілік
Элементтердің валенттілігі
Слайд 26Катион мен анионның радиусы
Атомның катионға айналуы - орбитальдық радиустың күрт кішірейуі
Атомның
анионға айналуы орбитальдық радиусы өзгермейді
Rкат < Rат < Rан
Cl+ < Cl < Cl–
0,099 0,181нм
Rкат < Rат < Rан
Cl+ < Cl < Cl–
0,099 0,181нм
Слайд 30 Валенттілік
Валенттілік-бір элемент атомының басқа элемент атомын қосып алу қабілеті.
Ол шаманың сандық мәні элементтің байланыс түзуге жұмсалатын дара электрондар сандарымен анықталады. Ол рим цифрларымен белгіленеді, сандық мәні 1-ден 8-ге дейін өзгереді.
Слайд 32Қышқылдық-негіздік қасиеттері
В-к Қышқылдық қасиеттері
ІІ ІІ
ІІІ ІІ ІV ІІ VІ ІІ VІІ ІІ
MnO Mn2O3 MnO2 MnO3 Mn2O7
нег. әлсіз нег. амфот. қышл. қышл.
MnO Mn2O3 MnO2 MnO3 Mn2O7
нег. әлсіз нег. амфот. қышл. қышл.