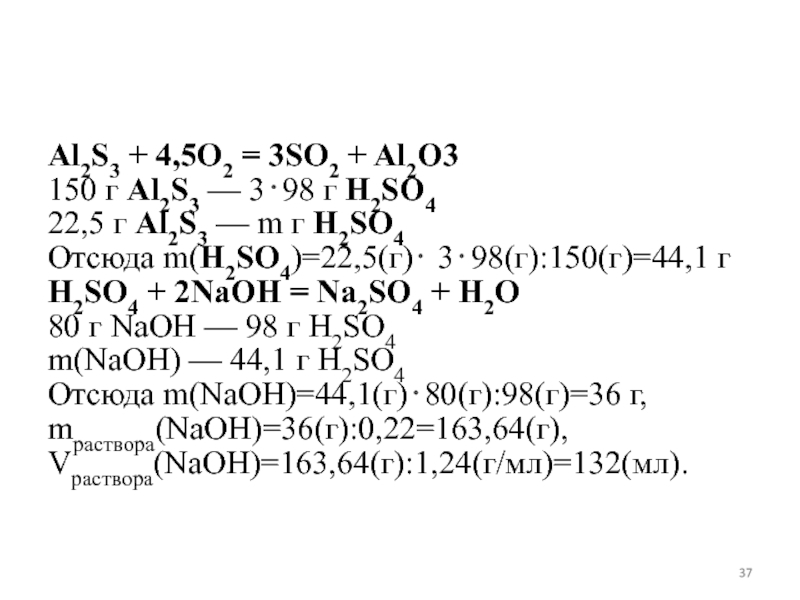Массовая доля. Эквивалент. Вывод формулы вещества
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Стратегия решения олимпиадных задач по химии. Массовая доля. Эквивалент. Вывод формулы вещества
Содержание
- 1. Стратегия решения олимпиадных задач по химии. Массовая доля. Эквивалент. Вывод формулы вещества
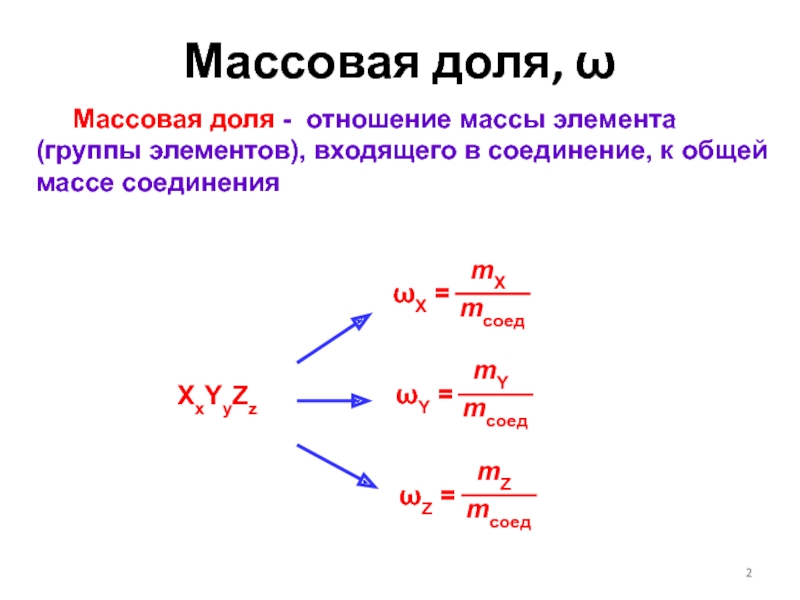
- 2. Массовая доля, ω Массовая доля
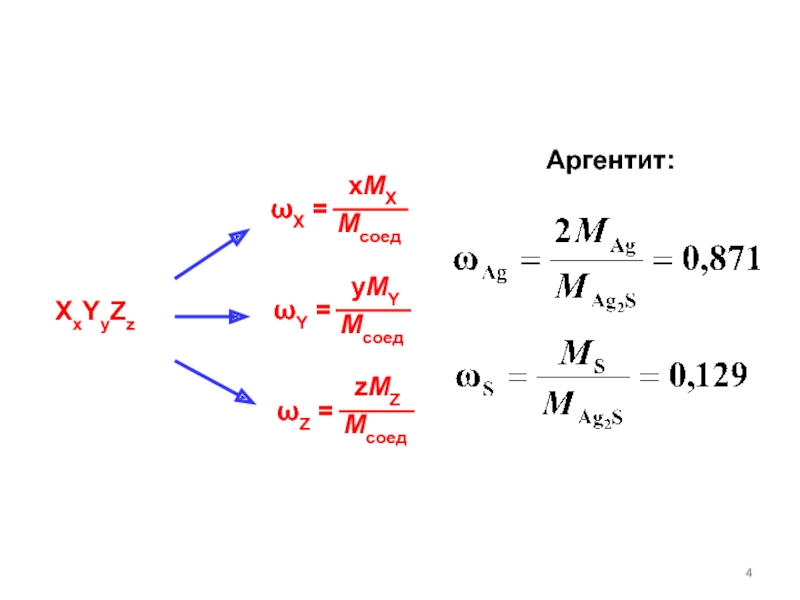
- 3. Аргентит Ag2SСереброСера
- 4. XxYyZzωX = MсоедxMXωZ = MсоедzMZωY = MсоедyMYАргентит:
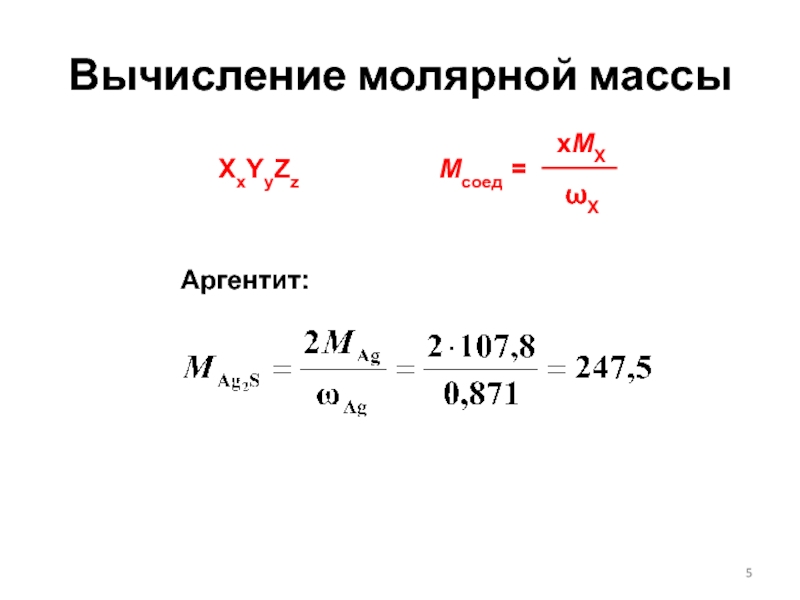
- 5. Вычисление молярной массыXxYyZzωXMсоед =xMXАргентит:
- 6. Определение индексов в формулахXxYyZzx:y:z = ωX MX:ωY MY:ωZ MZАргентит (AgxSy):
- 7. Самые простые задачи, которые только можно придуматьЖелезо
- 8. Самые простые задачи, которые только можно придуматьЖелезо
- 9. Самые простые задачи, которые только можно придуматьХимический
- 10. Самые простые задачи, которые только можно придуматьХимический
- 11. Самые простые задачи, которые только можно придуматьОпределить
- 12. Самые простые задачи, которые только можно придуматьОпределить
- 13. Самые простые задачи, которые только можно придуматьХлорид некоторого металла содержит 74,7% хлора; определите неизвестный металл.
- 14. Самые простые задачи, которые только можно придуматьХлорид
- 15. Самые простые задачи, которые только можно придуматьСоль,
- 16. Самые простые задачи, которые только можно придуматьСоль,
- 17. Самые простые задачи, которые только можно придуматьНеорганическое
- 18. Самые простые задачи, которые только можно придуматьНеорганическое
- 19. Эквивалент и молярная массаЭквивалент (Э) – это
- 20. Эквивалент и молярная массаОпределить эквивалент веществ:Серная кислотаАзотная
- 21. Эквивалент и молярная массаЕсли в реакции принимает
- 22. Закон эквивалентовИеремия Вениамин РИХТЕР(1762 – 1807)
- 23. Закон эквивалентовAxBy+y -xwA ЭАwВ ЭВ=ЭА = МА/yЭВ = МВ/xωA = xMA+yMBxMA=MA=yMAyMВх+ЭA+ЭBЭAωВ = xMA+yMByMВ=MB=xMAyMВх+ЭA+ЭBЭB
- 24. Молекулярная масса
- 25. При растворении в воде 1,6 г металла выделилось 0,896 л (н.у.) водорода. Определить эквивалент металла.
- 26. При растворении в воде 1,6 г металла выделилось 0,896 л (н.у.) водорода. Определить эквивалент металла.РЕШЕНИЕ:
- 27. Для нейтрализации 5,8 г кислоты, образованной
- 28. Для нейтрализации 5,8 г кислоты, образованной
- 29. Две пластинки с одинаковой массой и
- 30. Две пластинки с одинаковой массой и
- 31. При сжигании 1,44 г вещества образовалось
- 32. При сжигании 1,44 г вещества образовалось
- 33. При взаимодействии 3,42 г щелочного металла
- 34. При сжигании 1,44 г вещества образовалось
- 35. Районная олимпиада 2000 г. 9 классПри обжиге
- 36. РЕШЕНИЕ:Обозначим неизвестный металл – М, тогда
- 37. Al2S3 + 4,5O2 = 3SO2 + Al2O3150
- 38. Санкт-Петербургская олимпиада 2000 г. 9 классПри взаимодействии
- 39. РешениеПервую реакцию можно представить в виде:MHal +
- 40. Минерал гессит содержит 37,2% теллура. Определите формулу гессита.
- 41. РешениеПредположим, что гессит содержит только один атом
- 42. Районная олимпиада 2001 г. 10 класс Хлорпроизводное
- 43. РешениеВ соединении содержится 100 – (63,89 +
- 44. Санкт-Петербургская олимпиада 2000 г. 9 класс
- 45. РешениеОпределим эквивалентную массу металла:25,2 (г) Ме —
- 46. Санкт-Петербургская олимпиада 2000 г. 9 классПростое вещество
- 47. РешениеПри взаимодействии вещества А со щелочью могут
- 48. Вещество А не может быть литием, т.к.
- 49. Санкт-Петербургская олимпиада 2000 г. 9 классМонету чеканки
- 50. РешениеМасса основного компонента монеты: 3,28 – 0,28
- 51. Санкт-Петербургская олимпиада 2000 г. 9 классХимическое соединение,
- 52. РешениеОчевидно, что Х – это некоторый металл.
- 53. ПОтвет: Li2SO4 ∙ H2O
Массовая доля, ω Массовая доля - отношение массы элемента (группы элементов), входящего в соединение, к общей массе соединенияXxYyZzωX = mсоедmXωZ = mсоедmZωY = mсоедmY
Слайд 1Стратегия решения олимпиадных задач по химии
Воронаев И.Г.
п.д.о. ЭБЦ «Крестовский остров»
Занятие 1-2.
Слайд 2Массовая доля, ω
Массовая доля - отношение массы элемента
(группы элементов), входящего в соединение, к общей массе соединения
XxYyZz
ωX =
mсоед
mX
ωZ =
mсоед
mZ
ωY =
mсоед
mY
Слайд 7Самые простые задачи, которые только можно придумать
Железо образует с кислородом три
оксида. Один из них содержит 77,8% железа, другой - 70,0% и третий - 72,4%. Определите формулы оксидов.
Слайд 8Самые простые задачи, которые только можно придумать
Железо образует с кислородом три
оксида. Один из них содержит 77,8% железа, другой - 70,0% и третий - 72,4%. Определите формулы оксидов.
РЕШЕНИЕ:
Запишем формулу оксида железа в общем случае: FexOy.
Найдем отношение х : у и, приводя к целочисленному отношению, определим формулы оксидов.
РЕШЕНИЕ:
Запишем формулу оксида железа в общем случае: FexOy.
Найдем отношение х : у и, приводя к целочисленному отношению, определим формулы оксидов.
Слайд 9Самые простые задачи, которые только можно придумать
Химический анализ соединения азота с
водородом, имеющего относительную молекулярную массу 32, показал, что массовая доля азота в соединении равна 66%. Верно ли был проведен анализ?
Слайд 10Самые простые задачи, которые только можно придумать
Химический анализ соединения азота с
водородом, имеющего относительную молекулярную массу 32, показал, что массовая доля азота в соединении равна 66%. Верно ли был проведен анализ?
РЕШЕНИЕ:
Если химический анализ проведен верно, то молекула данного соединения азота с водородом должна содержать:
Число атомов в молекуле не может быть дробным, поэтому анализ проведен неверно.
РЕШЕНИЕ:
Если химический анализ проведен верно, то молекула данного соединения азота с водородом должна содержать:
Число атомов в молекуле не может быть дробным, поэтому анализ проведен неверно.
Слайд 11Самые простые задачи, которые только можно придумать
Определить формулу вещества, содержащего 1,22
массов. части калия; 1,11 массов. части хлора и 2,00 массов. части кислорода. Существуют ли еще вещества того же качественного состава? Что вы можете сказать (на языке формул) об их количественном составе?
Слайд 12Самые простые задачи, которые только можно придумать
Определить формулу вещества, содержащего 1,22
массов. части калия; 1,11 массов. части хлора и 2,00 массов. части кислорода. Существуют ли еще вещества того же качественного состава?
РЕШЕНИЕ:
Для нахождения количественного состава разделим массовые части элементов на их относительные атомные массы:
т. е. формула искомого вещества КСlО4 (перхлорат калия).
Эти же элементы содержатся в гипохлорите калия КСlO, хлорите калия КСlО2, хлорате калия КСlO3.
РЕШЕНИЕ:
Для нахождения количественного состава разделим массовые части элементов на их относительные атомные массы:
т. е. формула искомого вещества КСlО4 (перхлорат калия).
Эти же элементы содержатся в гипохлорите калия КСlO, хлорите калия КСlО2, хлорате калия КСlO3.
Слайд 13Самые простые задачи, которые только можно придумать
Хлорид некоторого металла содержит 74,7%
хлора; определите неизвестный металл.
Слайд 14Самые простые задачи, которые только можно придумать
Хлорид некоторого металла содержит 74,7%
хлора; определите неизвестный металл.
РЕШЕНИЕ:
Формула хлорида в общем виде МеСln , где n - целое; тогда
Титан и магний
РЕШЕНИЕ:
Формула хлорида в общем виде МеСln , где n - целое; тогда
Титан и магний
Слайд 15Самые простые задачи, которые только можно придумать
Соль, содержащая некоторый элемент X,
имеет следующее массовое соотношение элементов
X : Н : N : О = 12 : 5 : 14 : 48.
Какова формула этой соли?
X : Н : N : О = 12 : 5 : 14 : 48.
Какова формула этой соли?
Слайд 16Самые простые задачи, которые только можно придумать
Соль, содержащая некоторый элемент X,
имеет следующее массовое соотношение элементов
X : Н : N : О = 12 : 5 : 14 : 48.
Какова формула этой соли?
РЕШЕНИЕ:
Пусть формула соли HaNbOcXd. Тогда можно записать соотношение
где Ar(Х) – относительная атомная масса неизвестного элемента.
X : Н : N : О = 12 : 5 : 14 : 48.
Какова формула этой соли?
РЕШЕНИЕ:
Пусть формула соли HaNbOcXd. Тогда можно записать соотношение
где Ar(Х) – относительная атомная масса неизвестного элемента.
Слайд 17Самые простые задачи, которые только можно придумать
Неорганическое вещество состоит из трёх
элементов, один из которых кислород, а два других – неизвестны (обозначим их Х и У). Известно, что массовая доля кислорода в этом соединении равна 0,653, а элемента Х – 0,031. Определите формулу вещества, зная, что атом элемента Х в 31 раз легче атома У, а атом элемента У в 1,93 раза тяжелее атома кислорода.
Слайд 18Самые простые задачи, которые только можно придумать
Неорганическое вещество состоит из трёх
элементов, один из которых кислород, а два других – неизвестны (обозначим их Х и Y). Известно, что массовая доля кислорода в этом соединении равна 0,653, а элемента Х – 0,031. Определите формулу вещества, зная, что атом элемента Х в 31 раз легче атома Y, а атом элемента Y в 1,93 раза тяжелее атома кислорода.
РЕШЕНИЕ:
Переведём массовые доли элементов в проценты, найдем массовую долю элемента Y. Она равна 31,6%.
Найдём относительную атомную массу элемента Y, она равна 31, значит этот элемент фосфор.
Найдём элемент Х, который в 31 раз легче Y. Установим элемент водород.
Учтём массовые доли элементов:
O : H : P
65, 3 : 16 3,1 : 1 31,6 : 31
Получим соотношения элементов 4 : 3 : 1
Выведем формулу H3PO4 – ортофосфорная кислота
РЕШЕНИЕ:
Переведём массовые доли элементов в проценты, найдем массовую долю элемента Y. Она равна 31,6%.
Найдём относительную атомную массу элемента Y, она равна 31, значит этот элемент фосфор.
Найдём элемент Х, который в 31 раз легче Y. Установим элемент водород.
Учтём массовые доли элементов:
O : H : P
65, 3 : 16 3,1 : 1 31,6 : 31
Получим соотношения элементов 4 : 3 : 1
Выведем формулу H3PO4 – ортофосфорная кислота
Слайд 19Эквивалент и молярная масса
Эквивалент (Э) – это такое весовое количество вещества,
которое в химической реакции может замещать, вытеснять или присоединять 1 в.ч. водорода, 8 в.ч. кислорода или эквивалентное количество другого элемента.
Эквивалентная масса – это количество граммов вещества, численно равное его эквиваленту.
Эквивалентная масса – это количество граммов вещества, численно равное его эквиваленту.
Слайд 20Эквивалент и молярная масса
Определить эквивалент веществ:
Серная кислота
Азотная кислота
Гидроксид алюминия
Сульфат железа (III)
Оксид
марганца (IV)
Определить эквиваленты веществ участвующих в реакции:
2NaOH + H3PO4 = Na2HPO4 + 2H2O
MnO4- + 8H+ + 5ē → Mn2+ + 4H2O
2Fe + 3Cl2 = 2FeCl3
Определить эквиваленты веществ участвующих в реакции:
2NaOH + H3PO4 = Na2HPO4 + 2H2O
MnO4- + 8H+ + 5ē → Mn2+ + 4H2O
2Fe + 3Cl2 = 2FeCl3
Слайд 21Эквивалент и молярная масса
Если в реакции принимает участие газообразное вещество, то
не обязательно пересчитывать объемные единицы в весовые: можно пользоваться эквивалентным объемом (аналогично молярному объему).
Определите эквиваленты газообразных водорода, кислорода, хлора.
Определите эквиваленты газообразных водорода, кислорода, хлора.
Слайд 22Закон эквивалентов
Иеремия Вениамин РИХТЕР
(1762 – 1807)
«Если одно и то
же количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа оснований, то количества последних эквивалентьны и нейтрализуются одним и тем же количеством другой кислоты
И.В.Рихтер (1792)
Современная формулировка
Элементы соединяются между собой в весовых отношениях пропорциональных их химическим эквивалентам.
И.В.Рихтер (1792)
Современная формулировка
Элементы соединяются между собой в весовых отношениях пропорциональных их химическим эквивалентам.
AxBy
+y -x
wA ЭА
wВ ЭВ
=
ЭА = МА/y
ЭВ = МВ/x
Слайд 23Закон эквивалентов
AxBy
+y -x
wA ЭА
wВ ЭВ
=
ЭА = МА/y
ЭВ = МВ/x
ωA
=
xMA+yMB
xMA
=
MA
=
y
MA
y
MВ
х
+
ЭA+ЭB
ЭA
ωВ =
xMA+yMB
yMВ
=
MB
=
x
MA
y
MВ
х
+
ЭA+ЭB
ЭB
Слайд 25 При растворении в воде 1,6 г металла выделилось 0,896 л
(н.у.) водорода. Определить эквивалент металла.
Слайд 26 При растворении в воде 1,6 г металла выделилось 0,896 л
(н.у.) водорода. Определить эквивалент металла.
РЕШЕНИЕ:
РЕШЕНИЕ:
Слайд 27 Для нейтрализации 5,8 г кислоты, образованной элементом VI группы израсходовали
40 мл 2 моль/экв.л раствора едкого натра. Определите кислоту.
Слайд 28 Для нейтрализации 5,8 г кислоты, образованной элементом VI группы израсходовали
40 мл 2 моль/экв.л раствора едкого натра. Определите кислоту.
РЕШЕНИЕ:
РЕШЕНИЕ:
Слайд 29 Две пластинки с одинаковой массой и изготовленные из металла, образующего
двузарядные ионы, погрузили одну в раствор сульфата меди, другую – в раствор сульфата ртути. Через некоторое время масса первой пластинки уменьшилась на 3,6%, а масса второй пластинки увеличилась на 6,675%. Уменьшение молярной концентрации обоих растворов было одинаковым. Определите название металла
Слайд 30 Две пластинки с одинаковой массой и изготовленные из металла, образующего
двузарядные ионы, погрузили одну в раствор сульфата меди, другую – в раствор сульфата ртути. Через некоторое время масса первой пластинки уменьшилась на 3,6%, а масса второй пластинки увеличилась на 6,675%. Уменьшение молярной концентрации обоих растворов было одинаковым. Определите название металла
РЕШЕНИЕ:
РЕШЕНИЕ:
Слайд 31 При сжигании 1,44 г вещества образовалось 0,53 г соды; 1,456
л CO2 и 0,45 г воды. Определить молекулярную формулу вещества.
Слайд 32 При сжигании 1,44 г вещества образовалось 0,53 г соды; 1,456
л CO2 и 0,45 г воды. Определить молекулярную формулу вещества.
РЕШЕНИЕ:
РЕШЕНИЕ:
Слайд 33 При взаимодействии 3,42 г щелочного металла с водой образовалось 448
мл водорода (н. у.). Какой металл вступил в реакцию?
Слайд 34 При сжигании 1,44 г вещества образовалось 0,53 г соды; 1,456
л CO2 и 0,45 г воды. Определить молекулярную формулу вещества.
РЕШЕНИЕ:
Уравнение протекающей реакции:
2Me + 2HOH = 2MeOH + H2↑
Переведём объём водорода в литры: 448 мл – 0,448 л
Найдём количество вещества водорода:
v(H2) = 0,448 л : 22,4 л/моль = 0,02 моль
По уравнению реакции найдём количество вещества щелочного металла:
v(Ме) = 0, 04 моль
Установим молярную массу металла:
М(Ме) = m : v = 3,42 г: 0,04 моль = 85,5 г/моль
По таблице Менделеева установим щелочной металл.
Это рубидий – Rb.
Mr (Rb) = 85,5 г/моль
РЕШЕНИЕ:
Уравнение протекающей реакции:
2Me + 2HOH = 2MeOH + H2↑
Переведём объём водорода в литры: 448 мл – 0,448 л
Найдём количество вещества водорода:
v(H2) = 0,448 л : 22,4 л/моль = 0,02 моль
По уравнению реакции найдём количество вещества щелочного металла:
v(Ме) = 0, 04 моль
Установим молярную массу металла:
М(Ме) = m : v = 3,42 г: 0,04 моль = 85,5 г/моль
По таблице Менделеева установим щелочной металл.
Это рубидий – Rb.
Mr (Rb) = 85,5 г/моль
Слайд 35Районная олимпиада 2000 г.
9 класс
При обжиге сульфида трехвалентного металла массой 22,5
г было израсходовано 15,12 л (н.у.) кислорода. Полученный газ был окислен в присутствии катализатора, продукт этой реакции растворен в воде и полностью нейтрализован раствором гидроксида натрия. Определите:
а) Какой объем 22%-ного раствора гидроксида натрия (плотность 1,24) потребуется для полной нейтрализации водного раствора продукта каталитического окисления?
б) Сульфид какого металла подвергался обжигу?
а) Какой объем 22%-ного раствора гидроксида натрия (плотность 1,24) потребуется для полной нейтрализации водного раствора продукта каталитического окисления?
б) Сульфид какого металла подвергался обжигу?
Слайд 36РЕШЕНИЕ:
Обозначим неизвестный металл – М, тогда
2Me2S3 + 9O2
= 6SO2 + 2Me2O3
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Следовательно, Me2S3 3H2SO4
Находим атомную массу металла:
(2А+96) г Me2S3 — 4,522,4 л O2
22,5 г Me2S3 — 15,12 л O2.
Отсюда
2А = 22,5(г) 4,5(г) 22,4(л):15,12(л)–96 ,
А=27, это – алюминий.
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Следовательно, Me2S3 3H2SO4
Находим атомную массу металла:
(2А+96) г Me2S3 — 4,522,4 л O2
22,5 г Me2S3 — 15,12 л O2.
Отсюда
2А = 22,5(г) 4,5(г) 22,4(л):15,12(л)–96 ,
А=27, это – алюминий.
Слайд 37Al2S3 + 4,5O2 = 3SO2 + Al2O3
150 г Al2S3 — 398
г H2SO4
22,5 г Al2S3 — m г H2SO4
Отсюда m(H2SO4)=22,5(г) 398(г):150(г)=44,1 г
H2SO4 + 2NaOH = Na2SO4 + H2O
80 г NaOH — 98 г H2SO4
m(NaOH) — 44,1 г H2SO4
Отсюда m(NaOH)=44,1(г)80(г):98(г)=36 г,
mраствора(NaOH)=36(г):0,22=163,64(г),
Vраствора(NaOH)=163,64(г):1,24(г/мл)=132(мл).
22,5 г Al2S3 — m г H2SO4
Отсюда m(H2SO4)=22,5(г) 398(г):150(г)=44,1 г
H2SO4 + 2NaOH = Na2SO4 + H2O
80 г NaOH — 98 г H2SO4
m(NaOH) — 44,1 г H2SO4
Отсюда m(NaOH)=44,1(г)80(г):98(г)=36 г,
mраствора(NaOH)=36(г):0,22=163,64(г),
Vраствора(NaOH)=163,64(г):1,24(г/мл)=132(мл).
Слайд 38Санкт-Петербургская олимпиада 2000 г.
9 класс
При взаимодействии 3,57 г галогенида щелочного металла
с избытком раствора нитрата серебра образовалось 5,64 г осадка. Если такую же навеску галогенида обработать концентрированной серной кислотой с последующим прокаливанием продукта реакции, то получается 2,61 г сухого остатка. Определите состав галогенида щелочного металла.
Слайд 39Решение
Первую реакцию можно представить в виде:
MHal + AgNO3 = AgHal +
MNO3
Пусть молярная масса галогенида металла равна (А+х) г/моль, тогда молярная масса галогенида серебра равна (108+х) г/моль.
Отсюда (A+x)/3,57 = (108+x)/5,64 или
5,64A + 2,07x = 385,56
Вторая реакция:
2MHal + H2SO4 = M2SO4 + 2HHal
Отсюда 2(A+x)/3,57 = (2A+96)/2,61 или
5,22х – 1,92А = 342,72
Решая эти два уравнения, получим А=39 (калий), х=80 (бром).
Следовательно в качестве исходного соединения был взят бромид калия.
Пусть молярная масса галогенида металла равна (А+х) г/моль, тогда молярная масса галогенида серебра равна (108+х) г/моль.
Отсюда (A+x)/3,57 = (108+x)/5,64 или
5,64A + 2,07x = 385,56
Вторая реакция:
2MHal + H2SO4 = M2SO4 + 2HHal
Отсюда 2(A+x)/3,57 = (2A+96)/2,61 или
5,22х – 1,92А = 342,72
Решая эти два уравнения, получим А=39 (калий), х=80 (бром).
Следовательно в качестве исходного соединения был взят бромид калия.
Слайд 41Решение
Предположим, что гессит содержит только один атом теллура. Тогда молярная масса
минерала будет равна: М = А(Те)/ω(Те) = 127,6/0,372 = 343 г/моль. (Если в молекуле присутствует 2, 3, 4 и т.д. атомов теллура, то молярная масса возрастает в соответствующее число раз).
В принципе минерал может быть теллуридом, теллуритом или теллуратом какого-то металла. Необходимо проанализировать все случаи.
Если минерал является теллуридом, то на входящий в него металл приходится 343 – 127,6 = 215,6 г/моль. Эта величина точно соответствует удвоенной атомной массе серебра (107,8×2).
Следовательно, гессит – это теллурид серебра Ag2Te.
(Анализ теллуритов и теллуратов не дает разумных структур).
В принципе минерал может быть теллуридом, теллуритом или теллуратом какого-то металла. Необходимо проанализировать все случаи.
Если минерал является теллуридом, то на входящий в него металл приходится 343 – 127,6 = 215,6 г/моль. Эта величина точно соответствует удвоенной атомной массе серебра (107,8×2).
Следовательно, гессит – это теллурид серебра Ag2Te.
(Анализ теллуритов и теллуратов не дает разумных структур).
Слайд 42Районная олимпиада 2001 г.
10 класс
Хлорпроизводное некоторого углеводорода содержит 63,89% хлора
и 32,47% углерода. Определите простейшую формулу этого соединения. Напишите структурные формулы двух его изомеров, принадлежащих к разным гомологическим рядам.
Слайд 43Решение
В соединении содержится 100 – (63,89 + 32,47) = 3,64% водорода.
Мольное
отношение элементов в соединении будет равно:
(C) : (H) : (Cl) = 2,7 : 3,6 : 1,8 = 3 : 4 : 2
Простейшая формула: C3H4Cl2.
Возможные структурные формулы:
СH2=CH–CHCl2
(C) : (H) : (Cl) = 2,7 : 3,6 : 1,8 = 3 : 4 : 2
Простейшая формула: C3H4Cl2.
Возможные структурные формулы:
СH2=CH–CHCl2
Cl
Cl
Слайд 44Санкт-Петербургская олимпиада 2000 г.
9 класс
Неизвестный металл при нагревании
активно реагирует с хлором, образуя хлорид с содержанием металла 25,2% по массе. Хлорид этого металла при обычных условиях жидкость и реагирует с водой.
а) Определите неизвестный металл и напишите формулу его хлорида.
б) Напишите уравнения описанных в условии задачи реакций.
в) Где может применяться свойство хлорида этого металла реагировать с водой.
а) Определите неизвестный металл и напишите формулу его хлорида.
б) Напишите уравнения описанных в условии задачи реакций.
в) Где может применяться свойство хлорида этого металла реагировать с водой.
Слайд 45Решение
Определим эквивалентную массу металла:
25,2 (г) Ме — 74,8 (г) Cl
Э(Ме)
— 35,5 (г) Cl
Отсюда Э(Ме) = 25,235,5/74,8 = 11,96 12 (г)
Валентность Атомная масса
1 12 (углерод, но он не подходит по условиям задачи)
2 24 (магний, но его хлорид – твердое вещество)
3 36 (нет)
4 48 (титан)
Ti + 2Cl2 = TiCl4 – жидкость, легко гидролизуется;
TiCl4 + 4H2O = Ti(OH)4 + 4HCl
Это свойство применяется для постановки дымовых завес, т.е. при разбрызгивании TiCl4 образуется густой туман.
Отсюда Э(Ме) = 25,235,5/74,8 = 11,96 12 (г)
Валентность Атомная масса
1 12 (углерод, но он не подходит по условиям задачи)
2 24 (магний, но его хлорид – твердое вещество)
3 36 (нет)
4 48 (титан)
Ti + 2Cl2 = TiCl4 – жидкость, легко гидролизуется;
TiCl4 + 4H2O = Ti(OH)4 + 4HCl
Это свойство применяется для постановки дымовых завес, т.е. при разбрызгивании TiCl4 образуется густой туман.
Слайд 46Санкт-Петербургская олимпиада 2000 г.
9 класс
Простое вещество А массой 0,624 г растворили
в щелочи. При этом выделился 1 л газа, для окисления которого потребовался 1 л хлора. Через полученный раствор пропустили углекислый газ до полного выпадения осадка, который отфильтровали и прокалили. Масса остатка оказалась равной 1,34 г. Определите вещество А и напишите уравнения упомянутых реакций. (Объемы газов измерены при н.у.).
Слайд 47Решение
При взаимодействии вещества А со щелочью могут выделяться:
а) водород (Al +
NaOH).
б) кислород (F2 + NaOH).
в) соединение А с водородом (P + NaOH).
Из соотношения объемов выделившегося газа и хлора следует, что этот газ – водород.
При пропускании в раствор СО2 может выпадать карбонат или гидроксид. Оба они при прокаливании могут образовать оксид.
По навеске исходного простого вещества и массе оксида находим эквивалентную массу вещества А:
Э(А) = 0,6248:(1,34–0,624) = 6,97.
б) кислород (F2 + NaOH).
в) соединение А с водородом (P + NaOH).
Из соотношения объемов выделившегося газа и хлора следует, что этот газ – водород.
При пропускании в раствор СО2 может выпадать карбонат или гидроксид. Оба они при прокаливании могут образовать оксид.
По навеске исходного простого вещества и массе оксида находим эквивалентную массу вещества А:
Э(А) = 0,6248:(1,34–0,624) = 6,97.
Слайд 48Вещество А не может быть литием, т.к. его карбонат заметно растворим
в воде, и азотом, т.к. он не реагирует с щелочью. Условию задачи удовлетворяет кремний (Аr = 28).
Уравнения реакций:
Si + 2NaOH + H2O = Na2SiO3 + H2.
H2 + Cl2 = 2HCl.
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3.
H2SiO3 = H2O + SiO2.
Уравнения реакций:
Si + 2NaOH + H2O = Na2SiO3 + H2.
H2 + Cl2 = 2HCl.
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3.
H2SiO3 = H2O + SiO2.
Слайд 49Санкт-Петербургская олимпиада 2000 г.
9 класс
Монету чеканки 1992 года, достоинством 1 рубль
и массой 3,28 г опустили в раствор соляной кислоты. При этом выделилось 1,2 л водорода (н.у.) и осталось 0,28 г нерастворившегося остатка. Этот остаток обработали разбавленной азотной кислотой и получили раствор голубого цвета.
а) Определите, какой металл является основным компонентом монеты.
б) Обсудите состав нерастворимого в соляной кислоте вещества.
в) Для чего служит это второе вещество?
а) Определите, какой металл является основным компонентом монеты.
б) Обсудите состав нерастворимого в соляной кислоте вещества.
в) Для чего служит это второе вещество?
Слайд 50Решение
Масса основного компонента монеты: 3,28 – 0,28 = 3,00 (г)
3 (г)
выделяют из кислоты 1,2 (л) водорода, а 1 экв – 11,2 (л), тогда ЭМе = 3 (г)11,2 (л)/1,2 (л) = 28 (г).
Атомная масса металла:
Валентность Атомная масса
1 28 (нет)
2 56 (железо)
3 84 (нет)
4 112 (кадмий, но у него нет валентности 4)
Вторым компонентом сплава является медь, на что указывает цвет раствора после реакции с азотной кислотой.
Уравнения реакций: Fe + 2HCl = FeCl2 + H2,
3Cu + 8HNO3 = 3Cu(NO3)3 + 2NO + 4H2O
Медь вводят в состав монеты для придания ей привычного желтоватого оттенка.
Атомная масса металла:
Валентность Атомная масса
1 28 (нет)
2 56 (железо)
3 84 (нет)
4 112 (кадмий, но у него нет валентности 4)
Вторым компонентом сплава является медь, на что указывает цвет раствора после реакции с азотной кислотой.
Уравнения реакций: Fe + 2HCl = FeCl2 + H2,
3Cu + 8HNO3 = 3Cu(NO3)3 + 2NO + 4H2O
Медь вводят в состав монеты для придания ей привычного желтоватого оттенка.
Слайд 51Санкт-Петербургская олимпиада 2000 г.
9 класс
Химическое соединение, содержащее 92,83% элемента Х, поместили
в стакан и добавили 100 г раствора азотной кислоты. После окончания реакции остаток отфильтровали и получили чистый 12,00%-ный раствор нитрата Х. При добавлении 10 мл этого раствора к 100 мл раствора сульфата аммония выпадает осадок, в котором содержание Х на 24,5% меньше, чем в исходном веществе. При добавлении 10 мл этого раствора к 100 мл раствора аммиака выпадает осадок, в котором содержание Х только на 7% меньше, чем в исходном веществе.
1. Предложите максимально простой, но обоснованный способ однозначного определения Х.
2. Рассчитайте массовую долю HNO3 в растворе азотной кислоты.
1. Предложите максимально простой, но обоснованный способ однозначного определения Х.
2. Рассчитайте массовую долю HNO3 в растворе азотной кислоты.
Слайд 52Решение
Очевидно, что Х – это некоторый металл. Рассчитаем эквивалентную массу Х,
исходя из его массовой доли в образовавшемся сульфате. Массовая доля Х в сульфате равна 92,83–24,5=68,33; отсюда: Э(Х)/Э(SO4) = 68,33/(100–68,33). Э(Х) = 103,6. Элемент Х – это свинец. Представим исходное соединение в виде PbnYm, где Y–произвольная группа атомов. Определим Э(Y): Э(Y)/Э(Pb)=(100–92,83)/92,83. Отсюда Э(Y) = 8. Очевидно, что Y – это кислород.
При добавлении к PbO азотной кислоты прошла реакция:
PbO + 2HNO3 = Pb(NO3)2 + H2O
Обозначим через х массовую долю азотной кислоты, тогда (HNO3)=x/63, a (PbO)=(Pb(NO3)2)=x/126. Отсюда m(PbO) = 1,771x a m(Pb(NO3)2)=2,629x. Масса полученного раствора равна 100+1,771х, а концентрация Pb(NO3)2 = 2,629/(100+1,771х) = 0,1200.
Отсюда х = 4,967%.
При добавлении к PbO азотной кислоты прошла реакция:
PbO + 2HNO3 = Pb(NO3)2 + H2O
Обозначим через х массовую долю азотной кислоты, тогда (HNO3)=x/63, a (PbO)=(Pb(NO3)2)=x/126. Отсюда m(PbO) = 1,771x a m(Pb(NO3)2)=2,629x. Масса полученного раствора равна 100+1,771х, а концентрация Pb(NO3)2 = 2,629/(100+1,771х) = 0,1200.
Отсюда х = 4,967%.