- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Спирты
Содержание
- 1. Спирты
- 2. Определение Спирты (алкоголи) - это производные углеводородов,
- 3. Классификация спиртов по строению УВ радикала:СпиртыПредельные (алканолы)НепредельныеАроматическиеCH3OHметанолC6H5CH2OHфенилметанолалкенолыалкинолыCH2=CH-CH2OHпропен-2-ол-1HC=C-CH2OHпропин-2-ол-1
- 4. Классификация спиртов по атомности:СпиртыОдноатомныеМногоатомныеC2H5OHэтанолДвухатомныеТрехатомныеCH2(OH)-CH2(OH)этандиол-1,2CH2(OH)-CH2(OH)-CH2(OH)пропандиол-1,2,3
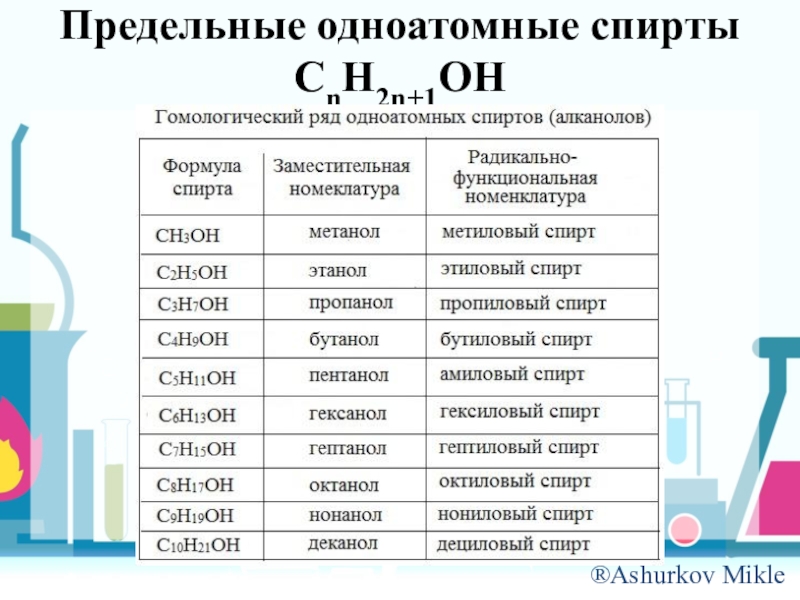
- 5. Предельные одноатомные спирты CnH2n+1OH
- 6. Изомерия и номенклатураНазвание спиртов включает в себя
- 7. ИзомерияДля спиртов характерна структурная изомерия:Изомерия положения –OH
- 8. Электронное строение молекулыСтроение самого простого спирта –
- 9. Физические свойства спиртовПредельные одноатомные спирты от C1
- 10. Химические свойства спиртовСвойства спиртов ROH определяются наличием
- 11. Реакции с разрывом связи RO-HСпирты реагируют с
- 12. Окисление спиртов 1. Под действием мягкого окислителя
- 13. ПолучениеВ промышленности:Метанол синтезируют из синтез-газа на катализаторе
Определение Спирты (алкоголи) - это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп -OH у насыщенных атомов углерода.
Слайд 1Средняя общеобразовательная школа №2
Выполнил: учитель химии
Ашурков Михаил Федорович
Презентация
по предмету:
Химия
на тему:
«Спирты (алкоголи)»
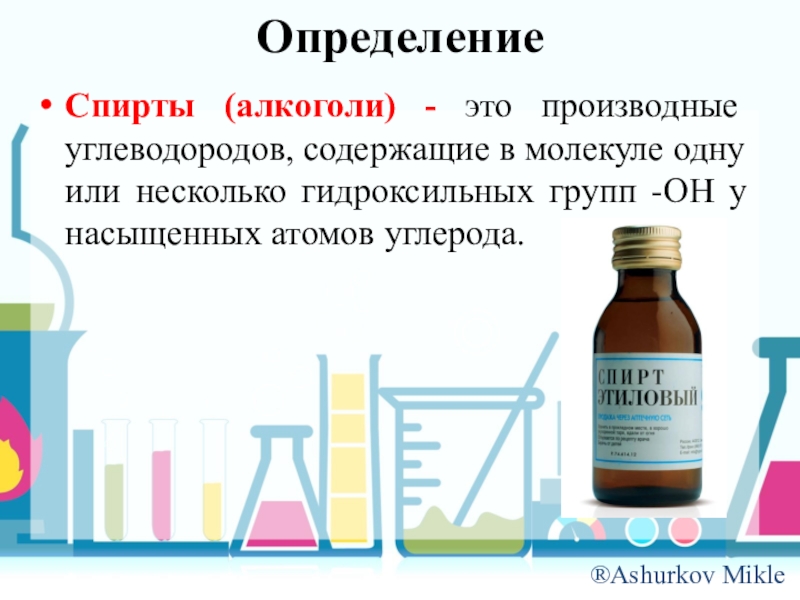
Слайд 2Определение
Спирты (алкоголи) - это производные углеводородов, содержащие в молекуле одну
или несколько гидроксильных групп -OH у насыщенных атомов углерода.
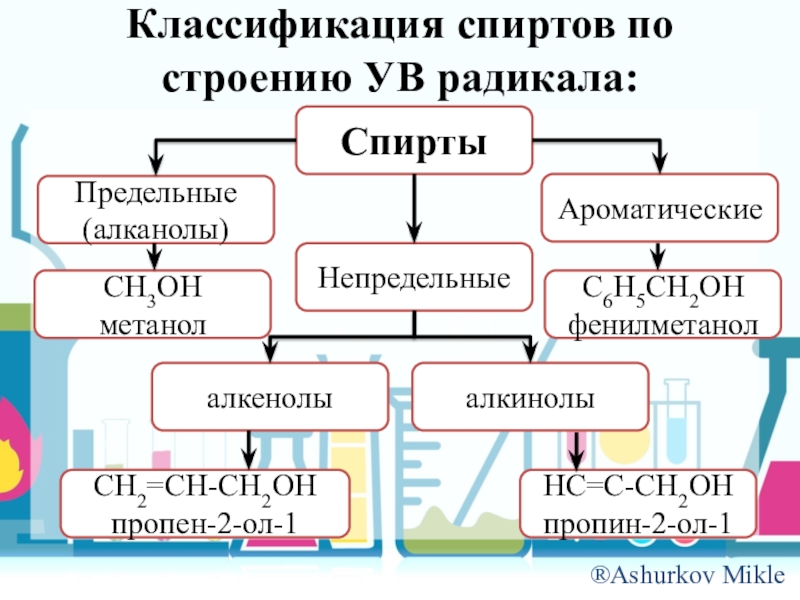
Слайд 3Классификация спиртов по строению УВ радикала:
Спирты
Предельные (алканолы)
Непредельные
Ароматические
CH3OH
метанол
C6H5CH2OH
фенилметанол
алкенолы
алкинолы
CH2=CH-CH2OH
пропен-2-ол-1
HC=C-CH2OH
пропин-2-ол-1
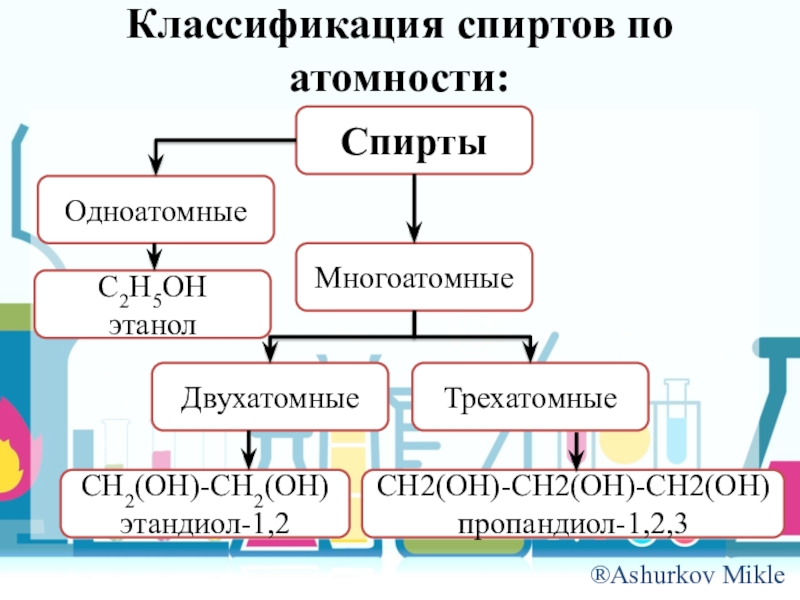
Слайд 4Классификация спиртов по атомности:
Спирты
Одноатомные
Многоатомные
C2H5OH
этанол
Двухатомные
Трехатомные
CH2(OH)-CH2(OH)
этандиол-1,2
CH2(OH)-CH2(OH)-CH2(OH)
пропандиол-1,2,3
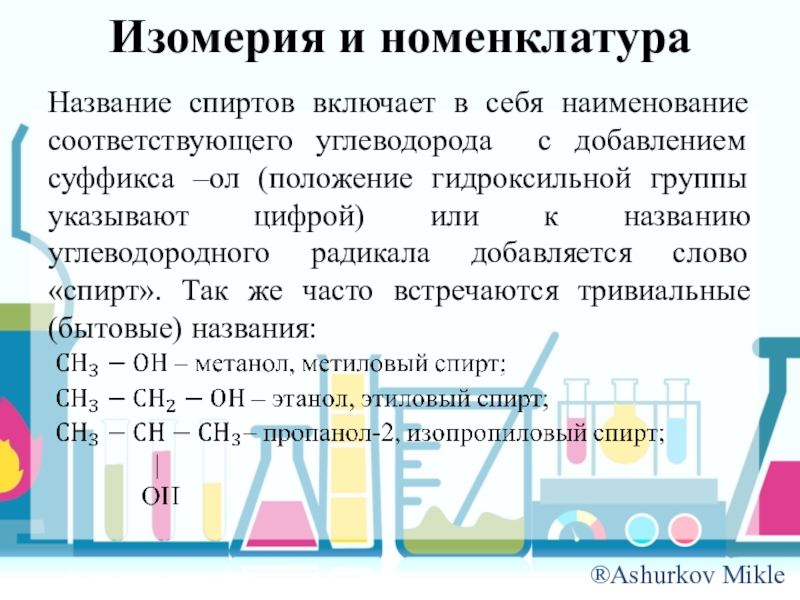
Слайд 6Изомерия и номенклатура
Название спиртов включает в себя наименование соответствующего углеводорода с
добавлением суффикса –ол (положение гидроксильной группы указывают цифрой) или к названию углеводородного радикала добавляется слово «спирт». Так же часто встречаются тривиальные (бытовые) названия:
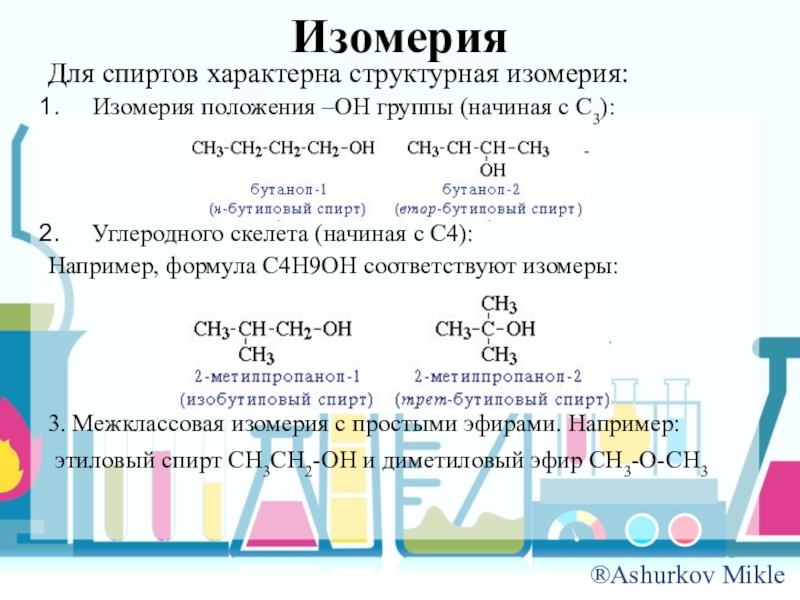
Слайд 7Изомерия
Для спиртов характерна структурная изомерия:
Изомерия положения –OH группы (начиная с C3):
Углеродного
скелета (начиная с C4):
Например, формула C4H9OH соответствуют изомеры:
3. Межклассовая изомерия с простыми эфирами. Например:
этиловый спирт CH3CH2-OH и диметиловый эфир CH3-O-CH3
Например, формула C4H9OH соответствуют изомеры:
3. Межклассовая изомерия с простыми эфирами. Например:
этиловый спирт CH3CH2-OH и диметиловый эфир CH3-O-CH3
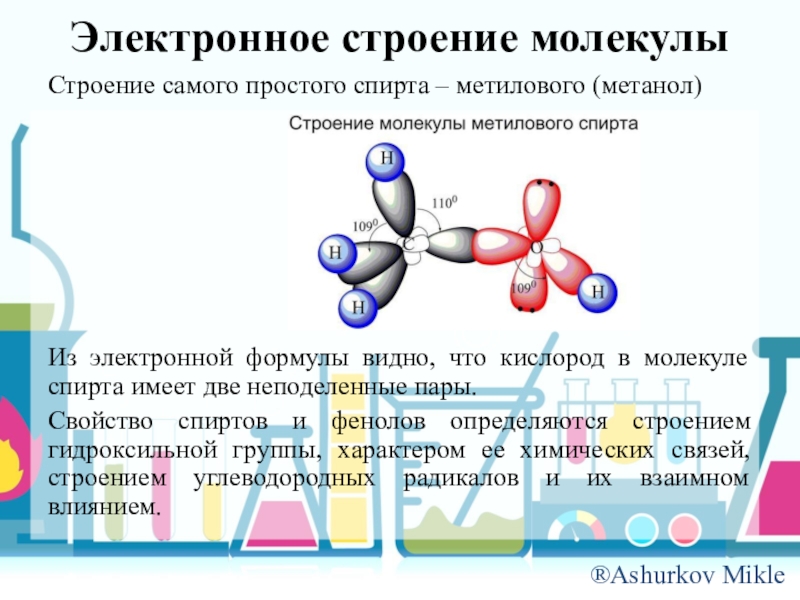
Слайд 8Электронное строение молекулы
Строение самого простого спирта – метилового (метанол)
Из электронной формулы
видно, что кислород в молекуле спирта имеет две неподеленные пары.
Свойство спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимном влиянием.
Свойство спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимном влиянием.
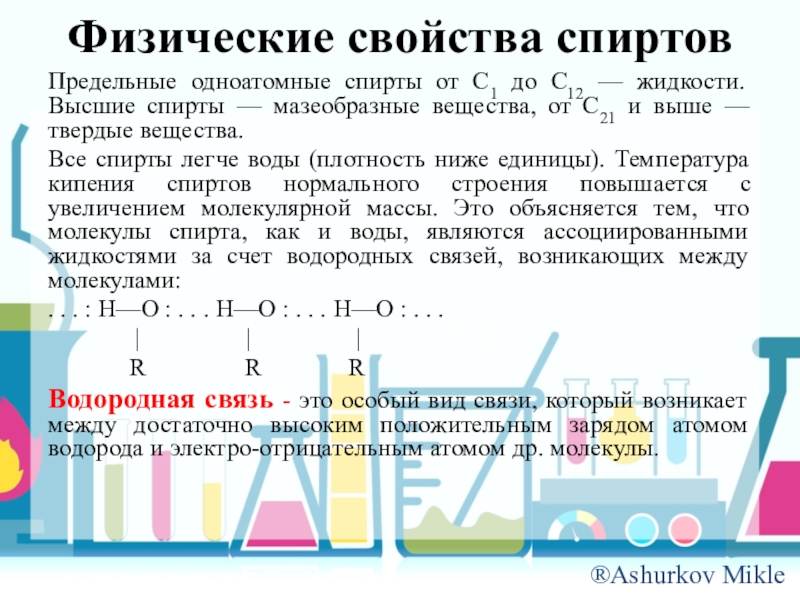
Слайд 9Физические свойства спиртов
Предельные одноатомные спирты от C1 до C12 — жидкости.
Высшие спирты — мазеобразные вещества, от C21 и выше — твердые вещества.
Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Это объясняется тем, что молекулы спирта, как и воды, являются ассоциированными жидкостями за счет водородных связей, возникающих между молекулами:
. . . : H—O : . . . H—O : . . . H—O : . . .
| | |
R R R
Водородная связь - это особый вид связи, который возникает между достаточно высоким положительным зарядом атомом водорода и электро-отрицательным атомом др. молекулы.
Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Это объясняется тем, что молекулы спирта, как и воды, являются ассоциированными жидкостями за счет водородных связей, возникающих между молекулами:
. . . : H—O : . . . H—O : . . . H—O : . . .
| | |
R R R
Водородная связь - это особый вид связи, который возникает между достаточно высоким положительным зарядом атомом водорода и электро-отрицательным атомом др. молекулы.
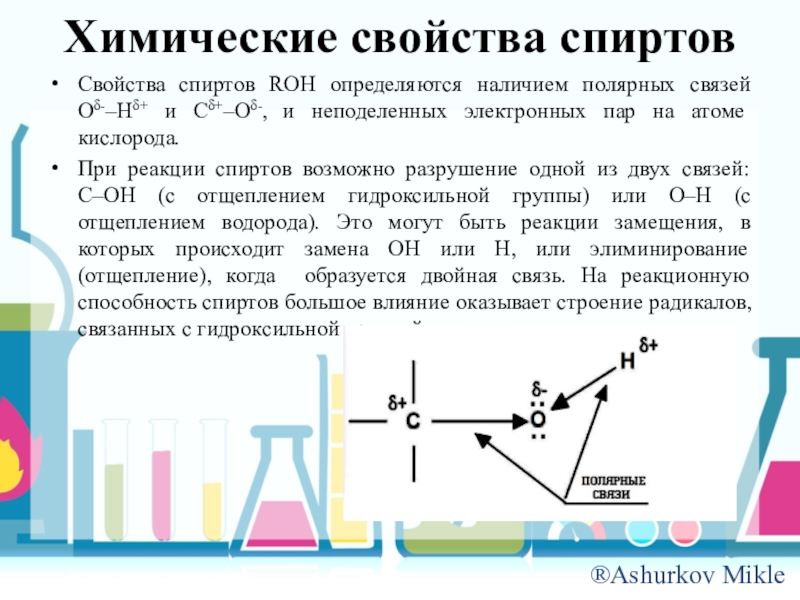
Слайд 10Химические свойства спиртов
Свойства спиртов ROH определяются наличием полярных связей O-–H+ и
C+–O-, и неподеленных электронных пар на атоме кислорода.
При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
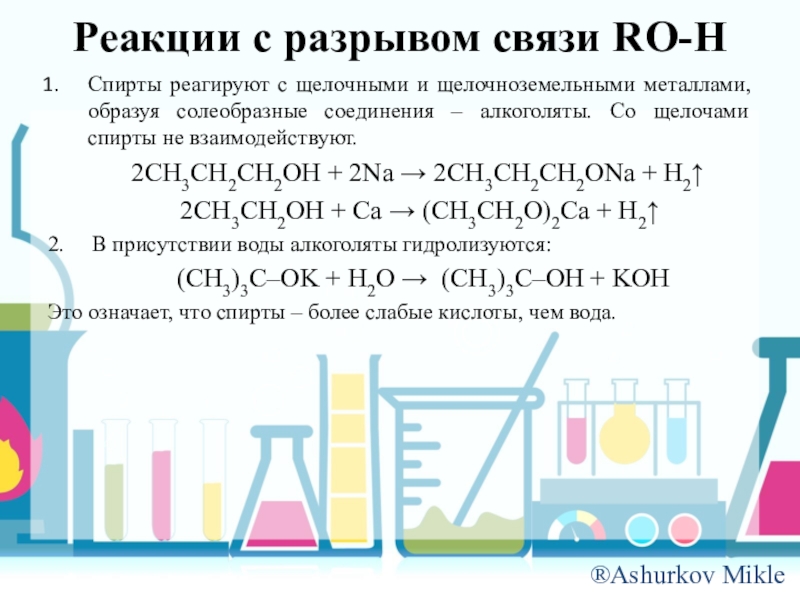
Слайд 11Реакции с разрывом связи RO-H
Спирты реагируют с щелочными и щелочноземельными металлами,
образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют.
2СH3CH2CH2OH + 2Na 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa (СH3CH2O)2Ca + H2
2. В присутствии воды алкоголяты гидролизуются:
(СH3)3С–OK + H2O (СH3)3C–OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода.
2СH3CH2CH2OH + 2Na 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa (СH3CH2O)2Ca + H2
2. В присутствии воды алкоголяты гидролизуются:
(СH3)3С–OK + H2O (СH3)3C–OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода.
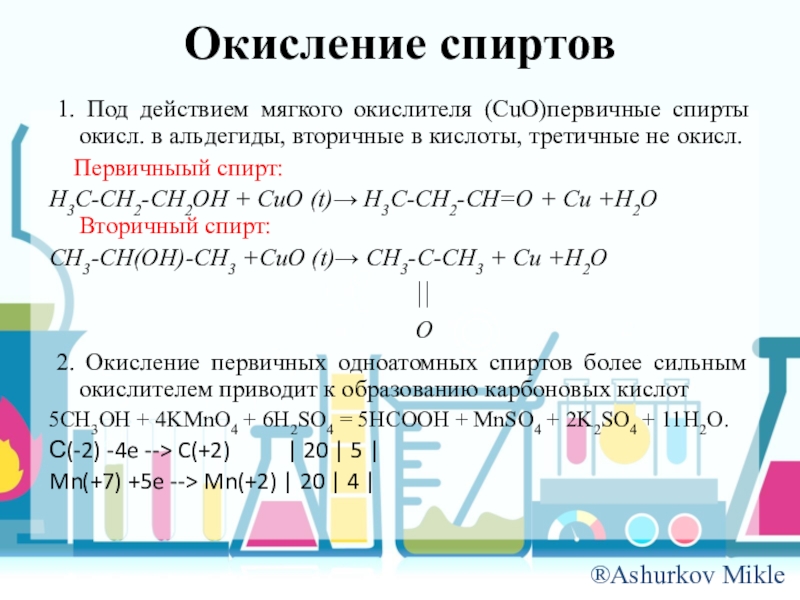
Слайд 12Окисление спиртов
1. Под действием мягкого окислителя (CuO)первичные спирты окисл. в
альдегиды, вторичные в кислоты, третичные не окисл.
Первичныый спирт:
H3C-CH2-CH2OH + CuO (t)→ H3C-CH2-CH=O + Cu +H2O Вторичный спирт:
CH3-CH(OH)-CH3 +CuO (t)→ CH3-C-CH3 + Cu +H2O
||
O
2. Окисление первичных одноатомных спиртов более сильным окислителем приводит к образованию карбоновых кислот
5CH3OH + 4KMnO4 + 6H2SO4 = 5HCOOH + MnSO4 + 2K2SO4 + 11H2O.
С(-2) -4e --> C(+2) | 20 | 5 |
Mn(+7) +5e --> Mn(+2) | 20 | 4 |
Первичныый спирт:
H3C-CH2-CH2OH + CuO (t)→ H3C-CH2-CH=O + Cu +H2O Вторичный спирт:
CH3-CH(OH)-CH3 +CuO (t)→ CH3-C-CH3 + Cu +H2O
||
O
2. Окисление первичных одноатомных спиртов более сильным окислителем приводит к образованию карбоновых кислот
5CH3OH + 4KMnO4 + 6H2SO4 = 5HCOOH + MnSO4 + 2K2SO4 + 11H2O.
С(-2) -4e --> C(+2) | 20 | 5 |
Mn(+7) +5e --> Mn(+2) | 20 | 4 |
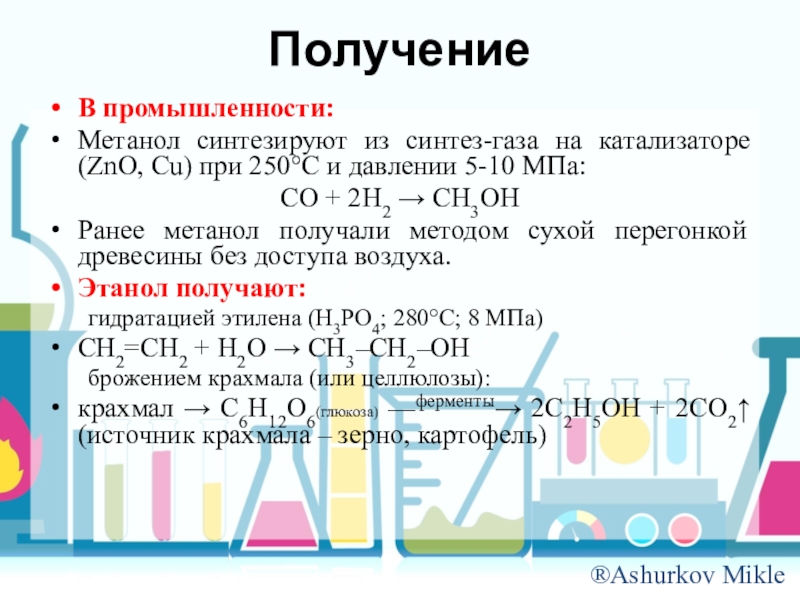
Слайд 13Получение
В промышленности:
Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250C
и давлении 5-10 МПа:
СО + 2Н2 СН3ОН
Ранее метанол получали методом сухой перегонкой древесины без доступа воздуха.
Этанол получают:
гидратацией этилена (Н3РО4; 280C; 8 МПа)
СН2=СН2 + Н2О СН3–СН2–ОН
брожением крахмала (или целлюлозы):
крахмал С6Н12О6(глюкоза) ––ферменты 2С2Н5ОН + 2СО2 (источник крахмала – зерно, картофель)
СО + 2Н2 СН3ОН
Ранее метанол получали методом сухой перегонкой древесины без доступа воздуха.
Этанол получают:
гидратацией этилена (Н3РО4; 280C; 8 МПа)
СН2=СН2 + Н2О СН3–СН2–ОН
брожением крахмала (или целлюлозы):
крахмал С6Н12О6(глюкоза) ––ферменты 2С2Н5ОН + 2СО2 (источник крахмала – зерно, картофель)