- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Соли, их классификация и свойства
Содержание
- 1. Соли, их классификация и свойства
- 2. Цели урокаСформировать понятие о солях как классе электролитовРассмотреть общие свойства солей в свете ТЭД
- 3. Давайте вспомним …Что такое соли?Соли – это
- 4. Составьте уравнения диссоциации солейСульфата калияКарбоната натрияНитрата железа
- 5. Как можно получить соли?Кислота + основание =
- 6. Образование солейН
- 7. Что такое кислая и средняя соль?Кислые соли
- 8. Как будут диссоциировать кислые соли?KHSO4 = K+
- 9. Что получится при взаимодействии кислоты с многокислотным
- 10. Что такое основные соли?Основные соли – это
- 11. Классификация солейNaHSO4 гидросульфат натрияCa(HCO3) 2гидрокарбонат кальцияNaH2PO4дигидрофосфат натрияNa2HPO4гидрофосфат
- 12. Химические свойства солейСоль + кислота = другая
- 13. Химические свойства солейСоль (р) + металл (более
- 14. Правила ряда напряжений (активности) металлов:Ме, расположенные правее
- 15. Исключение!В расплавах солей (т.е. без воды) щелочные
- 16. Составьте уравнения реакций и укажите их типХлорид
- 17. Составьте возможные уравнения реакцийFe2(SO4)3 + KOH →
- 18. Закончите молекулярные уравнения возможных реакций в растворах,
- 19. Установите соответствие между названием соли и ее
- 20. Вычеркните «лишние» формулыКислоты, которые не образуют кислых
- 21. В каком случае возможна реакция и почему?CuCl2 + Al →AlCl3 + Cu →CuSO4 + Pb →
- 22. Составьте возможные уравнения реакций с сульфатом железа
- 23. Запишите уравнения практически осуществимых реакций, укажите причину,
- 24. Запишите не менее 5 уравнений химических реакций,
- 25. Домашнее заданиеПараграф 41Упражнения 1 – 5
- 26. Литература О.С.Габриелян. Химия 8 класс, М., «Дрофа»,
Слайд 2Цели урока
Сформировать понятие о солях как классе электролитов
Рассмотреть общие свойства солей
Слайд 3Давайте вспомним …
Что такое соли?
Соли – это сложные вещества, состоящие из
Соли – это электролиты, которые при диссоциации образуют катионы металла и анионы кислотных остатков
Приведите примеры и названия солей
Каковы физические свойства солей?
Какая химическая связь в солях?
Слайд 4Составьте уравнения диссоциации солей
Сульфата калия
Карбоната натрия
Нитрата железа (III)
Хлорида меди (II)
Сульфата железа
K2SO4 = 2 K+ + SO42-
Na2CO3 = 2 Na+ + CO32-
Fe(NO3) 3 = Fe3+ + 3 NO3-
CuCl2 = Cu2+ + 2 Cl-
Fe2 (SO4) 3 = 2 Fe3+ + 3 SO42-
Слайд 5Как можно получить соли?
Кислота + основание = соль + вода
реакция нейтрализации
Соли – получаются при замене атомов водорода в кислоте на атомы металла
Что получится, если не все атомы водорода в кислоте заместить на атомы калия?
К2SO4 + 2 H2O
2
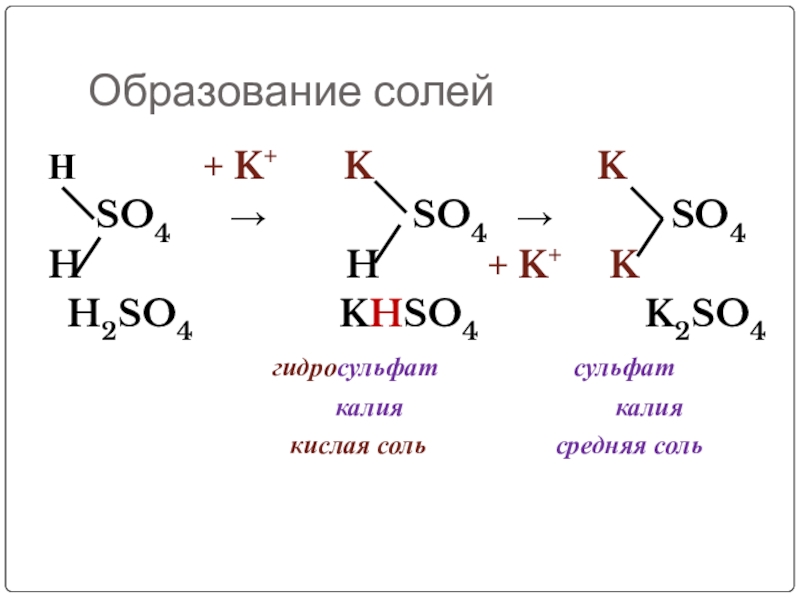
Слайд 6Образование солей
Н + K+
SO4 → SO4 → SO4
H H + K+ K
H2SO4 KHSO4 K2SO4
гидросульфат сульфат
калия калия
кислая соль средняя соль
Слайд 7Что такое кислая и средняя соль?
Кислые соли – это продукты неполного
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл
Может ли образовать кислую соль соляная кислота?
HCl + KOH = KCl + H2O
Одноосновные кислоты не могут образовывать кислые соли!
Слайд 8Как будут диссоциировать кислые соли?
KHSO4 = K+ + HSO4-
HSO4- ↔ H+ + SO42- (2 ступень)
Но диссоциация кислых солей происходит в основном по 1 ступени, поэтому пишут:
KHSO4 = K+ + HSO4-
Но не так: KHSO4 = K+ + H+ + SO4-
Слайд 9Что получится при взаимодействии кислоты с многокислотным основанием?
Са(ОН)2 + HCl =
Ca(OH)
1 моль 2 моль
А если соляной кислоты взять не 2 моль, а только 1 моль?
ОН + Cl- Cl Cl
Са → Ca → Ca
ОН OH + Cl- Cl
Ca(OH)2 CaOHCl CaCl2
гидроксохлорид хлорид
кальция кальция
основная соль
средняя соль
Слайд 10Что такое основные соли?
Основные соли – это продукты неполного замещения гидроксогрупп
Могут ли образовывать такие соли однокислотные основания?
NaOH + HNO3 = NaNO3 + H2O
Диссоциация основных солей:
СаОНСl = (CaOH)+ + Cl- (1 ступень)
(CaOH)+ ↔ Ca 2+ + OH- (2 ступень)
Не могут!
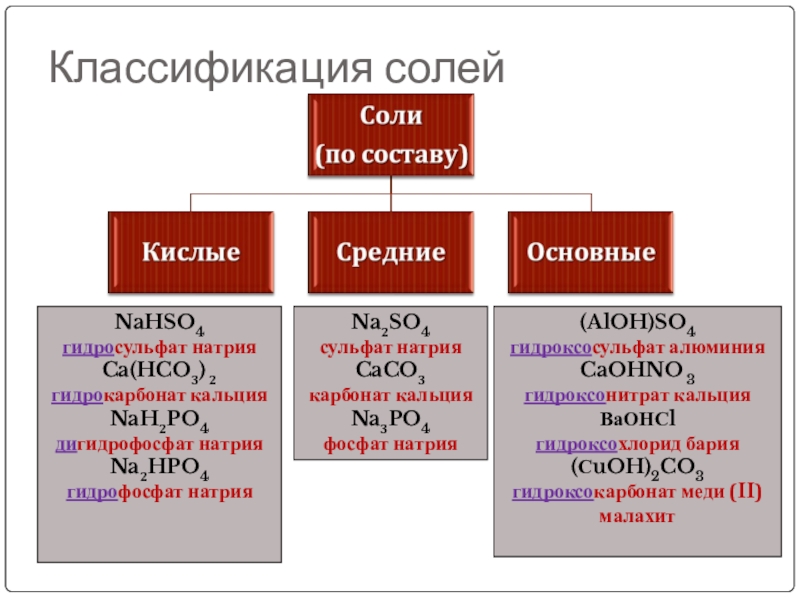
Слайд 11Классификация солей
NaHSO4
гидросульфат натрия
Ca(HCO3) 2
гидрокарбонат кальция
NaH2PO4
дигидрофосфат натрия
Na2HPO4
гидрофосфат натрия
(AlOH)SO4
гидроксосульфат алюминия
CaOHNO 3
гидроксонитрат
ВаОНСl
гидроксохлорид бария
(СuOH)2CO3
гидроксокарбонат меди (II)
малахит
Na2SO4
сульфат натрия
CaCO3
карбонат кальция
Na3PO4
фосфат натрия
Слайд 12Химические свойства солей
Соль + кислота = другая соль + другая кислота
AgNO3 + HBr = Na2SO3 + HNO3 =
Соль + щелочь = другая соль + другое основание (↓ или ↑)
CuCl2 + KOH = NH4Br + NaOH =
Соль1 (р) + соль2 (р) = соль3 + соль4
NaCl + AgNO3 = BaCl2 + K2SO4 =
К какому типу реакций относятся все приведенные уравнения?
Р О
Е Б
А М
К Е
Ц Н
И А
И
Слайд 13Химические свойства солей
Соль (р) + металл (более активный, но не IA,
CuSO4 + Zn = HgCl2 + Cu =
Fe(NO3)2 + Cu = Fe + AgNO3 =
Н. Н. Бекетов (1827-1911)
русский физико-химик,
создатель вытеснительного
ряда металлов
Немецкий химик
Герман Вальтер Нернст
в 1892 г. доказал, что вытеснительный
ряд Бекетова совпадает с рядом металлов
по уменьшению их восстановительной
способности
Слайд 14Правила ряда напряжений (активности) металлов:
Ме, расположенные правее водорода, не вытесняют Н2
Каждый Ме вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений
Восстановительная способность металлов (св-во отдавать электроны) уменьшается, а окислительная способность их катионов (св-во присоединять электроны) увеличивается в ряду слева направо
Слайд 15Исключение!
В расплавах солей (т.е. без воды) щелочные металлы (IA-группа) вытесняют все
Некоторые соли могут разлагаться при прокаливании
СаСО3 = СаО + СО2
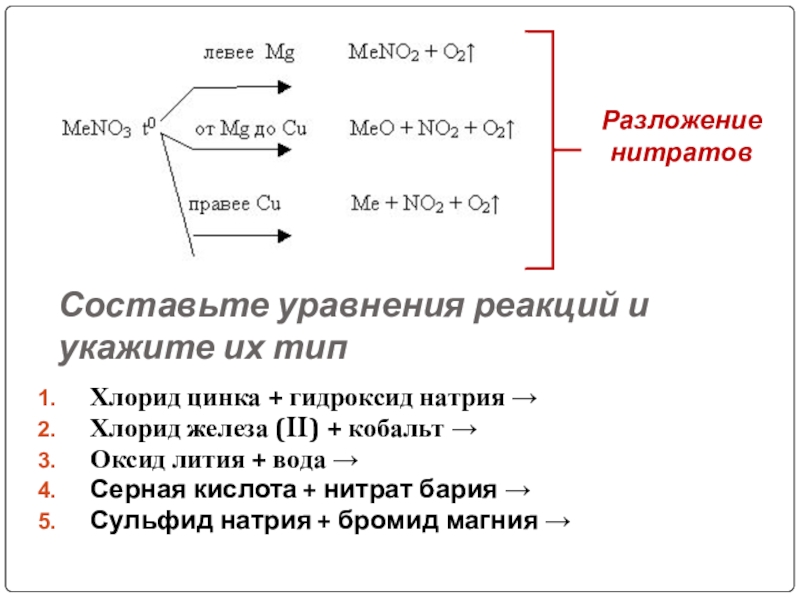
Слайд 16Составьте уравнения реакций и укажите их тип
Хлорид цинка + гидроксид натрия
Хлорид железа (II) + кобальт →
Оксид лития + вода →
Серная кислота + нитрат бария →
Сульфид натрия + бромид магния →
Разложение нитратов
Слайд 17Составьте возможные уравнения реакций
Fe2(SO4)3 + KOH →
KNO3 + NaOH → С
(NH4)2SO4 + LiOH → А
Fe(NO3)2 + HCl → Е
CaCl2 + H2SO4 → Л
K2CO3 + HNO3 → И
BaCl2 + HNO3 → А
Na2SiO3 + HCl → Й
Составьте из букв, соответствующих правильным ответам, название металла
Для любых двух уравнений реакций составьте ионные уравнения
Слайд 18Закончите молекулярные уравнения возможных реакций в растворах, запишите соответствующие им ионные
1 вариант
K2CO3 + HCl →
NaOH + CuSO4 →
KNO3 + CaCl2 →
Al2(SO4)3 + BaCl2 →
Mg + AgNO3 →
Составьте уравнение реакции между растворами фосфата калия и нитрата серебра в молекулярном и ионном видах
2 вариант
Na2SO3 + H2SO4 →
KOH + MgCl2 →
CuSO4 + HCl →
Fe2(SO4)3 + Ba(NO3)2 →
Cu + Hg(NO3)2 →
Составьте уравнение реакции между растворами карбоната магния и соляной кислотой в молекулярном и ионном видах
Слайд 19Установите соответствие между названием соли и ее типом
Из букв, соответствующих правильным
Слайд 20Вычеркните «лишние» формулы
Кислоты, которые не образуют кислых солей – это H2SO4,
Основания, которые не образуют основных солей – это Са(ОН) 2, NaOH, Cu(OH)2, KOH, Fe(OH)3, т.к. …
Слайд 22Составьте возможные уравнения реакций с сульфатом железа (II)
А) LiOH
Б) Cu
В) Ba(NO3)2
Г)
Д) Zn
Е) NaCl
Ж) AgNO3
Напишите ионные уравнения реакций
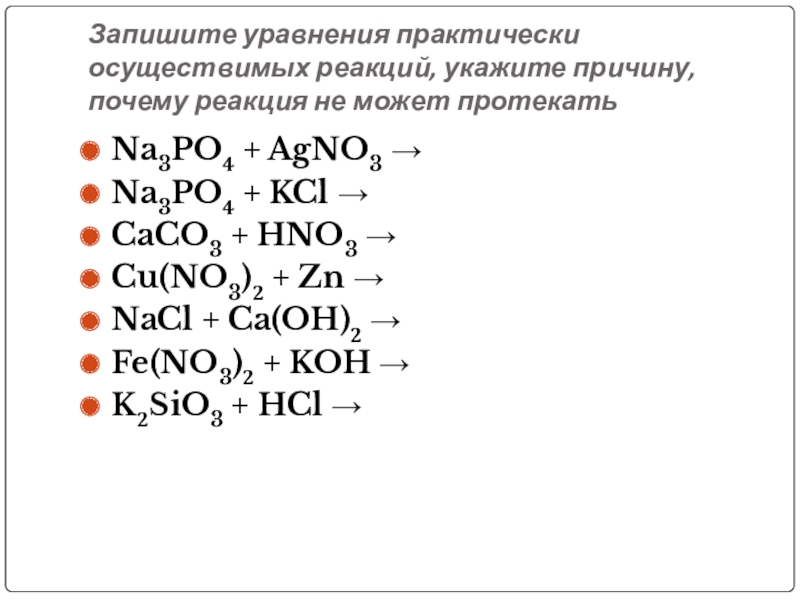
Слайд 23Запишите уравнения практически осуществимых реакций, укажите причину, почему реакция не может
Na3PO4 + AgNO3 →
Na3PO4 + KCl →
CaCO3 + HNO3 →
Cu(NO3)2 + Zn →
NaCl + Ca(OH)2 →
Fe(NO3)2 + KOH →
K2SiO3 + HCl →
Слайд 24Запишите не менее 5 уравнений химических реакций, с помощью которых можно
Хлорид меди (II)
Сульфат железа (II)
Карбонат магния
Слайд 26Литература
О.С.Габриелян. Химия 8 класс, М., «Дрофа», 2011
М.Ю.Горковенко. Поурочные разработки по
О.С.Габриелян, А.В.Яшукова. Рабочая тетрадь по химии 8 класс, М., «Дрофа», 2010
Некрасова Л.И. Химия 8 класс. Карточки заданий. Саратов: Лицей, 2008