- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Соединения железа. Как идея урока: пока дети смотрят презентацию делают лэпбук по тема: железо
Содержание
- 1. Соединения железа. Как идея урока: пока дети смотрят презентацию делают лэпбук по тема: железо
- 2. Общая характеристикаЖЕЛЕЗО - химический элемент, атомный номер
- 3. Расположение в Периодической системеВ периодической системе Менделеева
- 4. Нахождение в природеВ земной коре железо распространено
- 5. Магнитный железнякМАГНЕТИТ (магнитный железняк), минерал подкласса сложных
- 6. Красный железнякГЕМАТИТ(Красный железняк) - минерал подкласса простых
- 7. Бурый железнякБУРЫЙ ЖЕЛЕЗНЯК (Лимонит), - железная руда;
- 8. Серый колчеданПИРИТ (серный колчедан, железный колчедан) -
- 9. Оксид и гидроксидОксид железа (III) FeO и
- 10. Свойства оксида и гидроксидаОксид и гидроксил железа
- 11. Соли железаИз солей железа наибольшее техническое значение
- 12. Применение железа, его сплавов и соединенийЧистое железо
- 13. Железо в организме человекаСуточная потребность человека в
- 14. ЗаключениеЖелезо и его соединения играют огромную роль
- 15. Литература:Общая химия (И.Г. Хомченко)Справочные материалы по химии
Общая характеристикаЖЕЛЕЗО - химический элемент, атомный номер 26, атомная масса 55,847. Происхождение как латинского, так и русского названий элемента однозначно не установлено. Природное железо представляет собой смесь четырех нуклидов с массовыми числами 54 (содержание в природной
Слайд 2Общая характеристика
ЖЕЛЕЗО - химический элемент, атомный номер 26, атомная масса 55,847.
Происхождение как латинского, так и русского названий элемента однозначно не установлено. Природное железо представляет собой смесь четырех нуклидов с массовыми числами 54 (содержание в природной смеси 5,82% по массе), 56 (91,66%), 57 (2,19%) и 58 (0,33%). Конфигурация двух внешних электронных слоев 3 s 2 p 6 d 6 4s 2. Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других.
Слайд 3Расположение в Периодической системе
В периодической системе Менделеева железо входит в группу
VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят, кроме железа, также кобальт и никель. Эти три элемента образуют триаду и обладают сходными свойствами.
Слайд 4Нахождение в природе
В земной коре железо распространено достаточно широко — на
его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3 ; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2· nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют.
Слайд 5Магнитный железняк
МАГНЕТИТ (магнитный железняк), минерал подкласса сложных оксидов, FeFe2O4. Железо-черные кристаллы,
зернистые массы. Твердость 5,5-6,0; плотность 5,2 г/см3. Ферримагнетик. По происхождению метаморфический (встречается в кварцитах и кристаллических сланцах), контактово-метасоматический, магматический (крупные скопления в основных породах). Главная руда железа.
Слайд 6Красный железняк
ГЕМАТИТ(Красный железняк) - минерал подкласса простых оксидов, Fe2O3. Примеси Ti
(до 11%), Al (до 14%), Mn (до 17%) и др. Стально-серые до черных кристаллы (железный блеск, или спекулярит); буровато-красные скрытокристаллические массы (красный железняк). Твердость 6,0-6,5; плотность ок. 5,3 г/см3. По происхождению метаморфический, гипергенный и др. Важная руда железа. Основные месторождения — в железистых кварцитах (Кривой Рог на Украине, Курская магнитная аномалия в Российской Федерации, район Верхнего оз. в США).
Слайд 7Бурый железняк
БУРЫЙ ЖЕЛЕЗНЯК (Лимонит), - железная руда; минеральное образование из гидроксидов
железа, оксидов и гидроксидов кремния и алюминия. Главные минералы: гетит, гидрогетит, гематит, гидрогематит и др. Основные месторождения — осадочные и выветривания. Минимальное содержание Fe 30%. Главные месторождения: в Российской Федерации, на Украине, в США, Нов. Каледонии, на Кубе.
Слайд 8Серый колчедан
ПИРИТ (серный колчедан, железный колчедан) - самый распространенный минерал класса
сульфидов, FeS2. Примеси Cu, Au, Fe, Ni, Co и др. Латунно-желтые кубические кристаллы, сплошные зернистые массы. Твердость 6-6,5; плотность 5,0 г/см3. Полигенного происхождения. Главные промышленные месторождения — гидротермальные и метасоматические. Сырье для получения серной кислоты; руда золота, меди, кобальта.
Слайд 9Оксид и гидроксид
Оксид железа (III) FeO и соответствующий ему гидроксид железа
(II) Fe(OH) получают косвенно, в частности по следующей цепочке превращений:
Fe + 2HCl -> FeCl2 + H2
FeCl2 + 2KOH -> Fe(OH)2 + 2KCl
Fe(OH)2 + t -> FeO
Fe + 2HCl -> FeCl2 + H2
FeCl2 + 2KOH -> Fe(OH)2 + 2KCl
Fe(OH)2 + t -> FeO
Слайд 10Свойства оксида и гидроксида
Оксид и гидроксил железа (II) имеют ярко выраженные
основные свойства.
Катионы железа (II) Fe 2+ легко окисляются кислородом воздуха или другими окислителями (пероксидом водорода) до катионов железа (III) Fe 3+.
Белый осадок гидроксида железа (II) на воздухе приобретает зелёную окраску, а затем становится бурым, постепенно превращаясь в гидроксид железа (III) Fe(OH)2
Катионы железа (II) Fe 2+ легко окисляются кислородом воздуха или другими окислителями (пероксидом водорода) до катионов железа (III) Fe 3+.
Белый осадок гидроксида железа (II) на воздухе приобретает зелёную окраску, а затем становится бурым, постепенно превращаясь в гидроксид железа (III) Fe(OH)2
Слайд 11Соли железа
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Сульфаты железа: FeSO4 и Fe2(SO4)3. Образуют кристаллогидраты. FeSO4·7H2O (железный купорос) применяются в производстве чернил, для окраски шерсти в черный цвет, консервации древесины, как фунгицид. Fe2(SO4)3·9H2O — коагулянт при очистке воды, сырье для получения железных квасцов, протрава при крашении.
Слайд 12Применение железа, его сплавов и соединений
Чистое железо имеет довольно ограниченное применение.
Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Но сплавы железа — чугун и сталь — составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа(III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
Велика роль железа в живых организмах (например оно входит в состав гемоглобина крови).Соединения железа издавна применяют для лечения некоторых болезнейй.
Велика роль железа в живых организмах (например оно входит в состав гемоглобина крови).Соединения железа издавна применяют для лечения некоторых болезнейй.
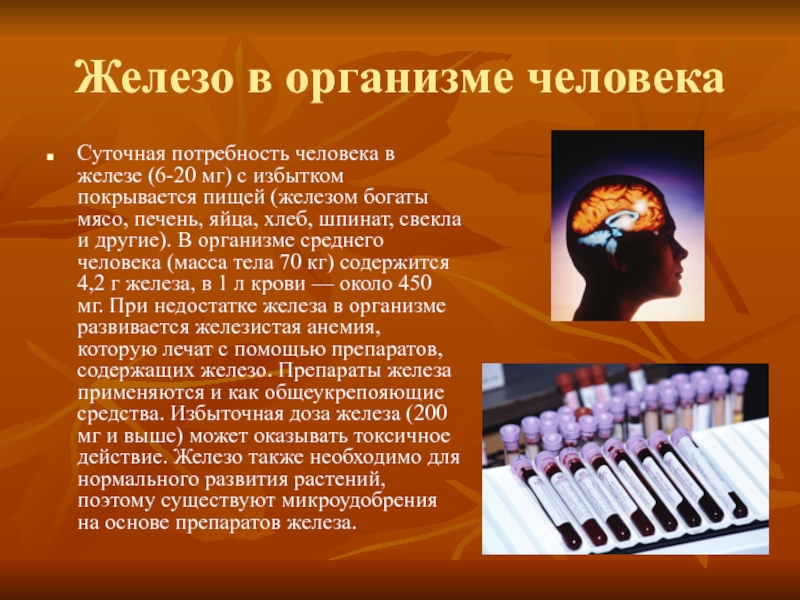
Слайд 13Железо в организме человека
Суточная потребность человека в железе (6-20 мг) с
избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4,2 г железа, в 1 л крови — около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепояющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа.
Слайд 14Заключение
Железо и его соединения играют огромную роль в жизни всех живых
организмов. Железо – незаменимое вещество, регулирующее работу организма. Также железо – материал, без которого невозможен технический прогресс, и если бы не было железа неизвестно как выглядел бы сейчас мир.
Слайд 15Литература:
Общая химия (И.Г. Хомченко)
Справочные материалы по химии ( Ю. Т. Третьяков)
Также
нагло использовался учебник по химии за 9 класс О.С. Габриеляна