- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Серная кислота
Содержание
- 1. Серная кислота
- 2. История открытия серной кислоты.С серной кислотой люди
- 3. Физические свойства серной кислоты.Жидкость.Бесцветная, маслянистая.Растворима в воде
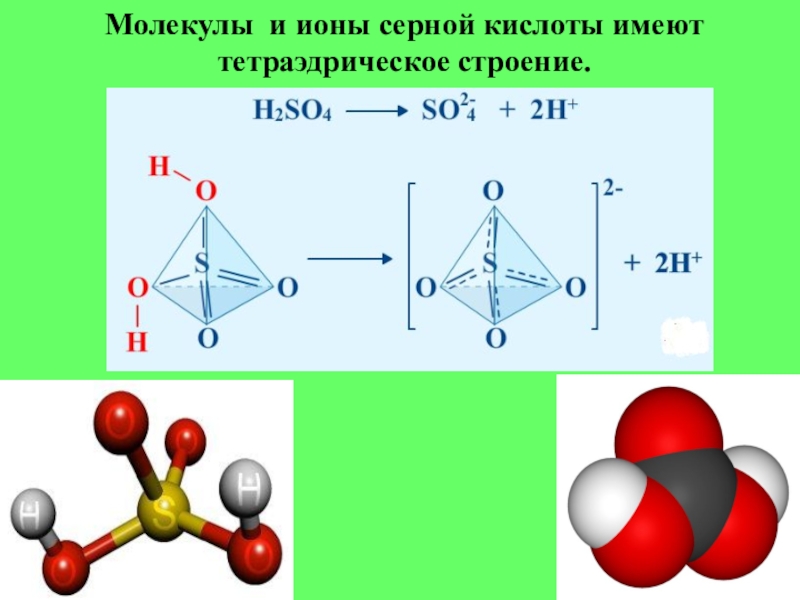
- 4. Молекулы и ионы серной кислоты имеют тетраэдрическое строение.
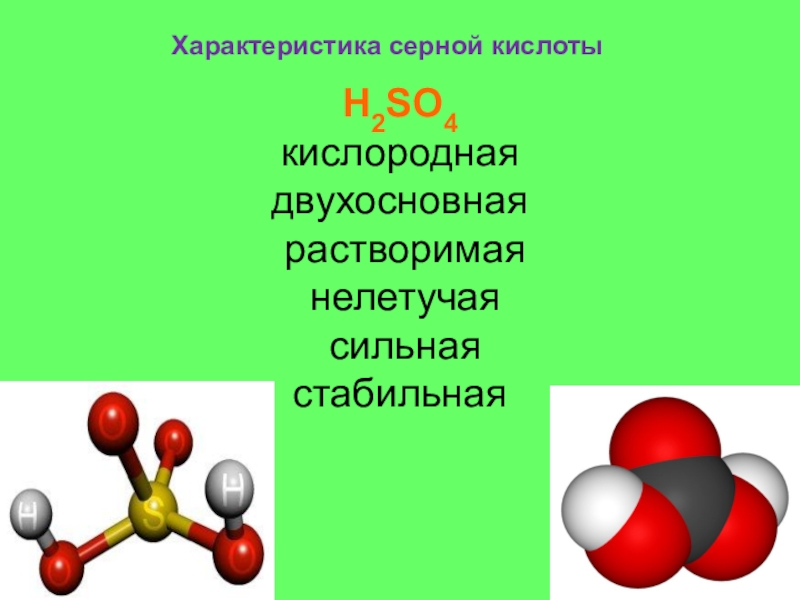
- 5. Характеристика серной кислотыH2SO4 кислороднаядвухосновная растворимая нелетучая сильнаястабильная
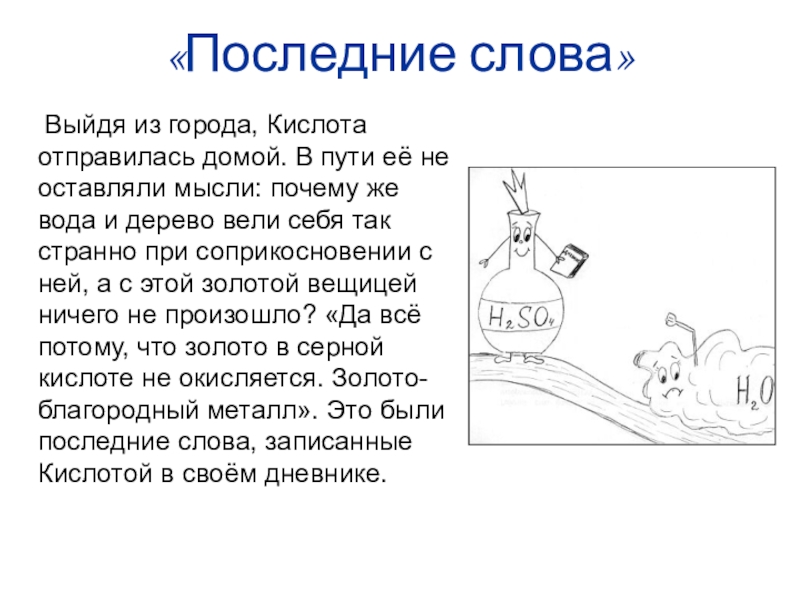
- 6. СЕРНАЯ КИСЛОТА – ЭТО ЯД!!!
- 7. А как правильно ?Сначала вода, Потом кислота. Иначе будет большая беда!
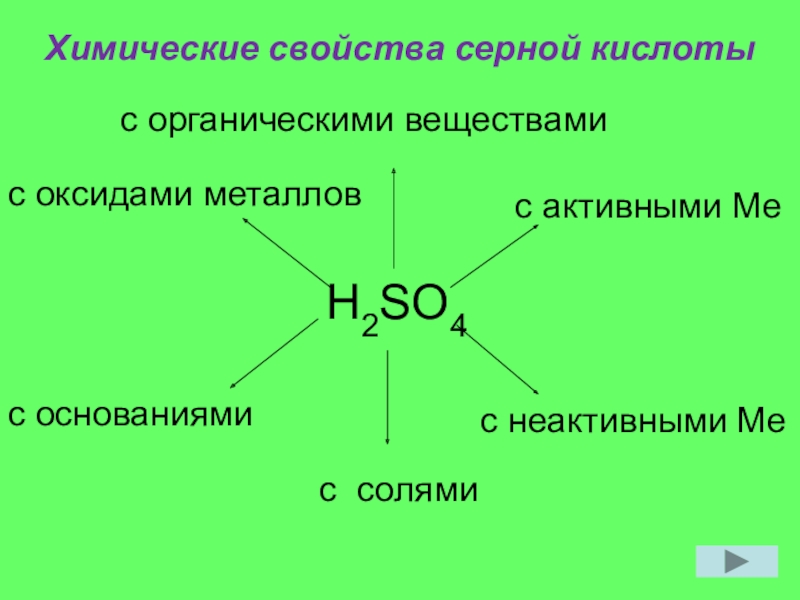
- 8. Химические свойства серной кислотыH2SO4с активными Мес неактивными Мес солямис основаниями с оксидами металловс органическими веществами
- 9. I. Химические свойства разбавленной серной кислоты1.Диссоциация:
- 10. 2. Взаимодействие с металлами (до Н )Zn
- 11. 3. Взаимодействие с оcновными и амфотерными оксидамиCuO
- 12. 4. Взаимодействие с основаниями и амфотерными гидроксидами2NaOH
- 13. 5.Взаимодействие с солями H2SO4+BaCl2 = BaSO4 ↓+
- 14. Серная кислота вытесняет более летучие кислотыNaCI + H2SO4 → NaHSO4 + HCI
- 15. Свойства концентрированной серной кислотыОрганические вещества обугливаются !!!C12H22O11 (сахароза) → 12С (уголь)
- 16. концентрированная серная кислота окисляет неметаллынеМе +
- 17. концентрированная серная кислота окисляет металлыконцентрированная H2SO4
- 18. Качественная реакция на сульфит-ион SO32-Na2SO3 + BaCl2
- 19. Сульфат меди
- 20. Сульфат никеля
- 21. Сульфат натрия.
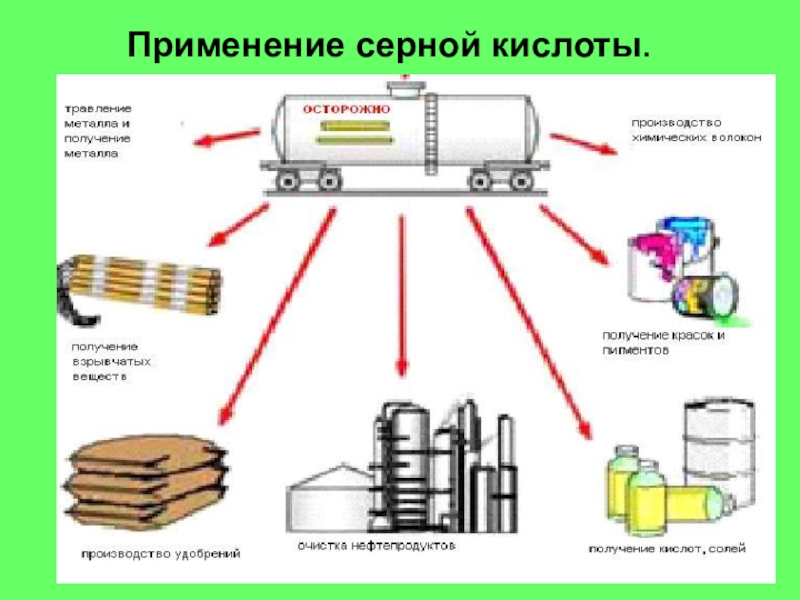
- 22. Применение серной кислоты.
- 23. СКАЗКА «Химическое королевство».
- 24. В одном химическом королевстве жила
- 25. «Физические свойства» С виду была она
- 26. «Растворение кислоты» Серная кислота
- 27. «Если вода соприкасается с серной
- 28. Так и Кислота не утолила
- 29. «Ювелирный магазин» Вскоре она пришла в
- 30. «Последние слова» Выйдя из города,
- 31. Конец
- 32. Домашнее заданиестр. 88-94, упр. 1-4
Слайд 1 Тема урока:
«СЕРНАЯ КИСЛОТА»
Я растворю любой металл.
Меня алхимик получал
В реторте глиняной простой. Слыву я главной кислотой...
Когда сама я растворяюсь
В воде,
то сильно нагреваюсь.
Слайд 2
История открытия серной кислоты.
С серной кислотой люди познакомились значительно позже, чем
ГЛАУБЕР, ИОГАНН РУДОЛЬФ (1604–1670), немецкий химик. Родился в Карлштадте в Нижней Франконии (Германия), в семье бедного цирюльника.
Концентрированную серную кислоту он получил прокаливанием «зеленого витриола» (железного купороса FeSO4 ·7H2O), квасцов (сульфата калия-алюминия KAl(SO4)2·12H2O) или «белого витриола» (цинкового купороса ZnSO4·7H2O); отсюда – другое старинное название серной кислоты – купоросное масло.
Слайд 3Физические свойства
серной кислоты.
Жидкость.
Бесцветная, маслянистая.
Растворима в воде в любых пропорциях.
Образует два
сульфаты ( -SO2-4)
гидросульфаты (- HSO-4)
Слайд 5
Характеристика серной кислоты
H2SO4
кислородная
двухосновная
растворимая
нелетучая
сильная
стабильная
Слайд 8Химические свойства серной кислоты
H2SO4
с активными Ме
с неактивными Ме
с солями
с основаниями
с
с органическими веществами
Слайд 9I. Химические свойства разбавленной серной кислоты
1.Диссоциация:
H2SO4
HSO4- ↔ H+ + SO42-
Слайд 102. Взаимодействие с металлами (до Н )
Zn + H2SO4 → ZnSO4
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
Слайд 113. Взаимодействие с оcновными и амфотерными оксидами
CuO + H2SO4 → CuSO4
ZnO + H2SO4 → ZnSO4 + H2O
Слайд 124. Взаимодействие с основаниями и амфотерными гидроксидами
2NaOH + H2SO4 → Na2SO4
2NaOH + H2SO4 → Na2SO4 +2 H2O
избыток
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Слайд 15Свойства концентрированной серной кислоты
Органические вещества обугливаются !!!
C12H22O11 (сахароза) → 12С
Слайд 16 концентрированная серная кислота окисляет неметаллы
неМе + H2SO4 (конц.) = H2O
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Слайд 17 концентрированная серная кислота окисляет металлы
концентрированная H2SO4 – сильный окислитель;
при
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
8Na + 5H2SO4 → 4Na2SO4 + H2S + 4H2O
Слайд 18Качественная реакция на сульфит-ион SO32-
Na2SO3 + BaCl2 = 2NaCl + BaSO4↓
Качественная реакция на ион –SO42-
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
Слайд 25«Физические свойства»
С виду была она уж и не так
Слайд 26«Растворение кислоты»
Серная кислота хотела быть заметной и
Она шла уже пять часов, ей очень захотелось пить. И вдруг она увидела колодец. «Вода!» - воскликнула Кислота и, подбежав к колодцу, прикоснулась к воде.
Вода страшно зашипела. С криком испуганная Кислота бросилась прочь. Конечно же, что при смешивании серной кислоты с водой выделяется большое количество теплоты.
Слайд 27 «Если вода соприкасается с серной кислотой, то вода, не
Слайд 28 Так и Кислота не утолила свою жажду, она увидела
Но и это у нее не получилось. Как только серная Кислота дотронулась до дерева, оно стало обугливаться. Не зная причины этого, испуганная Кислота убежала прочь.
Слайд 29«Ювелирный магазин»
Вскоре она пришла в город и решила зайти
Кислота увидела множество прекрасных колец. Попросив у продавца золотое кольцо, она надела его на свой длинный, красивый палец. Кислоте понравилось кольцо, и она его купила.