Тема урока
«Сера»
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Сера и её соединения,производство
Содержание
- 1. Сера и её соединения,производство
- 2. Цели урока:Воспитание терпимости, способности прислушиваться к мнению
- 3. Положение в Периодической системе химических элементов3 периодГлавная
- 4. Электронное строение и валентные возможности.
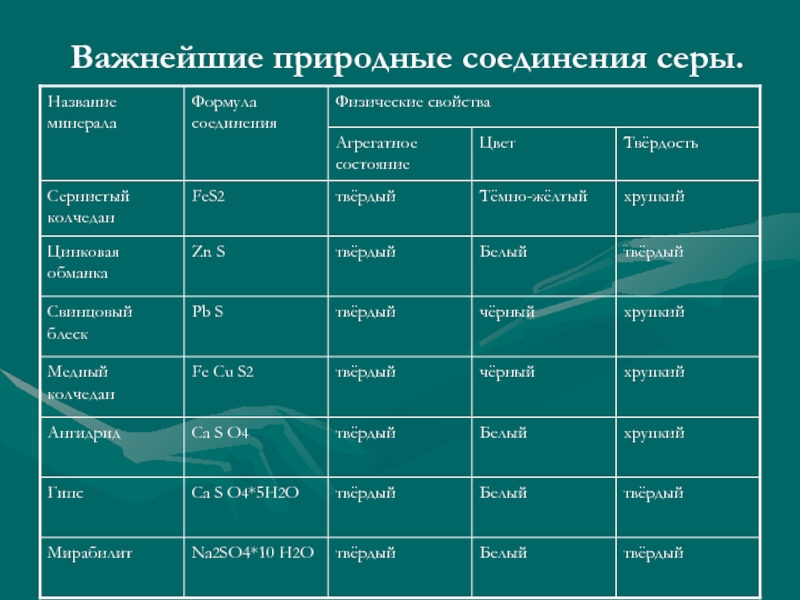
- 5. Важнейшие природные соединения серы.
- 6. Аллотропные модификации.
- 7. Химические свойства серы и её соединений.1.Свойства серы:
- 8. Химические свойства серы и её соединений.3. Свойства
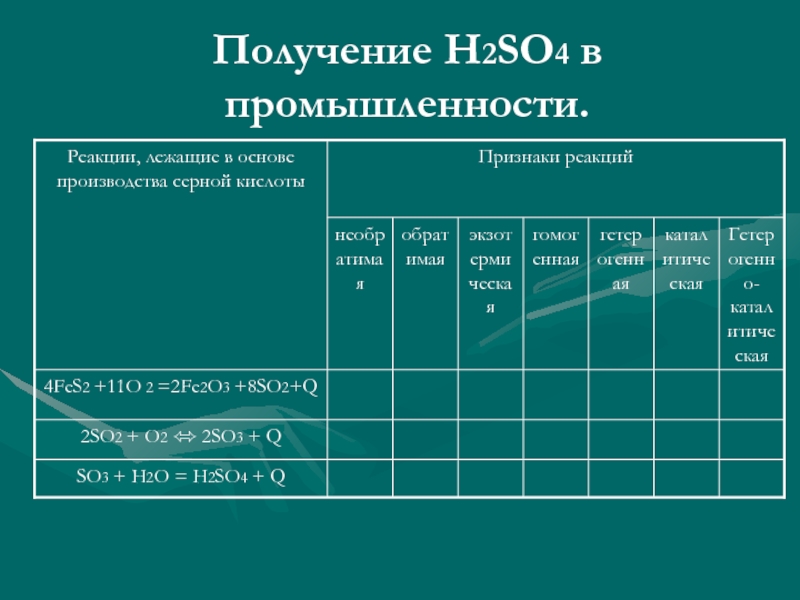
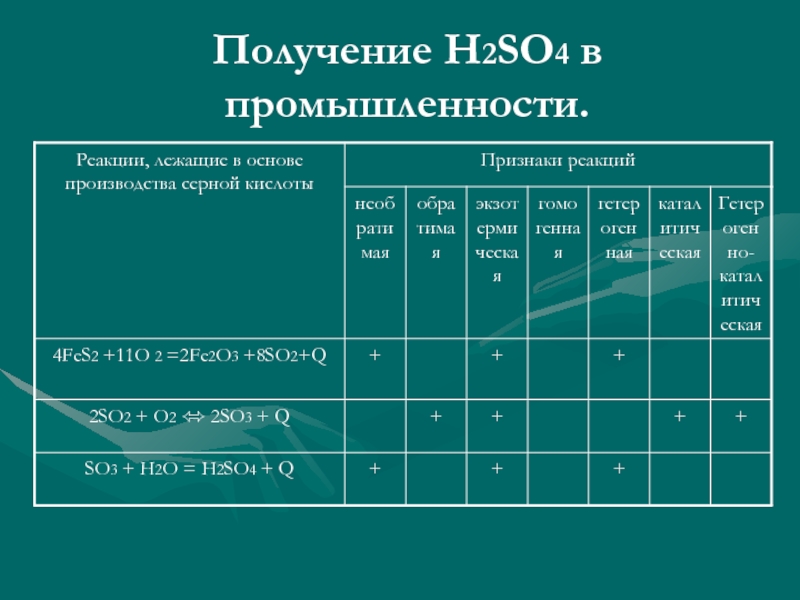
- 9. Получение H2SO4 в промышленности. I. Стадия –
- 10. Получение H2SO4 в промышленности.
- 11. Получение H2SO4 в промышленности.
- 12. Получение H2SO4 в промышленности.
- 13. Задачи на вычисление выхода продукта.Какой объём сероводорода
- 14. Алгоритм решения задачи.
- 15. Алгоритм решения задачи.Теоретический выход продукта реакцииVтеор(H2S)
Цели урока:Воспитание терпимости, способности прислушиваться к мнению других, коммуникативных навыков;Развивать логику и критическое мышление;Изучить общую характеристику химического элемента серы: положение в ПСХЭ; электронное строение атома.Рассмотреть химические реакции, лежащие в основе производства серной кислоты.Познакомить учащихся с задачами
Слайд 1« Знание, добытое без личного усилия, без личного напряжения,- знание мертвое.
Только пропущенное через собственную голову становится твоим достоянием.»
Профессор Нойгауз
Слайд 2Цели урока:
Воспитание терпимости, способности прислушиваться к мнению других, коммуникативных навыков;
Развивать логику
и критическое мышление;
Изучить общую характеристику химического элемента серы: положение в ПСХЭ; электронное строение атома.
Рассмотреть химические реакции, лежащие в основе производства серной кислоты.
Познакомить учащихся с задачами на вычисление выхода продукта.
Изучить общую характеристику химического элемента серы: положение в ПСХЭ; электронное строение атома.
Рассмотреть химические реакции, лежащие в основе производства серной кислоты.
Познакомить учащихся с задачами на вычисление выхода продукта.
Слайд 3Положение в Периодической системе химических элементов
3 период
Главная подгруппа VI группы
Порядковый номер
16
Заряд ядра атома +16
Состав атома: электронов – 16
протонов – 16
нейтронов: 32-16=16
Высшая валентность VI, низшая - II
Заряд ядра атома +16
Состав атома: электронов – 16
протонов – 16
нейтронов: 32-16=16
Высшая валентность VI, низшая - II
Слайд 4Электронное строение и валентные возможности.
+16 S ) )
)
- - -
2e 8e 6e
Электронная формула
2 2 6 2 4
+16S 1S 2S 2P 3S 3P
- - -
2e 8e 6e
Электронная формула
2 2 6 2 4
+16S 1S 2S 2P 3S 3P
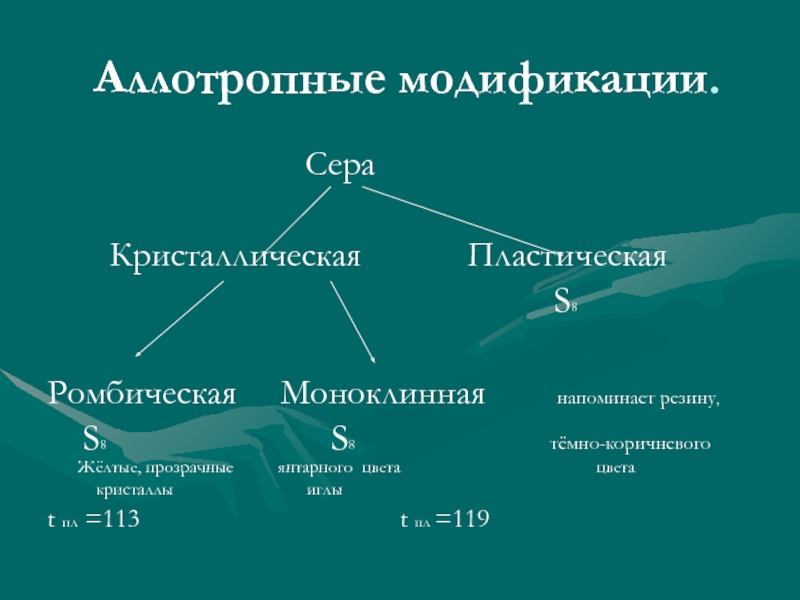
Слайд 6Аллотропные модификации.
Сера
Кристаллическая Пластическая
S8
Ромбическая Моноклинная напоминает резину,
S8 S8 тёмно-коричневого Жёлтые, прозрачные янтарного цвета цвета
кристаллы иглы
t пл =113 t пл =119
Кристаллическая Пластическая
S8
Ромбическая Моноклинная напоминает резину,
S8 S8 тёмно-коричневого Жёлтые, прозрачные янтарного цвета цвета
кристаллы иглы
t пл =113 t пл =119
Слайд 7Химические свойства серы и её соединений.
1.Свойства серы:
Горит в кислороде:
S + O2 = SO2
Взаимодействует с металлами и водородом:
Fe + S=Fe S H2 + S=H2 S
2.Свойства оксидов: SO2 и SO3 :
С водой: SO2 + H2O = H2SO3;
SO3 + H2O = H2SO4
Со щелочами: SO2 + 2NaOH = Na2SO3 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
C основными оксидами: SO3 + Ca O = CaSO4
Взаимодействует с металлами и водородом:
Fe + S=Fe S H2 + S=H2 S
2.Свойства оксидов: SO2 и SO3 :
С водой: SO2 + H2O = H2SO3;
SO3 + H2O = H2SO4
Со щелочами: SO2 + 2NaOH = Na2SO3 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
C основными оксидами: SO3 + Ca O = CaSO4
Слайд 8Химические свойства серы и её соединений.
3. Свойства серной кислоты:
+ _
Диссоциирует: I. H2SO4 ⬄ H + HSO4
_ + 2 -
II. HSO4 ⬄ H + SO4
Взаимодействует с металлами:
Zn + H2SO4 = ZnSO4 + H2
Взаимодействует со щелочами, основаниями, амфотерными гидроксидами:
H2SO4 + 2NaOH = Na2SO4 + H2O
H2SO4 + Cu(OH)2 = CuSO4 + H2O
3 H2SO4 + 2 AI(OH)3 = AI2(SO4)3 + H2O
Взаимодействует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + Zn O=ZnSO4 + H2O
Диссоциирует: I. H2SO4 ⬄ H + HSO4
_ + 2 -
II. HSO4 ⬄ H + SO4
Взаимодействует с металлами:
Zn + H2SO4 = ZnSO4 + H2
Взаимодействует со щелочами, основаниями, амфотерными гидроксидами:
H2SO4 + 2NaOH = Na2SO4 + H2O
H2SO4 + Cu(OH)2 = CuSO4 + H2O
3 H2SO4 + 2 AI(OH)3 = AI2(SO4)3 + H2O
Взаимодействует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + Zn O=ZnSO4 + H2O
Слайд 9Получение H2SO4 в промышленности.
I. Стадия – получение сернистого газа.
S + O2 = SO2 + 297кДж
4 FeS2 + 11 O2 = 8 SO2 + 2 Fe2O3 + 3400кДж
2 H2S+3 O2=2 SO2 + 2 H2O
II.Стадия – получение сернистого ангидрида.
2 SO2 + O2 <=> 2 SO3 + 197кДж
III.Стадия – получение серной кислоты.
2 H2O + SO3 = H2SO4
4 FeS2 + 11 O2 = 8 SO2 + 2 Fe2O3 + 3400кДж
2 H2S+3 O2=2 SO2 + 2 H2O
II.Стадия – получение сернистого ангидрида.
2 SO2 + O2 <=> 2 SO3 + 197кДж
III.Стадия – получение серной кислоты.
2 H2O + SO3 = H2SO4
Слайд 13Задачи на вычисление выхода продукта.
Какой объём сероводорода получится при обработке 0,88г
сульфида железа избытком соляной кислоты, если выход продукта реакции составляет 80%?
Слайд 15Алгоритм решения задачи.
Теоретический выход продукта реакции
Vтеор(H2S) =0,224л.
2) Рассчитаем практический
выход. Возможны два варианта расчёта.
А) Химическая пропорция:
0,224л. H2S составляют – 100%
Х л. ---------------------- 80% ? Х= 0,1792л.
Б) Расчёт по формуле: W = Vпрак/Vтеор ?
Vпракт = W * Vтеор = 0,8 * 0,224л = 0,1792л
Ответ: Vпракт(H2S) = 0,1792л
А) Химическая пропорция:
0,224л. H2S составляют – 100%
Х л. ---------------------- 80% ? Х= 0,1792л.
Б) Расчёт по формуле: W = Vпрак/Vтеор ?
Vпракт = W * Vтеор = 0,8 * 0,224л = 0,1792л
Ответ: Vпракт(H2S) = 0,1792л