- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Реакции обмена
Содержание
- 1. Реакции обмена
- 2. Слайд 2
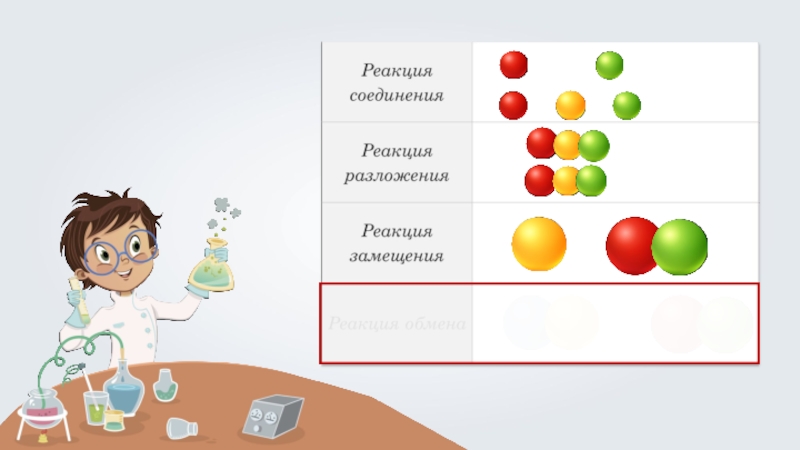
- 3. Реакции обмена — это реакции, в результате которых, два сложных вещества обмениваются своими составными частями.
- 4. Реакции обмена, протекающие в растворах, идут до
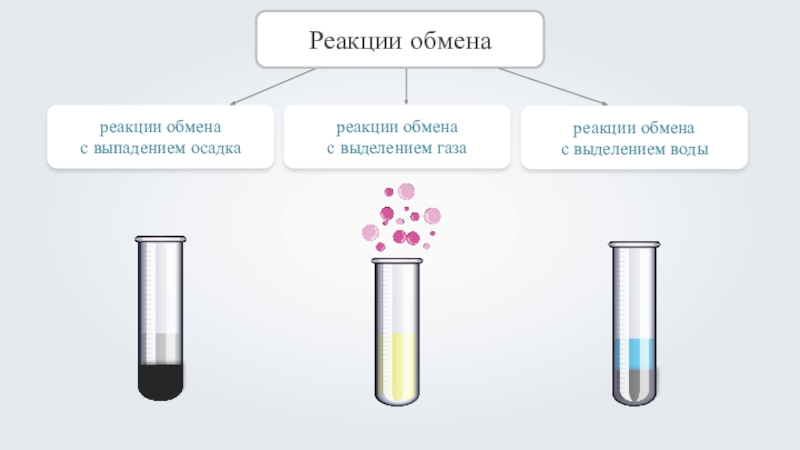
- 5. реакции обмена с выпадением осадкаРеакции обменареакции обмена с выделением газареакции обмена с выделением воды
- 6. \Реакции обмена с выпадением осадкащёлочь(NaOH)хлорид аллюминия (AlCl3)
- 7. \Реакции обмена с выпадением осадкащёлочь(NaOH)
- 8. \Реакции обмена с выпадением осадка
- 9. \Реакции обмена с выпадением осадка
- 10. \Реакции обмена с выпадением осадкаAlCl3 + NaOН
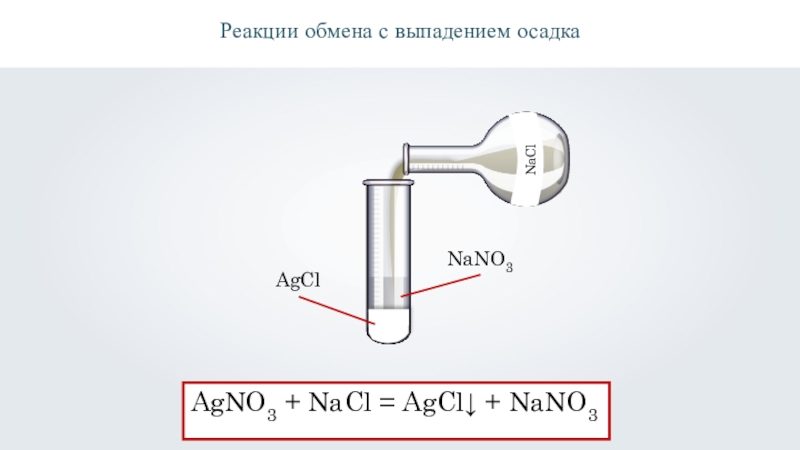
- 11. \Реакции обмена с выпадением осадканитрат серебра (AgNO3)раствор поваренной соли (NaCl)
- 12. \Реакции обмена с выпадением осадкаAgNO3 + NaCl = AgCl↓ + NaNO3AgClNaNO3
- 13. \Реакции обмена с выделением газахлорид аммония (NH4Cl)щёлочь (NaOH)
- 14. \Реакции обмена с выделением газа
- 15. \Реакции обмена с выделением газа
- 16. раствор NaCl + H2О\Реакции обмена с выделением
- 17. \Реакции обмена с выделением водыРеакции нейтрализации —
- 18. \Реакции обмена с выделением водыгидроксид калия (KOH)
- 19. \Реакции обмена с выделением водыгидроксид калия (KOH) лакмус
- 20. \Реакции обмена с выделением водысоляная кислота(HCl) хлорид
- 21. Основное правило протекания реакций обменаосадокгазвода
- 22. раствор щёлочи(NaOH) хлорид бария(BaCl2) NaClBa(OH)22NaOH + BaCl2 ≠ 2NaCl + Ba(OH)2реакция не идёт
Реакции обмена — это реакции, в результате которых, два сложных вещества обмениваются своими составными частями.
Слайд 3
Реакции обмена — это реакции, в результате которых, два сложных вещества
обмениваются своими составными частями.
Слайд 4Реакции обмена, протекающие в растворах, идут до конца только в том
случае, если в результате их образуется осадок, газ или вода.
Слайд 5реакции обмена
с выпадением осадка
Реакции обмена
реакции обмена
с выделением газа
реакции обмена
с выделением воды
Слайд 10\
Реакции обмена с выпадением осадка
AlCl3 + NaOН → Al(ОН)3↓ + NaCl
↓
AlCl3 + 3NaOН = Al(ОН)3↓ + 3NaCl
Слайд 16
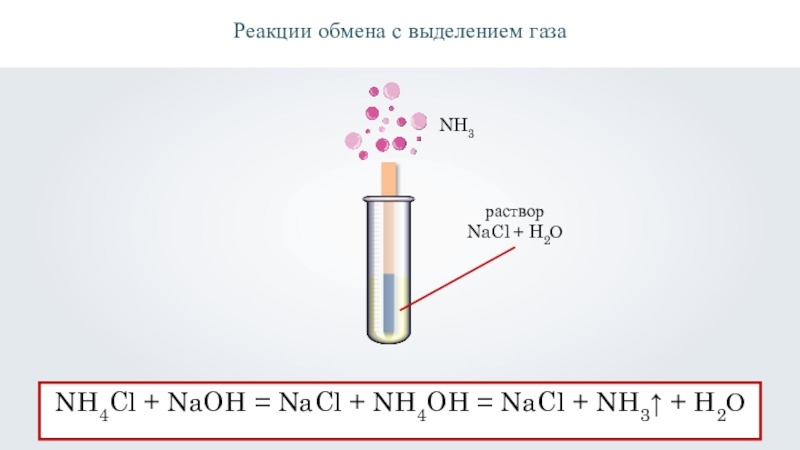
раствор
NaCl + H2О
\
Реакции обмена с выделением газа
NH4Cl + NaOH =
NaCl + NH4OH = NaCl + NH3↑ + H2О
NH3
Слайд 17\
Реакции обмена с выделением воды
Реакции нейтрализации — это реакции взаимодействия сильной
кислоты со щёлочью, в результате которых образуется малодиссоциирующее вещество — вода.
Слайд 20\
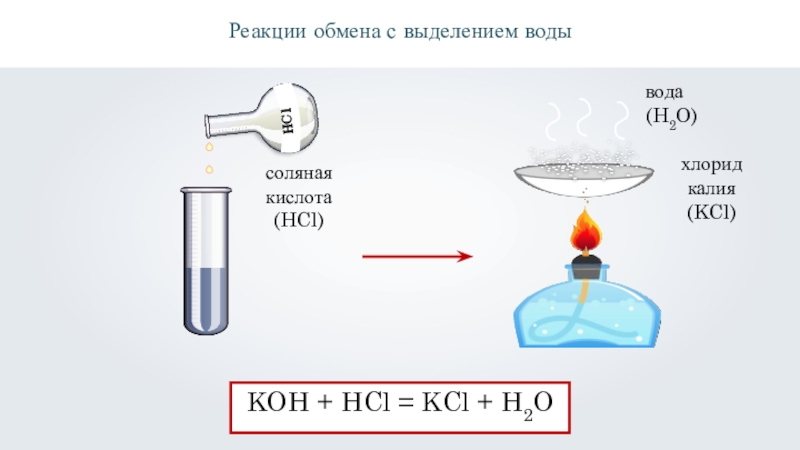
Реакции обмена с выделением воды
соляная
кислота
(HCl)
хлорид
калия
(KCl)
KOH + HCl
= KCl + H2O
вода
(H2O)
Слайд 22
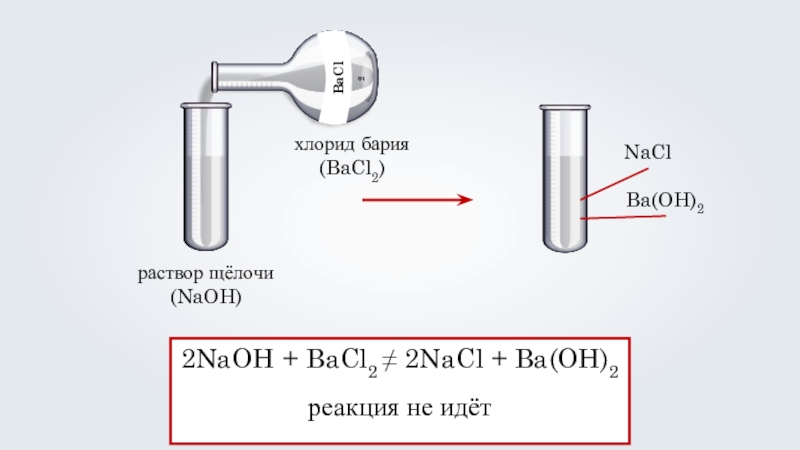
раствор щёлочи
(NaOH)
хлорид бария
(BaCl2)
NaCl
Ba(OH)2
2NaOH + BaCl2 ≠ 2NaCl + Ba(OH)2
реакция
не идёт