- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Реакции ионного обмена
Содержание
- 1. Реакции ионного обмена
- 2. Цель: закрепить навык составления уравнений реакций в ионном виде
- 3. Вставьте пропущенные слова: Уравнения реакций, в
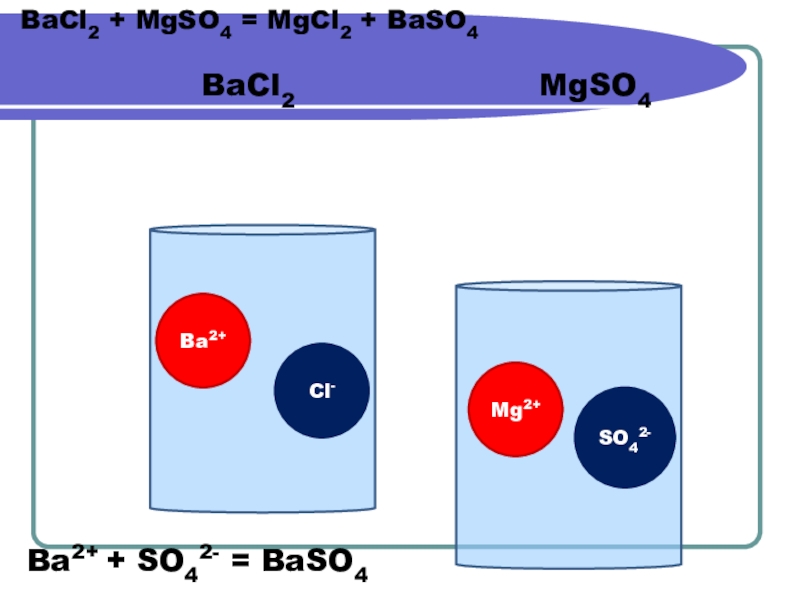
- 4. BaCl2Ba2+Cl-Mg2+SO42-MgSO4BaCl2 + MgSO4 = MgCl2 + BaSO4Ba2+ + SO42- = BaSO4
- 5. + 2 H2O= 2 Na++ SO42-2 H++SO42-+
- 6. Распределите вещества в два столбикаРасписываем на ионы Оставляем в виде молекулH2OH2SO4MgSNa2CO3NaOHSO2K2SiO3Fe(OH)2
- 7. Ошибка Уберите вещества, которые не надо расписывать на ионы при составлении ионного уравнения:О2NaOHОшибкаNaClОшибкаK2SO4CO2ОшибкаH2SO4CaCO3ОшибкаMg(NO3)2ОшибкаCuCl2BaSO4H2OН2SCu(OH)2SО3ОшибкаFeCl3ОшибкаNaNO3ОшибкаK2SОшибкаCa(OH)2ОшибкаAl(NO3)3ОшибкаNa2CO3
- 8. Ученик составил полные ионные уравнения для данных
- 9. Закончить уравнения реакций в молекулярном виде. Записать
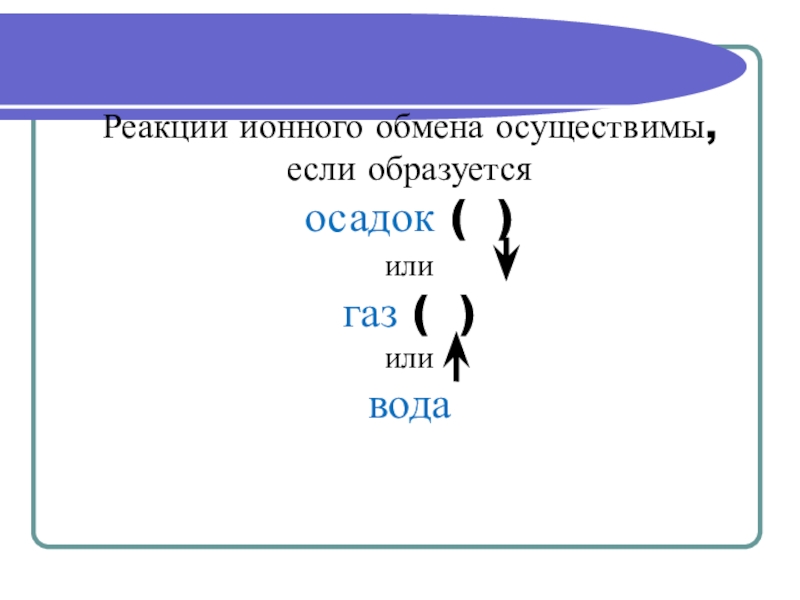
- 10. Реакции ионного обмена осуществимы, если образуется осадок ( )или газ ( )или вода
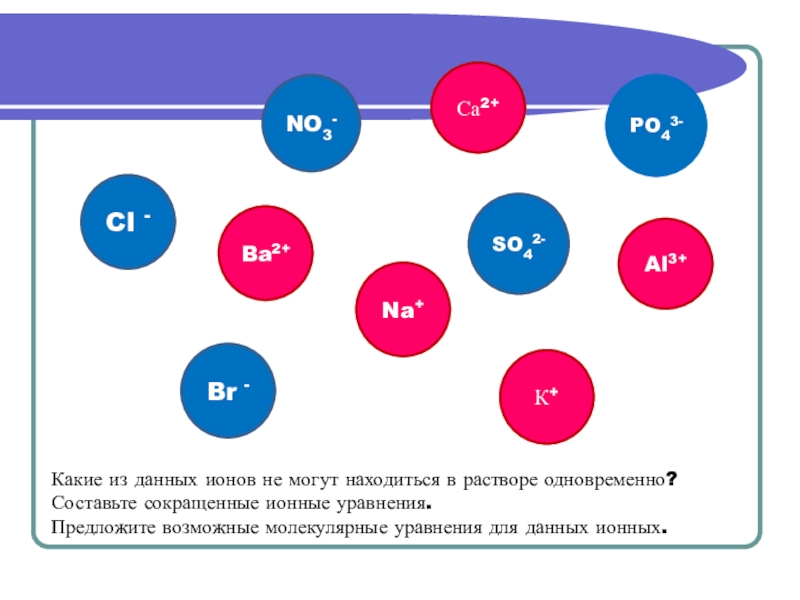
- 11. Br -Cl -SO42-NO3-Ba2+PO43-Na+Са2+К+Al3+Какие из данных ионов не
- 12. Самостоятельная работаСоставьте уравнения реакций в молекулярной, ионной
- 13. Проверь себя:Вариант 13 CaCl2 + 2 K3PO4
- 14. Домашнее задание:§ 37 (повторить).Придумать свои реакции, в
Слайд 3
Вставьте пропущенные слова:
Уравнения реакций, в которых вещества записаны в
Уравнения реакций, в которых вещества записаны в виде ионов, называются ___________.
Чтобы составить ионное уравнение, надо записать в виде ионов все _________ ____________.
Сильными электролитами являются:
соли: ______________,
кислоты: ________________________,
основания: ____________________________.
молекулярными
электролиты
растворимые
ионными
серная, соляная, азотная
сильные
NaOH, KOH, Ba(OH)2, Ca(OH)2
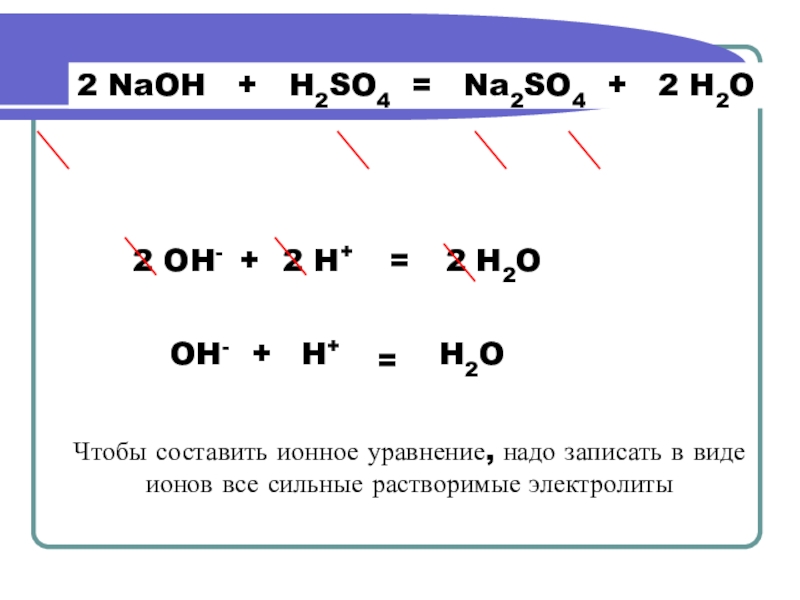
Слайд 5+ 2 H2O
= 2 Na++ SO42-
2 H++SO42-
+ 2 OH- +
2 Na+
2
2 OH-
2 H+
=
2 H2O
OH-
+
=
+
H2O
H+
Чтобы составить ионное уравнение, надо записать в виде ионов все сильные растворимые электролиты
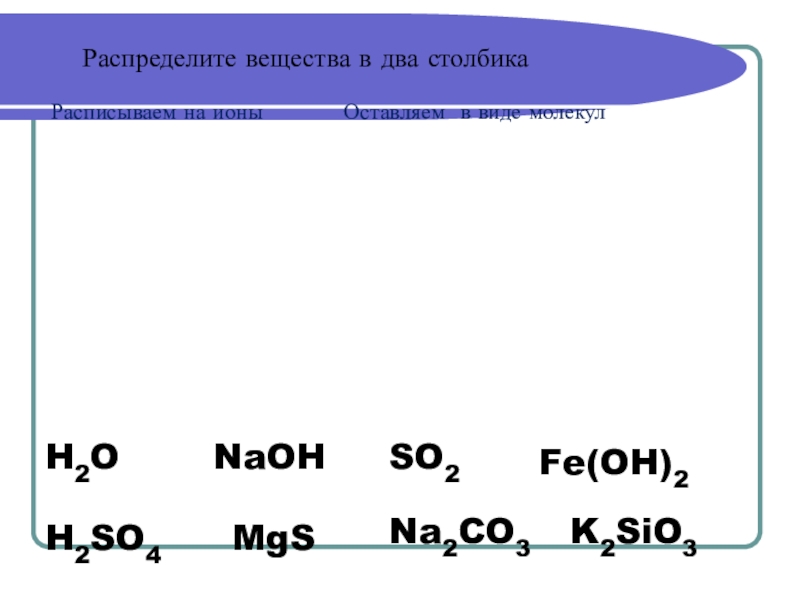
Слайд 6Распределите вещества в два столбика
Расписываем на ионы
H2O
H2SO4
MgS
Na2CO3
NaOH
SO2
K2SiO3
Fe(OH)2
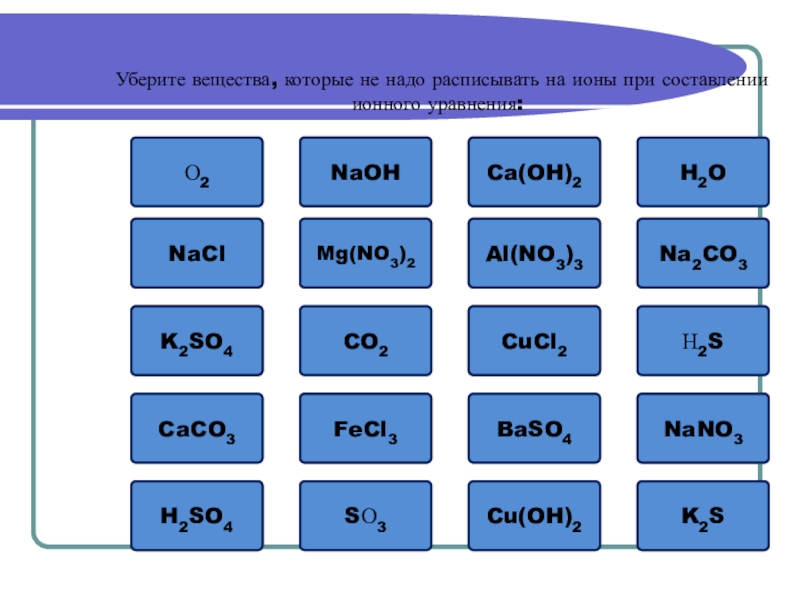
Слайд 7Ошибка
Уберите вещества, которые не надо расписывать на ионы при составлении
О2
NaOH
Ошибка
NaCl
Ошибка
K2SO4
CO2
Ошибка
H2SO4
CaCO3
Ошибка
Mg(NO3)2
Ошибка
CuCl2
BaSO4
H2O
Н2S
Cu(OH)2
SО3
Ошибка
FeCl3
Ошибка
NaNO3
Ошибка
K2S
Ошибка
Ca(OH)2
Ошибка
Al(NO3)3
Ошибка
Na2CO3
Слайд 8Ученик составил полные ионные уравнения для данных молекулярных. Исправьте ошибки. Составьте
Fe (OH)3 + 3 HCl = FeCl3 + 3 H2O
Fe3+ + 3 OH- + 3 H+ + 3 Cl- = Fe 2+ + 3 Cl - + 3 H2O
Са (OH)2 + 2 HCl = CaCl2 + 2 H2O
Ca2+ + OH- + 2 H+ + Cl- = Ca2+ + Cl- + 2 H2O
Ba (NO3)2 + Na2SO4 = BaSO4 + 2 NaNO3
Ba + 2 NO3 + 2 Na + SO4 = BaSO4 + 2 Na + 2 NO3
Слайд 9Закончить уравнения реакций в молекулярном виде. Записать их в ионном виде.
К2СО3
NaОH + ZnCl2 =
Mg(ОH)2 + HNO3 =
К2SО4 + NaCl =
Слайд 11Br -
Cl -
SO42-
NO3-
Ba2+
PO43-
Na+
Са2+
К+
Al3+
Какие из данных ионов не могут находиться в растворе
Составьте сокращенные ионные уравнения.
Предложите возможные молекулярные уравнения для данных ионных.
Слайд 12Самостоятельная работа
Составьте уравнения реакций в молекулярной, ионной и сокращенной ионной формах
Вариант
Вариант 2
CaCl2 + K3PO4 =
2) Cu (OH)2 + 2 HCl =
Al Cl3 + Ag NO3 =
Zn (OH)2 + 2 HNO3 =
Слайд 13Проверь себя:
Вариант 1
3 CaCl2 + 2 K3PO4 = Ca3 (PO4)2 +
3 Са2+ + 6 Cl- + 6 K+ + 2 PO43- = Ca3 (PO4)2 + 6K+ + 6Cl-
3 Са2+ + 2 PO43- = Ca3 (PO4)2
2) Cu (OH)2 + 2 HCl = CuCl2 + 2 H2O
Cu (OH)2 + 2 H+ + 2Cl- = Cu2+ + 2 Cl- + 2 H2O
Cu (OH)2 + 2 H+ = Cu2+ + 2 H2O
Вариант 2
Al Cl3 + 3 Ag NO3 = Al (NO3)3 + 3AgCl
Al3+ + 3Cl- + 3 Ag+ + 3 NO3- = Al3+ + 3NO3- + 3AgCl
Cl- + Ag+ = AgCl
2) Zn (OH)2 + 2 HNO3 = Zn (NO3)2 + 2 H2O
Zn (OH)2 + 2 H+ + 2 NO3- = Zn2+ + 2 NO3- + 2 H2O
Zn (OH)2 + 2 H+ = Zn2+ + 2 H2O
Слайд 14Домашнее задание:
§ 37 (повторить).
Придумать свои реакции, в которых бы:
А) образовался осадок;
Б)
В) реакции не происходило.
Составить уравнения в молекулярном и ионном виде.