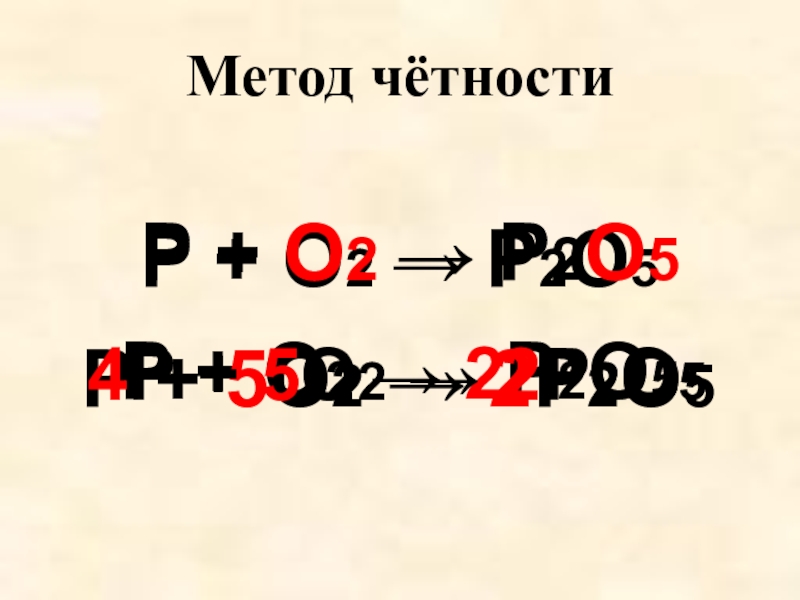знать закон сохранения массы веществ М.В.Ломоносова;
понимать необходимость расстановки коэффициентов;
знать правила расстановки коэффициенты;
использовать правила при расстановке коэффициентов;
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Расстановка коэффициентов в уравнениях химических реакций
Содержание
- 1. Расстановка коэффициентов в уравнениях химических реакций
- 2. Тема урока: Расстановка коэффициентов в уравнениях химических
- 3. КоэффициентЦифра, показывающая количество вещества (моль) Может быть дробнымЦифра, показывающая число молекул, атомовПоловину молекулы взять невозможно
- 4. Метод подбораP + O2 → P2O52P +
- 5. Метод наименьшего общего кратногоP + O2 →
- 6. Метод чётностиP + O2 → P2O5P +
- 7. Расстановка коэффициентов Если в схеме реакции есть формула соли, то вначале уравнивают число ионов, образующих соль.
- 8. Расстановка коэффициентов Если в схеме реакции есть
- 9. Расстановка коэффициентов Если вещества содержат водород и
Тема урока: Расстановка коэффициентов в уравнениях химических реакций Цифра, показывающая количество вещества (моль) Может быть дробнымЦифра, показывающая число молекул, атомовПоловину молекулы взять невозможноКоэффициент
Слайд 2Тема урока: Расстановка коэффициентов в уравнениях химических реакций
Цифра, показывающая количество
вещества (моль) Может быть дробным
Цифра, показывающая число молекул, атомов
Половину молекулы взять невозможно
Цифра, показывающая число молекул, атомов
Половину молекулы взять невозможно
Коэффициент
Слайд 3Коэффициент
Цифра, показывающая количество вещества (моль) Может быть дробным
Цифра, показывающая
число молекул,
атомов
Половину молекулы взять невозможно
Половину молекулы взять невозможно
Слайд 7Расстановка коэффициентов
Если в схеме реакции
есть формула соли,
то вначале
уравнивают
число ионов,
образующих соль.
число ионов,
образующих соль.
Слайд 8Расстановка коэффициентов
Если
в схеме реакции
есть несколько формул солей,
то
начинают уравнивать
с ионов, входящих в состав соли, содержащей большее их число.
с ионов, входящих в состав соли, содержащей большее их число.
Слайд 9Расстановка коэффициентов
Если
вещества содержат водород и кислород,
то атомы водорода
уравнивают в предпоследнюю очередь,
а атомы кислорода в последнюю.
а атомы кислорода в последнюю.