- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Презинтация по теме: Периодический закон и периодическая таблица Д.И.Менделеева.
Содержание
- 1. Презинтация по теме: Периодический закон и периодическая таблица Д.И.Менделеева.
- 2. Слайд 2
- 3. «Будущее не грозит разрушением периодическому зако-ну, а только надстройки и развитие обещаю…» Д.И. Менделеев
- 4. Открытию периодического закона предшествовало накопление знаний
- 5. Открытие Периодического закона Ко времени открытия Периодического
- 6. В основу своей работы по классификации
- 7. При переходе от лития к фтору
- 8. Если написать ряды один под другим так,
- 9. Li Be B
- 10. На основании своих наблюдений 1 марта
- 11. Периодическая закон химических элементов Свойства химических
- 12. Открытый Д. И. Менделеевым закон и построенная
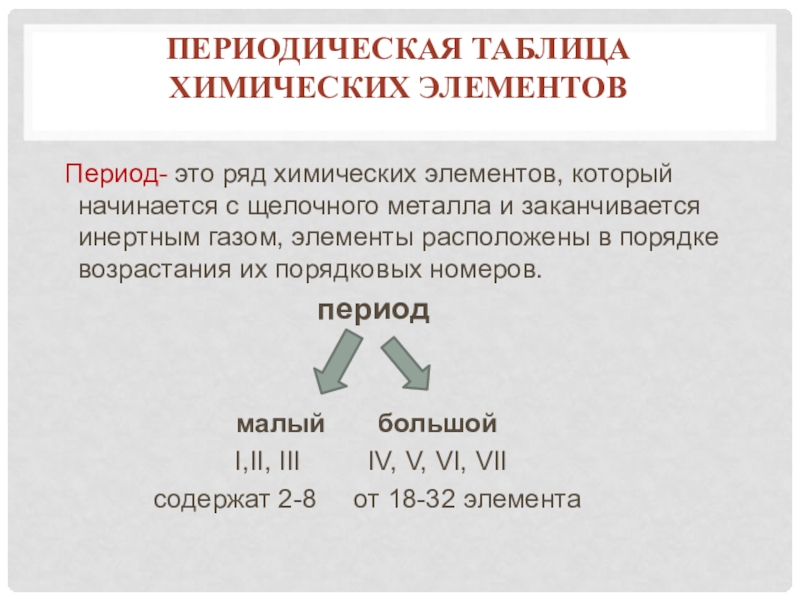
- 13. Периодическая таблица химических элементов Период-
- 14. Периодическая таблица химических элементов Периоды - горизонтальные ряды
- 15. Периодическая таблица химических элементов В периоде:
- 16. Периодическая таблица химических элементов Группы - вертикальные столбцы элементов
- 17. Периодическая таблица химических элементов
- 18. Периодическая таблица химических элементов В группеB
- 19. Радиус атома с увеличением зарядов ядер атомов
- 20. В одной и той же группе с
Слайд 3«Будущее не грозит разрушением периодическому зако-ну, а только надстройки и развитие обещаю…»
Слайд 4
Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По
Открытие Периодического закона
Слайд 5Открытие Периодического закона
Ко времени открытия Периодического закона было известно 63 элемента
Слайд 6
В основу своей работы по классификации химических элементов Д.И. Менделеев положил
Открытие Периодического закона
Слайд 7
При переходе от лития к фтору происходит закономерное ослабление металлических
При переходе от фтора к следующему по значению атомной массы элементу натрию происходит скачок в изменении свойств (Nа повторяет свойства Li)
За Na следует Mg, который сходен с Ве - они проявляют металлические свойства. А1, следующий за Mg, напоминает В. Как близкие родственники, похожи Si и С; Р и N; S и О; С1 и F.
При переходе к следующему за С1 элементу К опять происходит скачок в изменении и химических свойств.
Что же было обнаружено?
Слайд 8
Если написать ряды один под другим так, чтобы под литием находился
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
Периодическая закон
Д.И. Менделеева
Слайд 9 Li Be B C
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбики
попадают элементы, сходные по своим свойствам.
Периодическая закон
Д.И. Менделеева
Слайд 10
На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал
Первый вариант Периодической таблицы
Слайд 11Периодическая закон
химических элементов
Свойства химических элементов
находятся в периодической
зависимости от
номера (от зарядов их атомных ядер)
химических элементов.
Современная формулировка периодического закона.
Слайд 12 Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая
Периодическая таблица
химических элементов
Слайд 13Периодическая таблица
химических элементов
Период- это ряд химических элементов, который начинается
период
малый большой
I,II, III IV, V, VI, VII
содержат 2-8 от 18-32 элемента
Слайд 14Периодическая таблица
химических элементов
Периоды - горизонтальные ряды химических элементов, всего 7
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
Слайд 15Периодическая таблица
химических элементов
В периоде:
Na Mg Al Si P S
Металлические свойства ослабевают
Неметаллические свойства усиливаются
Слайд 16Периодическая таблица
химических элементов
Группы - вертикальные столбцы элементов с одинаковой валентностью, высшим
В таблице VIIIгрупп.
Слайд 17Периодическая таблица
химических элементов
главная побочная (подгруппа)
Входят элементы
больших и малых
Периодов
H Li Na K Rb Cs Fr
Входят элементы
больших периодов
Cu Ag Au
Слайд 18Периодическая таблица
химических элементов
В группе
B Al Ga In
Металлические свойства усиливаются.
Неметаллические свойства усиливаются.
Слайд 19 Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к.
Изменение радиуса атома в периоде
Слайд 20 В одной и той же группе с увеличением номера периода атомные
Изменение радиуса атома в группе