- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Презентатция §8.10 Аммиак (10 класс)
Содержание
- 1. Презентатция §8.10 Аммиак (10 класс)
- 2. Сабақтың мақсаттары: Білімділік: аммиак, қолданылуы, алынуы туралы
- 3. Үй тапсырмасы: АзотЖұлдызшалардағы сұраққа жауап беріңіз.
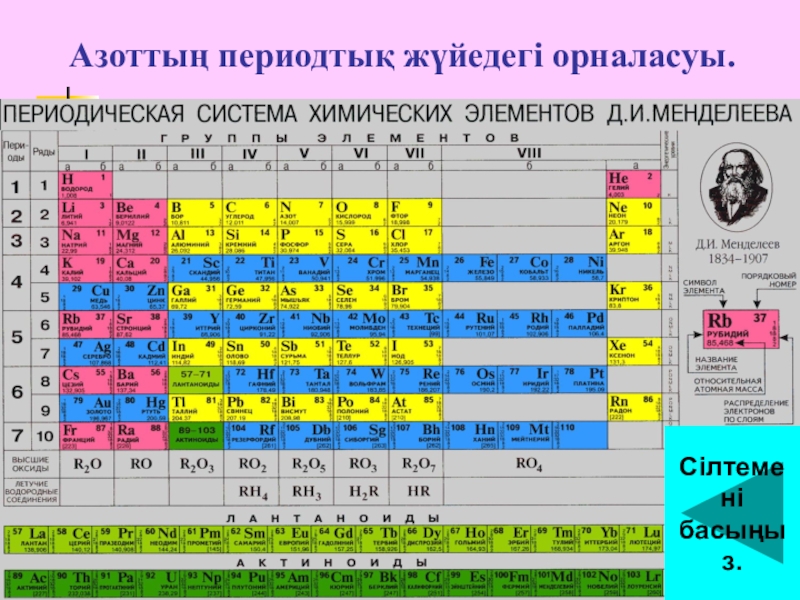
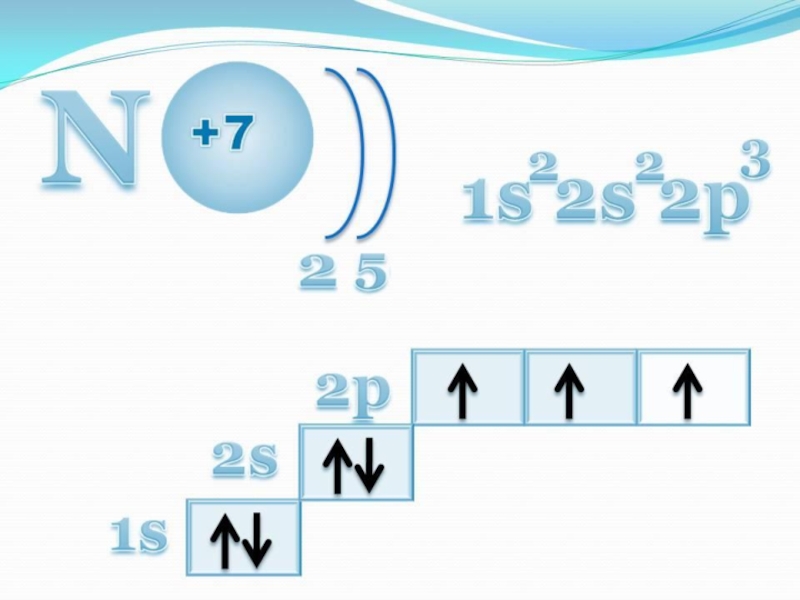
- 4. Азоттың периодтық жүйедегі орналасуы.Сілтемені басыңыз.
- 5. Азоттың физикалық қасиеттері.Сілтемені басыңыз.
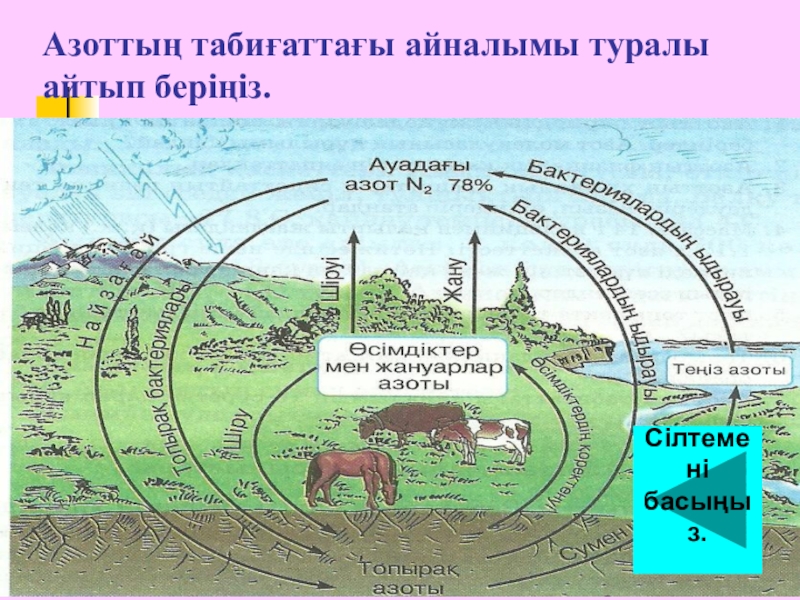
- 6. Азоттың табиғаттағы айналымы туралы айтып беріңіз.Сілтемені басыңыз.
- 7. Азоттың химиялық қасиеттеріСілтемені басыңыз.
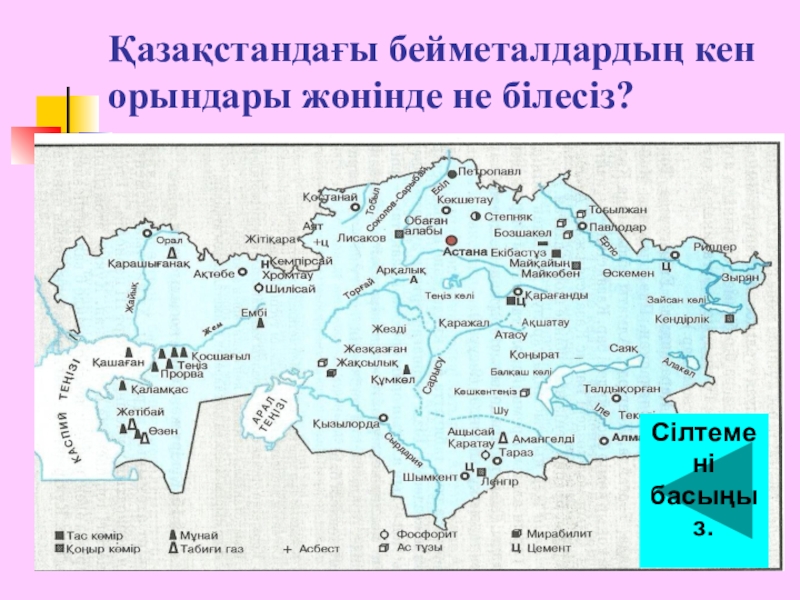
- 8. Қазақстандағы бейметалдардың кен орындары жөнінде не білесіз?Сілтемені басыңыз.
- 9. Азоттың биологиялық маңызы.Сілтемені басыңыз.
- 10. Тест жұмысы 1. Азот
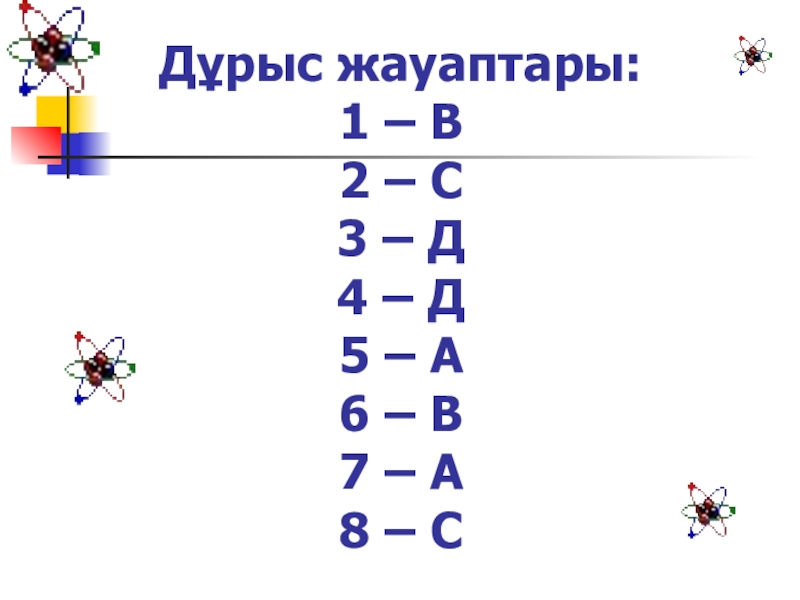
- 11. Дұрыс жауаптары: 1 – В 2 –
- 12. Бағалау критериі 7,8 – «5» 5,6 – «4» 3,4 – «3» 1,2 – «2»
- 13. Слайд 13
- 14. Сабақтың тақырыбы: Аммиак22.10.2015 жыл
- 15. Аммиактың өнеркәсіпте алынуы 3H₂ + N₂ = 2NH₃↑ + Q
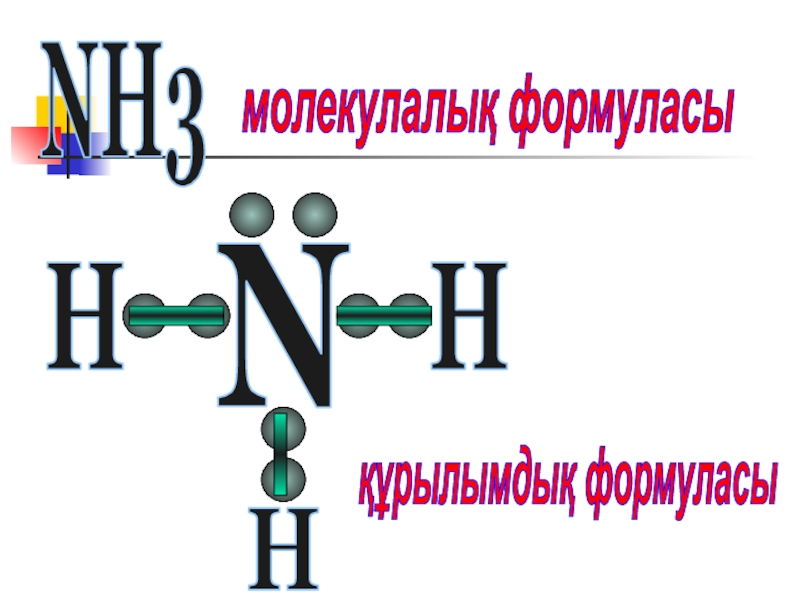
- 16. NH3молекулалық формуласыNқұрылымдық формуласыHHH
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. 2NH4CІ+Ca(OH)2 =2NH3↑ +CaCІ2 +2H2OЛабораторияда қатты аммоний хлориді NH4CІ мен сөндірілген әкті Ca(OH)2 араластырып, қыздырып, аммиак алады
- 21. Аммиактың алынуы 2NH₄ CL + Ca(OH)₂
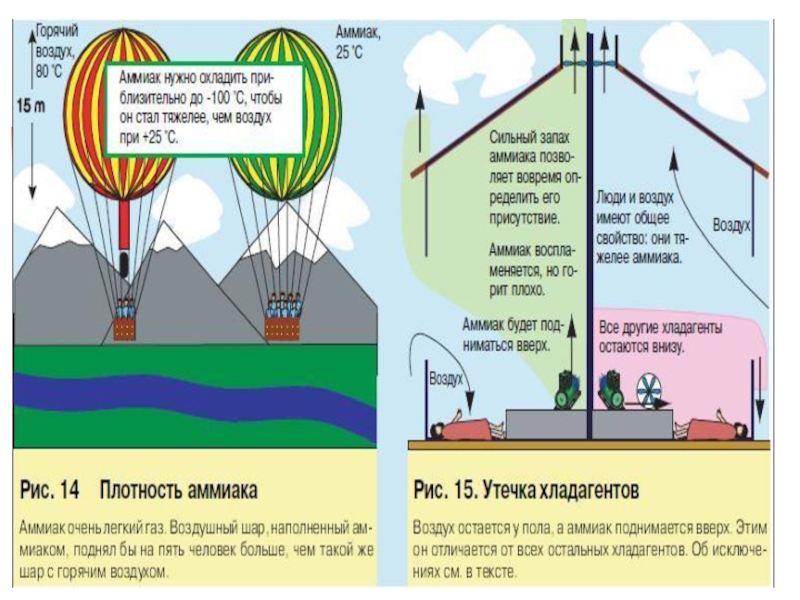
- 22. Физикалық қасиеттеріNH3 Б = - 33,4 СҚ = - 77,7 С00
- 23. Аммиак суда ерігенде аммиак гидратын NH3•H2O, NН4OH түзеді.
- 24. Аммиактың сулы ерітіндісін тұрмыста мүсәтір спирті деп атайды.
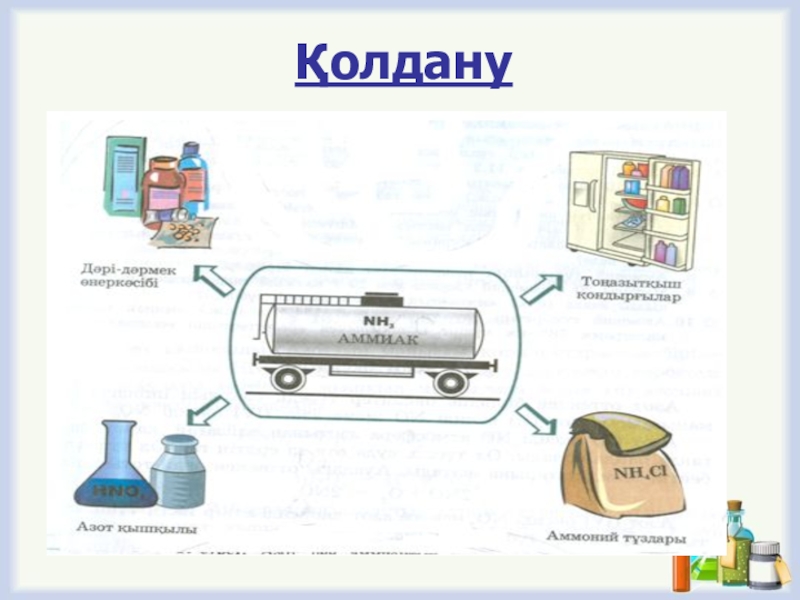
- 25. Қолдану
- 26. Аммоний хлориді түтіндегіш шашкалар жасауға қолданылады.Қолдану
- 27. Аммоний хлориді металлдардың бетіндегі оксидті қабықшаны ерітеді, сондықтан металдарды пайкілеуге қолданылады.
- 28. NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
- 29. Гальваникалық элементтерде (құрғақ батарея)
- 30. Слайд 30
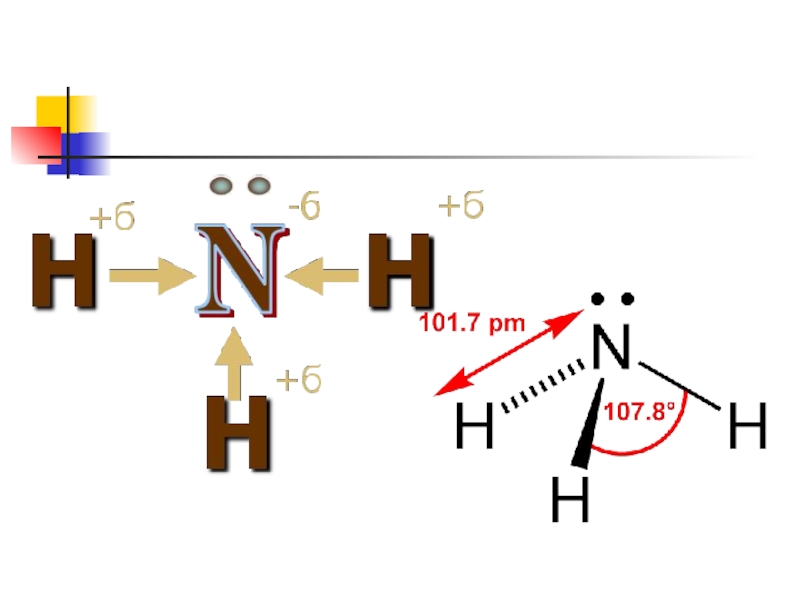
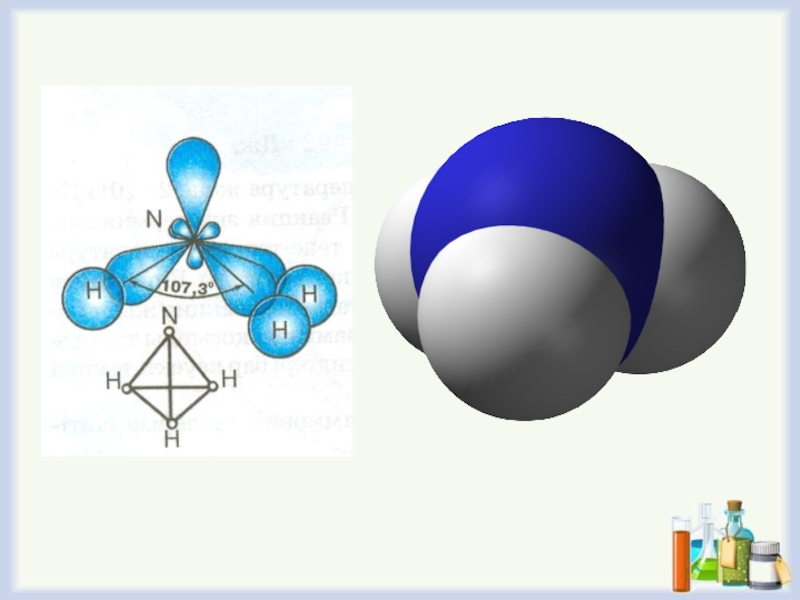
- 31. Аммиактың химиялық қасиеттеріАммиактың сумен әрекеттесуі. NH3
- 32. Аммиактың қышқылдармен әрекеттесуі
- 33. Аммиактың оттекте жануы Сr2O34NH3 + 5O₂ → NО₃↑ + H₂O
- 34. Отсыз түтін
- 35. Талдау (Материалды негізгі компоненттерге жіктеу, саралау, түйіндеу)
- 36. Тапсырма – 3 Көлемі 56л қ.ж.
- 37. Есептің шығарылуыБер:
- 38. Тақырыпты қорытындылау.1.Физикалық қасиеті қандай?2. Қолданылуы.3. Химиялық қасеттері.
- 39. Бағалау
- 40. Үйге тапсырма: §8.10 Аммиак. №5,6 жаттығу.
- 41. Тыңдағандарыңызға рахмет
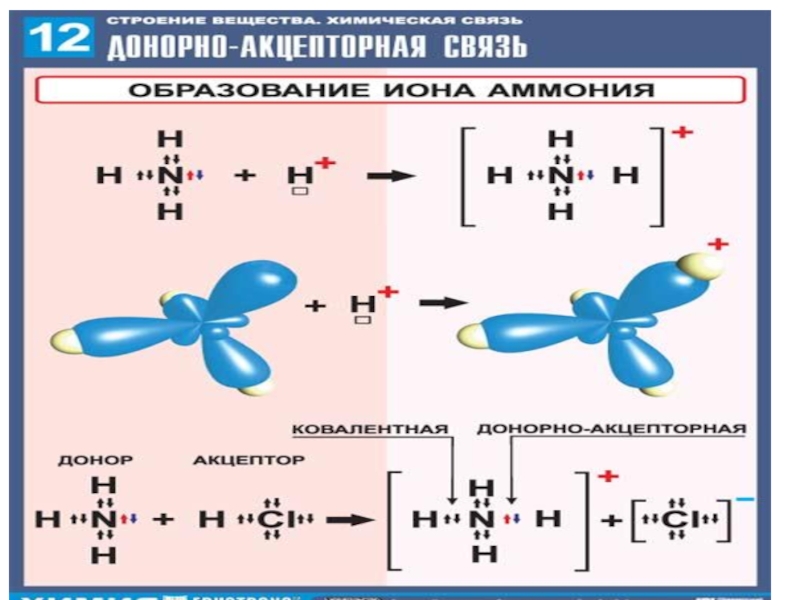
Сабақтың мақсаттары: Білімділік: аммиак, қолданылуы, алынуы туралы білімді жетілдіру;Дамытушылық: аммиактың құрылысының ерекшелігі, донорлы-акцепторлы механизмді, химиялық қасиетімен алынуына байланысты реакция теңдеулерін құрастыра білу, халық шарушылығында қолданылуы, қорытынды жасау, жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
Слайд 1Сабақтың тақырыбы: Аммиак
Кененбаева Жадыра Жұманқұлқызы
Химия және биология пәндерінің оқытушысы
Слайд 2Сабақтың мақсаттары:
Білімділік: аммиак, қолданылуы, алынуы туралы білімді жетілдіру;
Дамытушылық: аммиактың құрылысының
ерекшелігі, донорлы-акцепторлы механизмді, химиялық қасиетімен алынуына байланысты реакция теңдеулерін құрастыра білу, халық шарушылығында қолданылуы, қорытынды жасау, жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
Слайд 10Тест жұмысы
1. Азот атомында қанша s және
p электроны бар:
А) 6s және 9p; В) 4s және 3p ;
С) 6s және 10p; Д) 4s және 4p;
2. Азот қайсы қосылысында +5 және -3 тотығу дәрежесін көрсетеді:
А) NO2 , PH3; В) NO2 , H2 S;
С) N 2O5, NH3; Д) N2 O5, PH3?
3. Азот мына жай заттардың қайсысымен әрекеттеседі
( әр түрлі жағдайда) :
А) CI2 , Au , Pt; В) AI , C , P;
С) F2 , Ag, Au; Д) O2 ,H2 , Mg?
4. Азот 8 электрон қосып алатын сызбанұсқа
А) N-3→N+5 В) N+3→N+5
С) N+5→N+2 Д) N+5→N-3
5. Азоттың жоғарғы тотығу дәрежесі
А) +5 В) +3
С) -3 Д) +4
6. Азоттың ауадағы көлемдік үлесі
А) 21% В) 78,09%
С) 75,6% Д) 77%
7. Азоттың электрондық конфигурациясы
А) 1S22S22P3 В) 1S22S22P4
С) 1S22S22P5 Д) 1S22S22P6
8. Нитридтердің құрамында азот неше валентті?
А) 1 В) 4 С) 3 Д) 5
А) 6s және 9p; В) 4s және 3p ;
С) 6s және 10p; Д) 4s және 4p;
2. Азот қайсы қосылысында +5 және -3 тотығу дәрежесін көрсетеді:
А) NO2 , PH3; В) NO2 , H2 S;
С) N 2O5, NH3; Д) N2 O5, PH3?
3. Азот мына жай заттардың қайсысымен әрекеттеседі
( әр түрлі жағдайда) :
А) CI2 , Au , Pt; В) AI , C , P;
С) F2 , Ag, Au; Д) O2 ,H2 , Mg?
4. Азот 8 электрон қосып алатын сызбанұсқа
А) N-3→N+5 В) N+3→N+5
С) N+5→N+2 Д) N+5→N-3
5. Азоттың жоғарғы тотығу дәрежесі
А) +5 В) +3
С) -3 Д) +4
6. Азоттың ауадағы көлемдік үлесі
А) 21% В) 78,09%
С) 75,6% Д) 77%
7. Азоттың электрондық конфигурациясы
А) 1S22S22P3 В) 1S22S22P4
С) 1S22S22P5 Д) 1S22S22P6
8. Нитридтердің құрамында азот неше валентті?
А) 1 В) 4 С) 3 Д) 5
Слайд 202NH4CІ+Ca(OH)2 =2NH3↑ +CaCІ2 +2H2O
Лабораторияда қатты аммоний хлориді NH4CІ мен сөндірілген әкті
Ca(OH)2 араластырып, қыздырып, аммиак алады
Слайд 21 Аммиактың алынуы 2NH₄ CL + Ca(OH)₂ = NH₃↑ + CaCL₂ +
2 H₂O аммоний хлориді
NH3+ H2SO4 = (NH4)2SO4 аммоний сульфаты
NH3 + H3PO4 = (NH4)3 PO4 аммоний фосфаты
NH3+ H2SO4 = (NH4)2SO4 аммоний сульфаты
NH3 + H3PO4 = (NH4)3 PO4 аммоний фосфаты
Слайд 27Аммоний хлориді металлдардың бетіндегі оксидті қабықшаны ерітеді, сондықтан металдарды пайкілеуге қолданылады.
Слайд 31Аммиактың химиялық қасиеттері
Аммиактың сумен әрекеттесуі.
NH3 + H2O =
NН4OH
қышқылмен:
(NH4)3CO3 + 2HCI = 2NH4СІ +CO2 + H2O
2. тұзбен:
(NH4)2CO3 + BaCI2 = BaCO3 + 2NH4СІ
3. сілтімен:
(NH4)2CO3 + NaOH = Na 2CO3 + 2H2O + NH3
Слайд 35Талдау
(Материалды негізгі компоненттерге жіктеу,
саралау, түйіндеу)
Тапсырма
NH3→ N2→ NO→ NO2→HNO3
↓
Mg3N2
Mg3N2
Слайд 36Тапсырма – 3
Көлемі 56л қ.ж. азот сутектің артық мөлшерімен әрекеттесті.
Түзілген аммиактың қ.ж. көлемін есептеңдер.
Слайд 37Есептің шығарылуы
Бер:
Шешуі:
V(N2)=56л
Vқж=22.4л/моль 56л Хл 56л---------Хл
т/к: V(NH3)=? N2+3H2 = 2NH3
22.4л/моль 2*22.4л/моль 22,4л--------44,8л
Х = 112л
Ж/ы: 112 л
V(N2)=56л
Vқж=22.4л/моль 56л Хл 56л---------Хл
т/к: V(NH3)=? N2+3H2 = 2NH3
22.4л/моль 2*22.4л/моль 22,4л--------44,8л
Х = 112л
Ж/ы: 112 л