- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад ериодический закон и причины периодичности (9класс)
Содержание
- 1. ПрезентацияПериодический закон и причины периодичности (9класс)
- 2. Все состоит из элементов,Все то, что окружает нас:Вода, духи, стекло, пигменты,И воздух, и угарный газ
- 3. В результате изучения темы ,вы будете способны:1.Сравнивать
- 4. Назовите химические элементы VIII группы главной подгруппы.Сколько
- 5. Химические элементы стремятся завершить внешний уровень и
- 6. Сколько электронов на внешнем энергетическом уровне атома
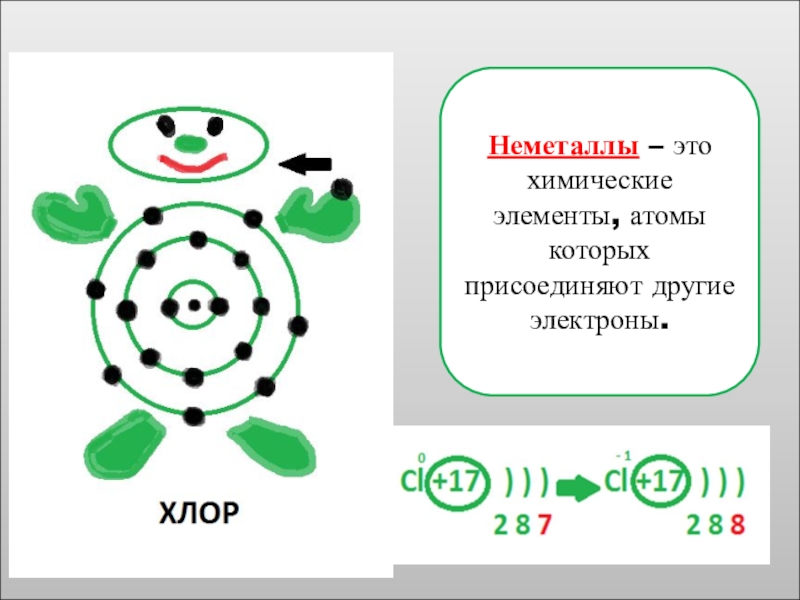
- 7. Неметаллы – это химические элементы, атомы которых присоединяют другие электроны.
- 8. Сколько электронов на внешнем энергетическом уровне атома
- 9. Металлы – это химические элементы, атомы которых отдают свои электроны другим атомам.
- 10. Проблема!!!Электронную конфигурацию какого атома приобретет атом Са
- 11. Проблема!!!Электронную конфигурацию какого атома приобретет атом Сl
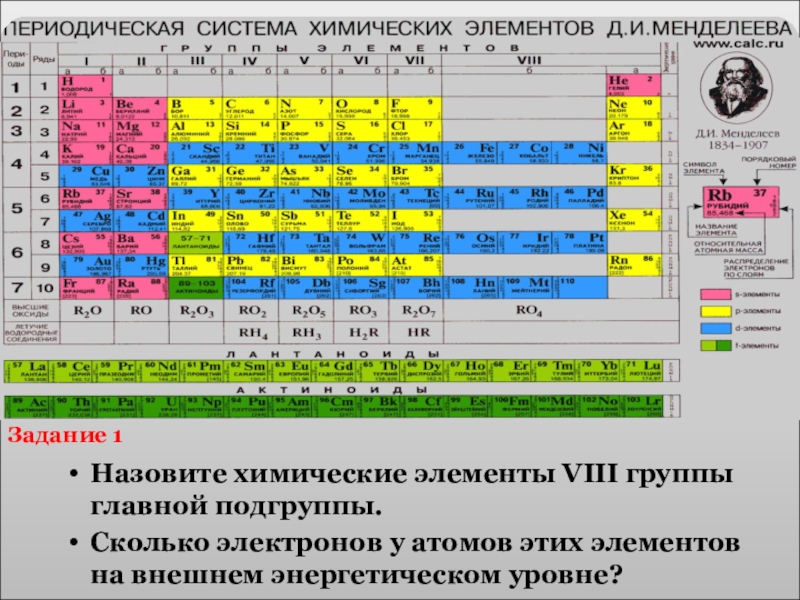
- 12. I.Физический смысл единиц ПСХЭ
- 13. Числупротонов в ядреПорядковый номерэлементаЗарядуядра атомаЧислу электроновФизический смысл порядкового номера химического элемента= численно равенЗадание 6
- 14. Физический смысл положения химического элемента В
- 15. II.Периодическое изменение свойств химических элементов
- 16. Химические элементыНеметаллы Имеют на внешнем энергетическом уровне
- 17. II.1.Изменение свойств ХЭ в периодах
- 18. Назовите все элементы III периода Периодической системы.Как
- 19. Почему радиус атомов химических элементов в периоде слева направо постепенно уменьшается?Задание 9
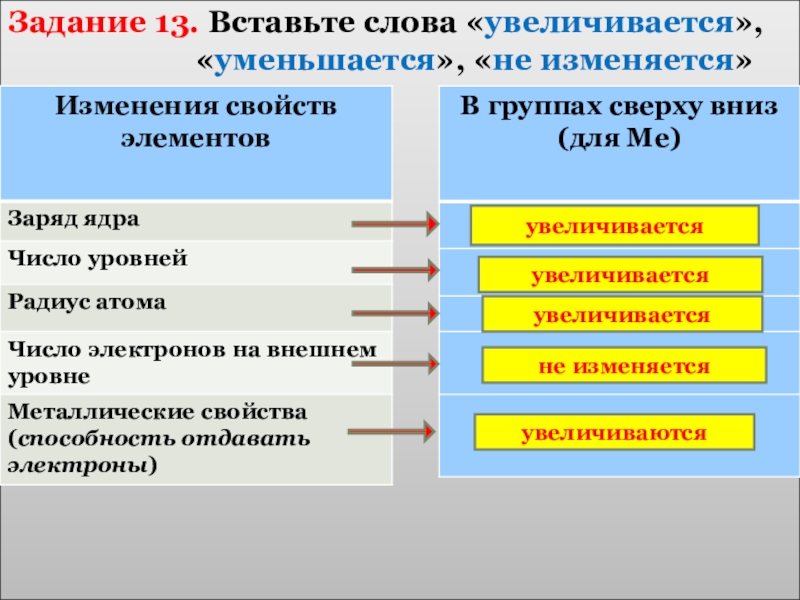
- 20. Задание 10. Вставьте слова «увеличивается»,
- 21. Закономерности изменения свойств химических элементов в периодеВ
- 22. II.2.Изменение свойств ХЭ в группах
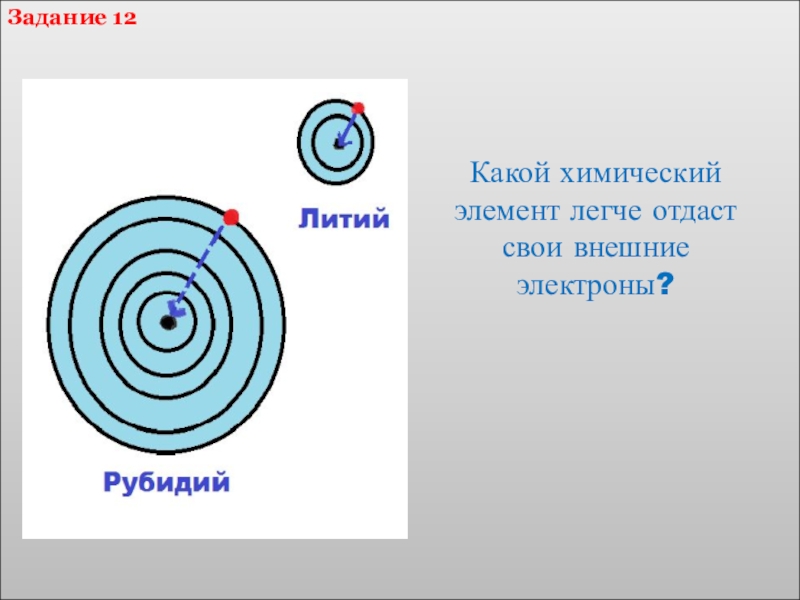
- 23. Назовите элементы I группы главной подгруппы.Как в
- 24. Какой химический элемент легче отдаст свои внешние электроны?Задание 12
- 25. Задание 13. Вставьте слова «увеличивается»,
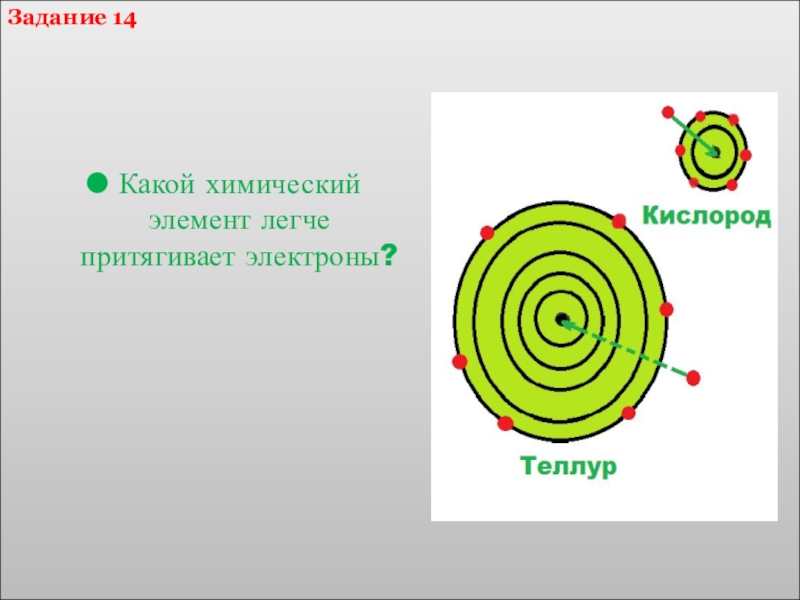
- 26. Какой химический элемент легче притягивает электроны?Задание 14
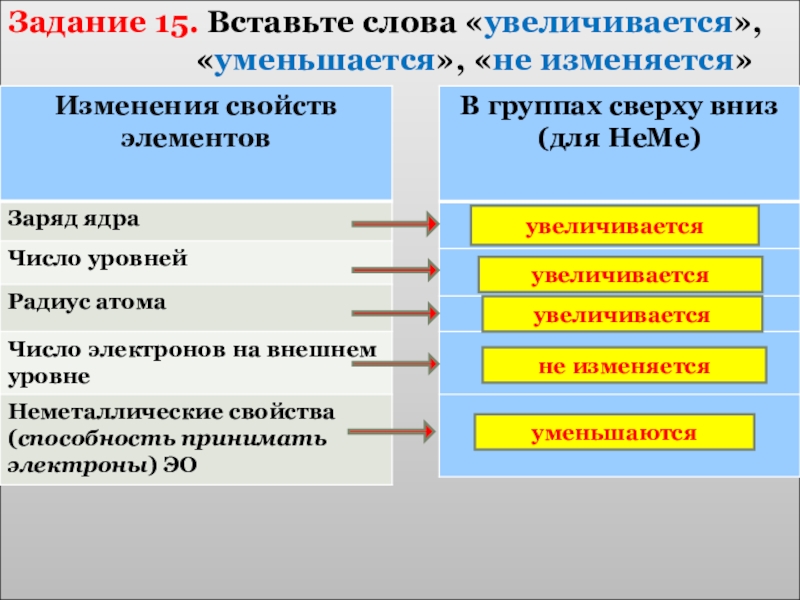
- 27. Задание 15. Вставьте слова «увеличивается»,
- 28. Закономерности изменения свойств химических элементов в группеЧисло
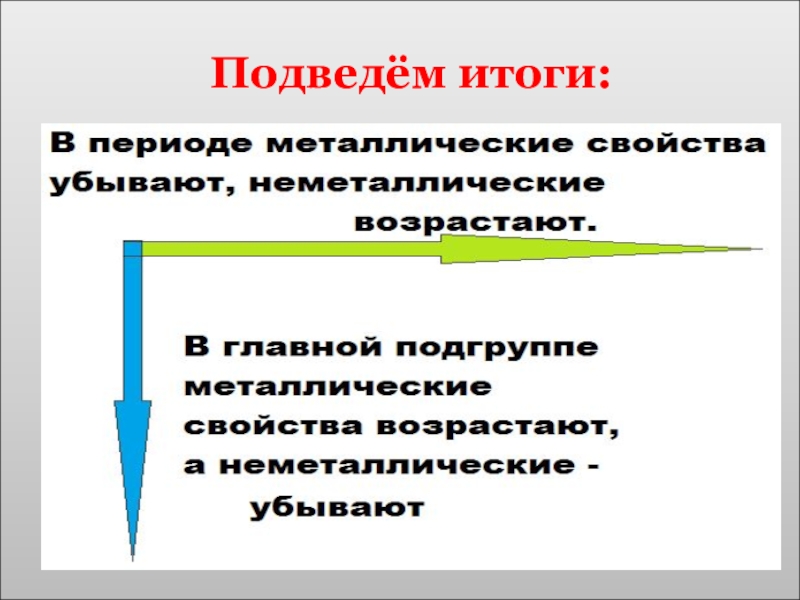
- 29. Подведём итоги:
- 30. 1. Расположите элементы в порядке возрастания заряда
- 31. 4. В ряду химических элементов C →
- 32. 5.В ряду химических элементов бор - углерод
- 33. 6.С увеличением порядкового номера элемента в периоде
- 34. 8.Основная причина изменения свойств элементов в периоде
- 35. 9.В главных подгруппах периодической системы с увеличением
- 36. 10.Из перечисленных элементов наиболее ярко выраженные неметаллические
- 37. 10.В периоде:Б) идет последовательное заполнение электронами одного
- 38. 11.Металлические свойства элементов в периоде:А) увеличиваются слева
- 39. 13.У какого элемента способность принимать электроны проявляется
- 40. 15.В периодах с увеличением заряда ядра атомов:А)
- 41. 16.Основная причина резкого изменения свойств ХЭ при
- 42. Разобрать и выучить конспект.Выучить параграф: § 2.5Выполнить упр: 1,2,7,9,10,3*,4*,5*Домашнее задание
Слайд 1
Периодический закон. Причины периодичности.
9 класс
Бозаджи Н.М.
учитель химии
высшей категории
Слайд 2Все состоит из элементов,
Все то, что окружает нас:
Вода, духи, стекло, пигменты,
И
Слайд 3
В результате изучения темы ,
вы будете способны:
1.Сравнивать периодические свойства элементов и
атомные радиусы,
электроотрицательность,
металлические и неметаллические свойства,
2.Обобщать и систематизировать понятия и навыки по изученной теме.
3.Осуществлять рефлексию своей деятельности.
Слайд 4
Назовите химические элементы VIII группы главной подгруппы.
Сколько электронов у атомов этих
Задание 1
Слайд 5
Химические элементы стремятся завершить внешний уровень и стать похожими на инертные
Внешний энергетический уровень, содержащий 8 электронов, называется завершённым.
Слайд 6
Сколько электронов на внешнем энергетическом уровне атома хлора?
Сколько электронов не хватает
Как хлор может завершить свой внешний уровень до 8 электронов?
На какой инертный газ станет похожим хлор, завершив внешний уровень?
Задание 2
Слайд 8
Сколько электронов на внешнем энергетическом уровне атома натрия?
Сколько электронов не хватает
Как натрий может завершить свой внешний уровень до «восьмёрки»?
На какой инертный газ станет похожим натрий?
Задание 3
Слайд 10Проблема!!!
Электронную конфигурацию
какого атома приобретет атом Са
отдавая свои 2 электрона
Ar – аргона
Задание 4
Слайд 11Проблема!!!
Электронную конфигурацию
какого атома приобретет атом Сl
принимая 1 электрон превращаясь
Ar – аргона
Задание 5
Слайд 13Числу
протонов в ядре
Порядковый номер
элемента
Заряду
ядра атома
Числу
электронов
Физический смысл порядкового номера химического элемента
=
Задание 6
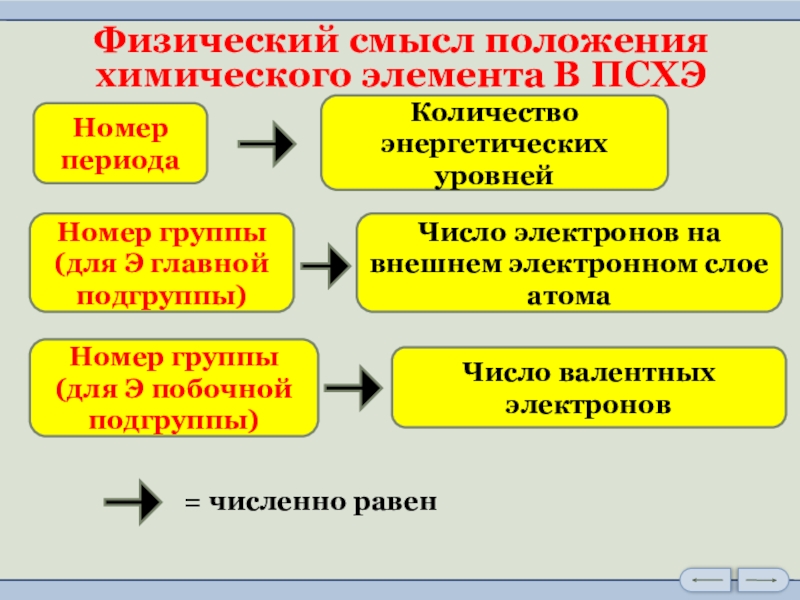
Слайд 14Физический смысл положения
химического элемента В ПСХЭ
Номер периода
Количество энергетических уровней
Номер группы
(для
Число электронов на внешнем электронном слое атома
Номер группы
(для Э побочной подгруппы)
Число валентных
электронов
= численно равен
Слайд 16
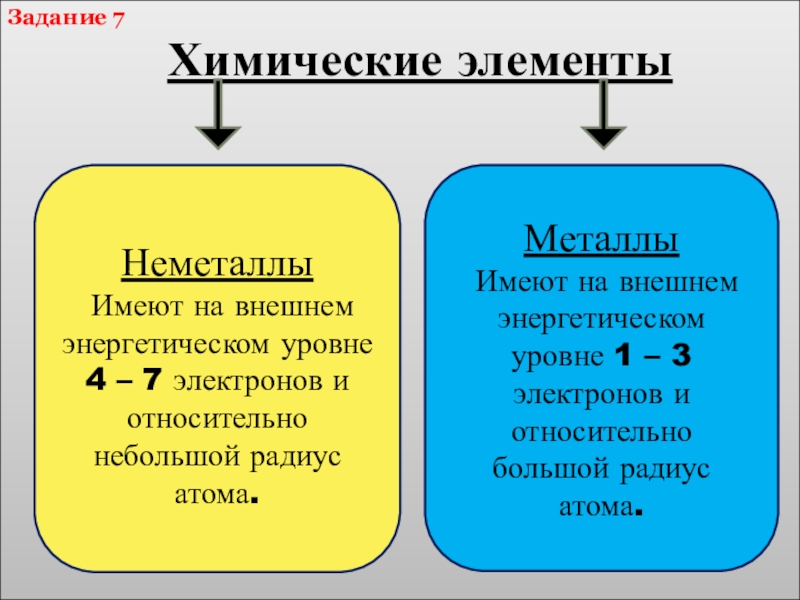
Химические элементы
Неметаллы
Имеют на внешнем энергетическом уровне 4 – 7 электронов
Металлы
Имеют на внешнем энергетическом уровне 1 – 3 электронов и относительно большой радиус атома.
Задание 7
Слайд 18
Назовите все элементы III периода Периодической системы.
Как изменяется в периоде слева
Число электронов на внешнем уровне?
Какие элементы в периоде будут металлами, а какие неметаллами?
Задание 8
Слайд 19
Почему радиус атомов химических элементов в периоде слева направо постепенно уменьшается?
Задание
Слайд 20
Задание 10. Вставьте слова «увеличивается»,
увеличивается
не изменяется
уменьшается
увеличивается
уменьшаются
увеличиваются
Слайд 21Закономерности изменения свойств химических элементов в периоде
В периоде
(малом)
Постепенно увеличивается число
Увеличивается валентность в высшем оксиде от 1 до 7
Постепенно уменьшается радиус атома
Металлические свойства постепенно ослабевают, а неметаллические - усиливаются
Слайд 23
Назовите элементы I группы главной подгруппы.
Как в подгруппе сверху вниз изменяется
Число электронов на внешнем уровне?
Металлами или неметаллами являются эти элементы?
У какого из элементов металлические свойства проявляются сильнее?
Задание 11
Слайд 25
Задание 13. Вставьте слова «увеличивается»,
увеличивается
увеличивается
увеличивается
не изменяется
увеличиваются
Слайд 27
Задание 15. Вставьте слова «увеличивается»,
увеличивается
увеличивается
увеличивается
не изменяется
уменьшаются
Слайд 28Закономерности изменения свойств химических элементов в группе
Число электронов на внешнем слое
Одинаковая валентность
Постепенно увеличивается количество энергетических уровней
Ослабевают неметаллические свойства
Усиливаются металлические свойства
В группе (главной подгруппе)
Слайд 301. Расположите элементы в порядке возрастания заряда ядра атома:
2. Расположите элементы в порядке убывания радиуса атома: Be, Ca, Ba, Mg.
3. Расположите элементы в порядке усиления неметаллических свойств: P, S, Mg, Al.
Задание 16
ТЕСТ
Слайд 314. В ряду химических элементов
C → Si → Ge →
1) увеличивается число электронных слоёв
2) увеличивается электроотрицательность
3) увеличиваются неметаллические свойства
4) уменьшается число протонов в ядре атома
Слайд 325.В ряду химических элементов бор - углерод - азот возрастает:
1) способность
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
Слайд 336.С увеличением порядкового номера элемента в периоде радиус атома:
А) увеличивается
Б) уменьшается
В) не изменяется
7.Из перечисленных элементов самый большой радиус атома имеет:
А) натрий
Б) магний
В) алюминий
Слайд 348.Основная причина изменения свойств элементов в периоде заключается в постепенном увеличении:
А)
Б) атомной массы
В) количества электронов в атоме
Г) количества нейтронов в ядрах атомов
Слайд 359.В главных подгруппах периодической системы с увеличением заряда ядра атомов:
А) усиливаются
Б) ослабевают металлические свойства элементов
В) усиливаются неметаллические свойства элементов
Г) ослабевают неметаллические свойства элементов
Слайд 3610.Из перечисленных элементов наиболее ярко выраженные неметаллические свойства проявляет:
А) кислород
Слайд 3710.В периоде:
Б) идет последовательное заполнение электронами одного энергетического подуровня
В) идет последовательное
А) идет последовательное заполнение электронами одного энергетического уровня
Слайд 3811.Металлические свойства элементов в периоде:
А) увеличиваются слева направо
В) не изменяются
12.Радиус атома
А) уменьшается сверху вниз
В) правильного ответа нет
Б) уменьшаются слева направо
Б) увеличиваются сверху вниз
Слайд 3913.У какого элемента способность принимать электроны проявляется сильнее:
А) В
В) O
14.У какого элемента способность отдавать электроны проявляются сильнее:
Б) Al
В) Mg Г) Cl
Г) F
А) Na
Слайд 4015.В периодах с увеличением заряда ядра атомов:
А) усиливаются металлические свойства элементов
Г)
Б) усиливаются неметаллические
свойства элементов
В) ослабевают металлические
свойства элемента
Слайд 4116.Основная причина резкого изменения свойств ХЭ при переходе от одного периода
А) постепенном накоплении электронов на внешнем энергетическом уровне атома
Б) появлении нового энергетического уровня
В) постепенном увеличении атомной массы
Г) увеличении количества нейтронов в ядре атома
Слайд 42
Разобрать и выучить конспект.
Выучить параграф: § 2.5
Выполнить упр:
Домашнее задание