- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Закон сохранения массы 8 класс химия
Содержание
- 1. Презентация Закон сохранения массы 8 класс химия
- 2. Валентность1. Что такое валентность?Валентность – свойство атомов
- 3. 3. Как определить валентность неметаллов по их
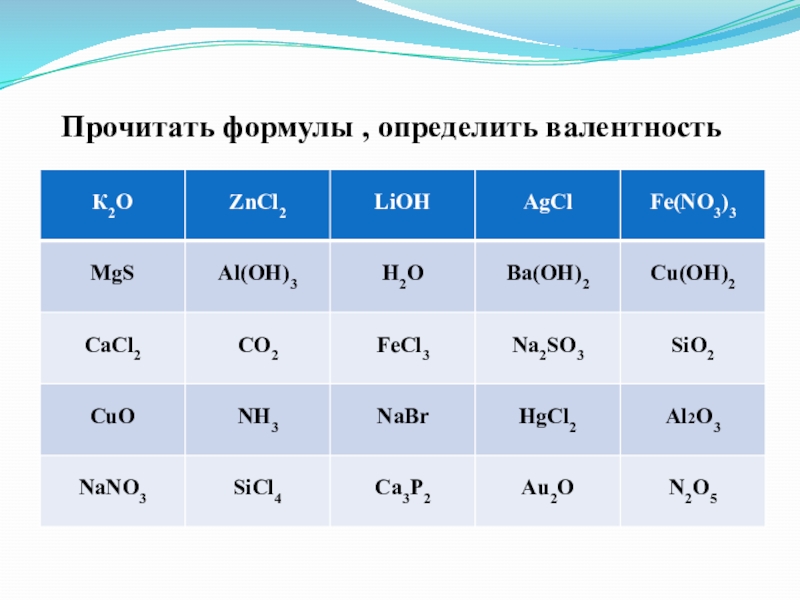
- 4. Прочитать формулы , определить валентность
- 5. Химическая реакция1. Что такое химическая реакция?Химическая реакция
- 6. Слайд 6
- 7. М.В. ЛомоносовОн прокаливал металлы в запаянном сосуде
- 8. Слайд 8
- 9. «Все перемены, в натуре случающиеся, такого суть
- 10. Антуан Лавуазье Европейская наука открыла закон сохранения массы
- 11. Слайд 11
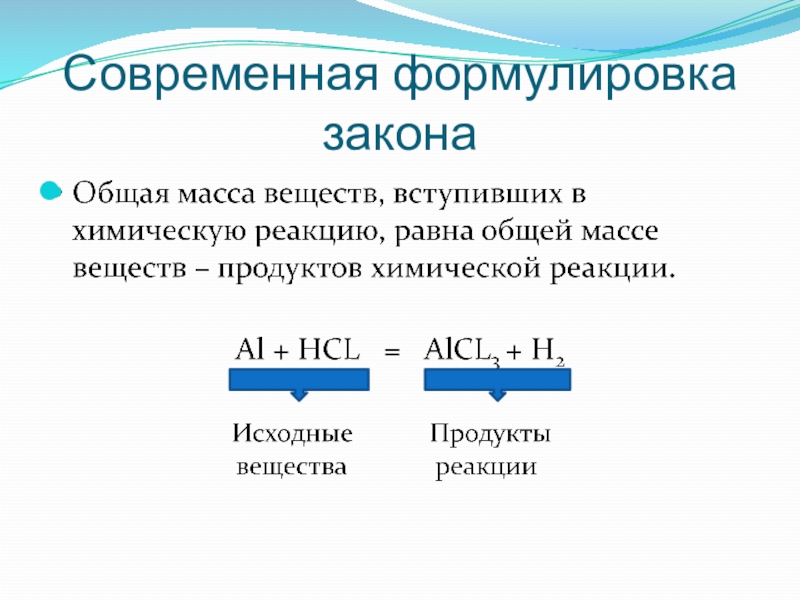
- 12. Современная формулировка закона
- 13. Сумма масс атомов химических элементов исходных веществ
- 14. Расставьте коэффициенты в уравнениях, докажите закон сохранения
- 15. В реакции Ca + Cl2→ CaCl2 коэффициенты
- 16. Связь между массой и энергией Альберта Эйнштейна.
- 17. Слайд 17
- 18. Переход одних видов энергии в другие.
- 19. Слайд 19
- 20. Слайд 20
- 21. Химическая энергия Электрическая энергияЭлектрохимическими
- 22. Слайд 22
- 23. Домашнее задание
- 24. Слайд 24
Валентность1. Что такое валентность?Валентность – свойство атомов присоединять определенное число других атомов.2. Как определить валентность металлов I,II,III группы по их положению в периодической системе?Металлы главных подгрупп проявляют постоянную валентность, равную номеру группы.
Слайд 2Валентность
1. Что такое валентность?
Валентность – свойство атомов присоединять определенное число других
атомов.
2. Как определить валентность металлов I,II,III группы по их положению в периодической системе?
Металлы главных подгрупп проявляют постоянную валентность, равную номеру группы.
2. Как определить валентность металлов I,II,III группы по их положению в периодической системе?
Металлы главных подгрупп проявляют постоянную валентность, равную номеру группы.
Слайд 33. Как определить валентность неметаллов по их положению в периодической системе?
Элементы
имеющие постоянную валентность: H,O,F.
Высшая валентность соответствует номеру группы.
Низшая валентность определяется: из числа 8 вычитается номер группы.
Переменная валентность определяется по формуле бинарного соединения, если известна валентность другого химического элемента.
Высшая валентность соответствует номеру группы.
Низшая валентность определяется: из числа 8 вычитается номер группы.
Переменная валентность определяется по формуле бинарного соединения, если известна валентность другого химического элемента.
Слайд 5Химическая реакция
1. Что такое химическая реакция?
Химическая реакция – это превращение одних
веществ в другие.
Гниение листьев;
Ржавление железа;
Высыхание краски;
Скисание молока;
Появление радуги;
Увеличение массы тела человека.
Гниение листьев;
Ржавление железа;
Высыхание краски;
Скисание молока;
Появление радуги;
Увеличение массы тела человека.
Слайд 7М.В. Ломоносов
Он прокаливал металлы в запаянном сосуде – реторте и обнаружил
, что вес веществ до и после реакции остался неизменным
Слайд 9«Все перемены, в натуре случающиеся, такого суть состояния, что, сколько у
одного тела отнимается, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте»
Этот закон был сформулирован в 1748 году, а самые точные эксперименты с реакцией обжига металлов в запаянных сосудах были проведены в 1756 году.
Этот закон был сформулирован в 1748 году, а самые точные эксперименты с реакцией обжига металлов в запаянных сосудах были проведены в 1756 году.
Слайд 10Антуан Лавуазье
Европейская наука открыла закон сохранения массы после публикации описания работ
великого французского химика Антуана Лавуазье.
В 1789 году независимо от русского ученого он самостоятельно открывает данный закон.
А. Лавуазье расширил распространение закона сохранения на массу каждого из элементов, которые принимали участие в реакции в составе сложных веществ.
В 1789 году независимо от русского ученого он самостоятельно открывает данный закон.
А. Лавуазье расширил распространение закона сохранения на массу каждого из элементов, которые принимали участие в реакции в составе сложных веществ.
Слайд 13 Сумма масс атомов химических элементов исходных веществ должна равняться сумме масс
атомов продуктов реакции:
1.Находим по таблице Д.И. Менделеева атомные массы элементов.
Ar(Al) =
Ar(H) =
Ar(Cl) =
2. Находим суммы масс атомов и молекул исходных веществ и продуктов реакции.
3. К какому выводу мы пришли?
1.Находим по таблице Д.И. Менделеева атомные массы элементов.
Ar(Al) =
Ar(H) =
Ar(Cl) =
2. Находим суммы масс атомов и молекул исходных веществ и продуктов реакции.
3. К какому выводу мы пришли?
Сумма масс атомов химических элементов исходных веществ должна равняться сумме масс атомов продуктов реакции:
Слайд 14Расставьте коэффициенты в уравнениях, докажите закон сохранения массы веществ
P +
Cl2 →PCl5 Na + S → Na2S
HCl + Mg →MgCl2 + H2 N2 + H2 →NH3
H2O+ Na → H2 + NaOH NO + O2 —> NO2 C6H6 + Cl2 —> C6H6Cl6 SO2 + O2 —> SO3
KNO3 = KNO2 + O2 NH3 +O2 = N2 + H2O
C6H6 + Cl2 = C6H5Cl + HCl Р + О2 = Р2О5
N2 + O2 —> NO NH3 + O2 = NO + H2O
PCl3 + Cl2 = PCl5
HCl + Mg →MgCl2 + H2 N2 + H2 →NH3
H2O+ Na → H2 + NaOH NO + O2 —> NO2 C6H6 + Cl2 —> C6H6Cl6 SO2 + O2 —> SO3
KNO3 = KNO2 + O2 NH3 +O2 = N2 + H2O
C6H6 + Cl2 = C6H5Cl + HCl Р + О2 = Р2О5
N2 + O2 —> NO NH3 + O2 = NO + H2O
PCl3 + Cl2 = PCl5
Слайд 15В реакции Ca + Cl2→ CaCl2 коэффициенты не нужны.
В реакции
Zn + HCl → ZnCl2 + H2 коэффициент у цинка 2.
В реакции Ca + O2 → CaO коэффициент у оксида кальция 2.
В реакции CH4 → C + H2 коэффициенты не нужны.
В реакции CuO + H2 → Cu + H2O коэффициент у меди 2.
В реакции Ca + O2 → CaO коэффициент у оксида кальция 2.
В реакции CH4 → C + H2 коэффициенты не нужны.
В реакции CuO + H2 → Cu + H2O коэффициент у меди 2.
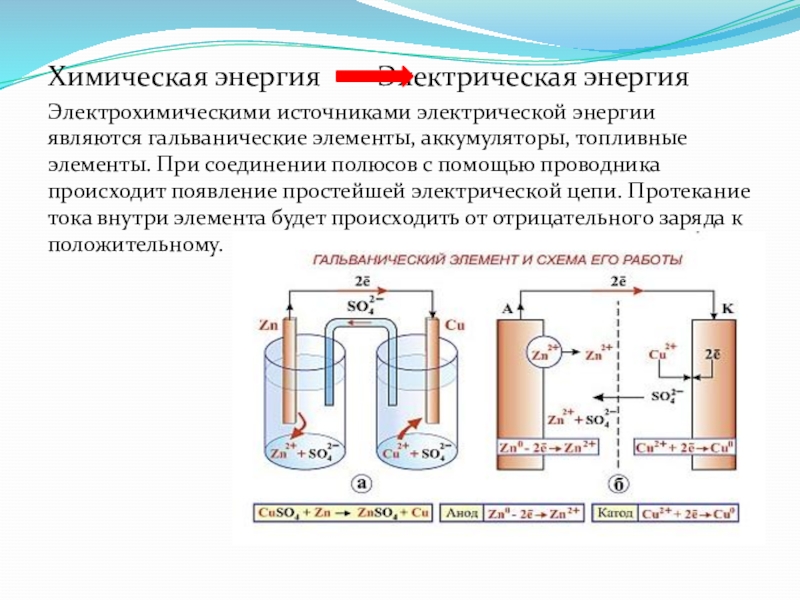
Слайд 21Химическая энергия Электрическая энергия
Электрохимическими источниками электрической энергии являются
гальванические элементы, аккумуляторы, топливные элементы. При соединении полюсов с помощью проводника происходит появление простейшей электрической цепи. Протекание тока внутри элемента будет происходить от отрицательного заряда к положительному.