«Механизмы реакций в органической химии»,
10 класс
Автор: Ким Наталья Викторовна
учитель химии
МОУСОШ №6 г. Нягани
ХМАО-Югры, 2008 год.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Виды частиц в органической химии. Типы реакций (10 профильный класс).
Содержание
- 1. Презентация Виды частиц в органической химии. Типы реакций (10 профильный класс).
- 2. Классификация реакций по механизму разрыва
- 3. Если при разрыве связи общая электронная пара
- 4. Слайд 4
- 5. Гомолитический разрыв более характерен для неполярных и слабополярных связей, а гетеролитический - для полярных.
- 6. Органические ионы и радикалыОрганические катионы, анионы и
- 7. Органические ионы и радикалыОт устойчивости промежуточных частиц
- 8. Слайд 8
- 9. Радикальные реакции Реакции, в которых
- 10. Радикальные реакции Реакции с участием свободных радикалов
- 11. Ионные реакцииРеакции, в которых происходит гетеролитический разрыв
- 12. Общая схема реакции: (CH3)3C-Cl + H2O → (CH3)3C-OH + HCl Стадии процесса:
- 13. Органические катионы и анионы - неустойчивые промежуточные
- 14. Электрофильные реакции Электрофильной называется реакция, в которой
- 15. Электрофильное присоединение: CH2=CH2 + HCl → CH3CH2Cl (электрофил
- 16. Электрофильное замещение: C6H6 + NO2+ →
- 17. Нуклеофильные реакции Нуклеофильной называется реакция, в которой
- 18. Строение некоторых нуклеофильных реагентов
- 19. Нуклеофильные реакцииБлагодаря подвижности π-электронов, нуклеофильными свойствами обладают
- 20. Примеры нуклеофильных реакцийНуклеофильное замещение: Механизм нуклеофильного
- 21. Использованная литература и Интернет-ресурс1. Габриелян О.С., Остроумов
Классификация реакций по механизму разрыва связей В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего
Слайд 2
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной
связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
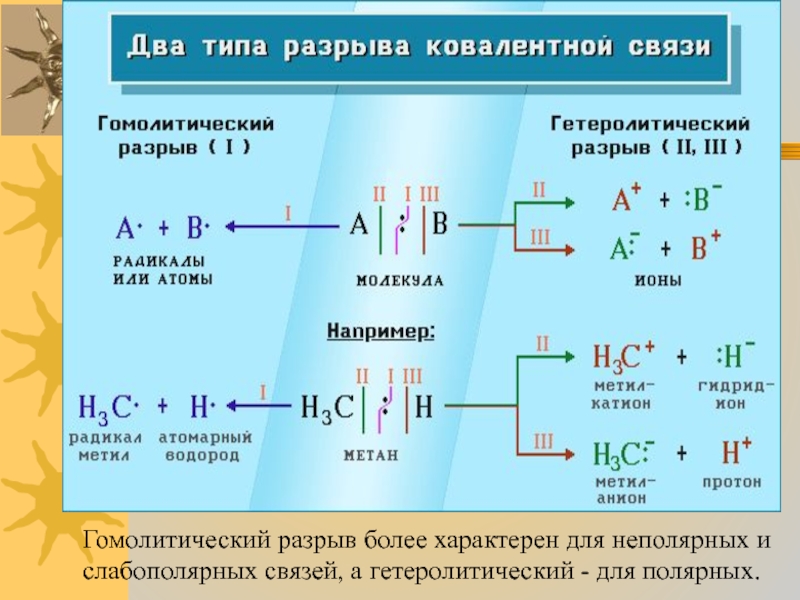
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
образуются свободные радикалы.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
образуются свободные радикалы.
Слайд 3Если при разрыве связи общая электронная пара остается у одного атома,
то такой разрыв называется гетеролитическим:
В результате образуются разноименно заряженные ионы - катион и анион.
Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
В результате образуются разноименно заряженные ионы - катион и анион.
Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
Слайд 5Гомолитический разрыв более характерен для неполярных и слабополярных связей, а гетеролитический
- для полярных.
Слайд 6Органические ионы и радикалы
Органические катионы, анионы и свободные радикалы являются неустойчивыми
промежуточными частицами. Они возникают при разрыве ковалентных связей на некоторых стадиях в сложных реакциях и сразу же вступают в дальнейшие превращения.
Относительная устойчивость и, следовательно, вероятность образования той или иной частицы определяются возможностью рассредоточения (делокализации) заряда в ионе или неспаренного электрона в радикале.
Относительная устойчивость и, следовательно, вероятность образования той или иной частицы определяются возможностью рассредоточения (делокализации) заряда в ионе или неспаренного электрона в радикале.
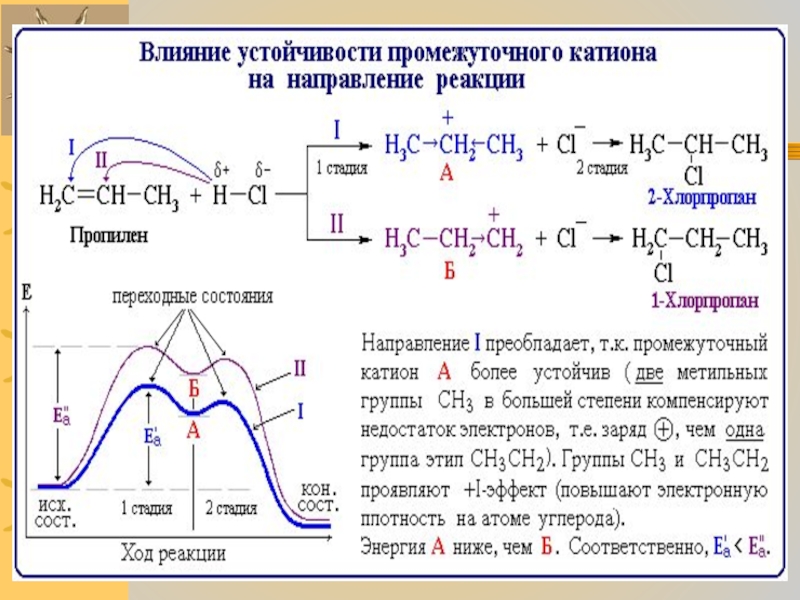
Слайд 7Органические ионы и радикалы
От устойчивости промежуточных частиц зависит направление реакции. Чем
ниже энергия промежуточной частицы (т.е. больше устойчивость), тем меньше энергия активации ее образования. Это в значительной степени определяет направление реакции в соответствии с правилом:
реакция идет через образование наиболее устойчивых промежуточных частиц.
реакция идет через образование наиболее устойчивых промежуточных частиц.
Слайд 9
Радикальные реакции
Реакции, в которых происходит гомолитический разрыв связей и образуются свободно-радикальные
промежуточные частицы, называются радикальными реакциями.
Пример - реакция радикального замещения при хлорировании метана: Общая схема реакции: CH4 + Cl2 → CH3Cl + HCl Стадии процесса: Cl2 → 2 Cl· (на свету) Cl· + H–CH3 → HCl + ·CH3 ·CH3 + Cl2 → CH3Cl + Cl· и так далее.
Пример - реакция радикального замещения при хлорировании метана: Общая схема реакции: CH4 + Cl2 → CH3Cl + HCl Стадии процесса: Cl2 → 2 Cl· (на свету) Cl· + H–CH3 → HCl + ·CH3 ·CH3 + Cl2 → CH3Cl + Cl· и так далее.
Слайд 10Радикальные реакции
Реакции с участием свободных радикалов характерны для соединений с неполярными
и слабополярными связями.
Такие связи (например, C–C, C–H, Cl–Cl, O–O и т.п.) склонны к гомолитическому разрыву.
Условия проведения радикальных реакций:
повышенная температура (часто реакцию проводят в газовой фазе),
действие света или радиоактивного излучения,
присутствие соединений - источников свободных радикалов (инициаторов),
неполярные растворители.
Условия проведения радикальных реакций:
повышенная температура (часто реакцию проводят в газовой фазе),
действие света или радиоактивного излучения,
присутствие соединений - источников свободных радикалов (инициаторов),
неполярные растворители.
Слайд 11Ионные реакции
Реакции, в которых происходит гетеролитический разрыв связей и образуются промежуточные
частицы ионного типа, называются ионными реакциями.
Такие реакции характерны для соединений с полярными связями (C-O, C-N, C-Cl) и связями с высокой поляризуемостью (C=C, C=C-C=C, C=O и т.п.), благодаря их склонности к гетеролитическому разрыву.
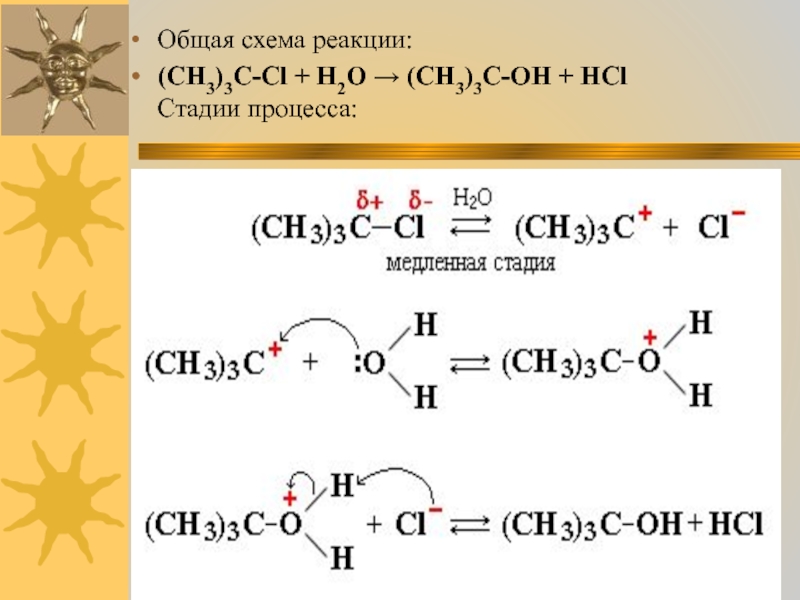
Пример ионной реакции - гидролиз 2-метил-2-хлорпропана (триметилхлорметана, трет-бутилхлорида)
Такие реакции характерны для соединений с полярными связями (C-O, C-N, C-Cl) и связями с высокой поляризуемостью (C=C, C=C-C=C, C=O и т.п.), благодаря их склонности к гетеролитическому разрыву.
Пример ионной реакции - гидролиз 2-метил-2-хлорпропана (триметилхлорметана, трет-бутилхлорида)
Слайд 13Органические катионы и анионы - неустойчивые промежуточные частицы.
В отличие от
неорганических ионов, постоянно присутствующих в водных растворах и расплавах, они возникают только в момент реакции и сразу же вступают в дальнейшие превращения.
Условия ионных реакций: невысокая температура;
полярные растворители, способные к сольватации образующихся ионов.
Действие света или радиоактивного излучения не влияет на скорость ионных реакций.
По характеру реагента, действующего на молекулу, ионные реакции делятся на электрофильные и нуклеофильные.
полярные растворители, способные к сольватации образующихся ионов.
Действие света или радиоактивного излучения не влияет на скорость ионных реакций.
По характеру реагента, действующего на молекулу, ионные реакции делятся на электрофильные и нуклеофильные.
Слайд 14Электрофильные реакции
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию
электрофильного реагента.
Электрофильные ("любящие электроны") реагенты или электрофилы - это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне. Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы, NO2+, ZnCl2, AlCl3.
Незаполненность внешнего электронного уровня в электрофиле показана на примере AlCl3.
Электрофильные ("любящие электроны") реагенты или электрофилы - это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне. Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы, NO2+, ZnCl2, AlCl3.
Незаполненность внешнего электронного уровня в электрофиле показана на примере AlCl3.
Слайд 15Электрофильное присоединение:
CH2=CH2 + HCl → CH3CH2Cl
(электрофил - H+ в составе
HCl)
Стадии:
I. CH2=CH2 + Hδ+-Clδ- → CH3CH2+ + Cl- (медленная)
II. CH3CH2+ + Cl- →CH3CH2Cl
(быстрая)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
(быстрая)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Слайд 16Электрофильное замещение:
C6H6 + NO2+ → C6H5NO2 + H+
(электрофил - NO2+)
Катион
NO2+ образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма - SE (S – substitution [замещение]).
Обозначение механизма - SE (S – substitution [замещение]).
Слайд 17Нуклеофильные реакции
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию
нуклеофильного реагента.
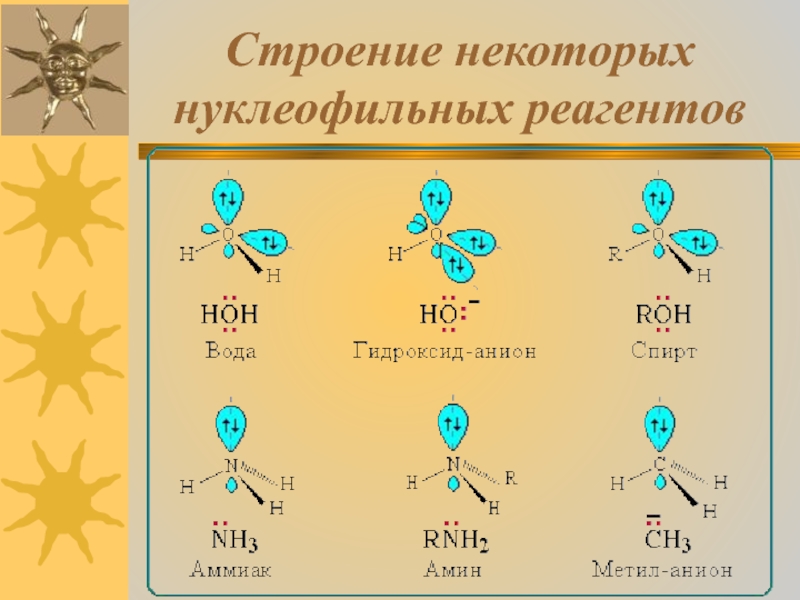
Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне.
Примеры нуклеофильных частиц:
OH-, Cl-, Br-, CN-, H2O, CH3OH, NH3.
Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне.
Примеры нуклеофильных частиц:
OH-, Cl-, Br-, CN-, H2O, CH3OH, NH3.
Слайд 19Нуклеофильные реакции
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
CH2=CH2, CH2=CH–CH=CH2, C6H6 и т.п.(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
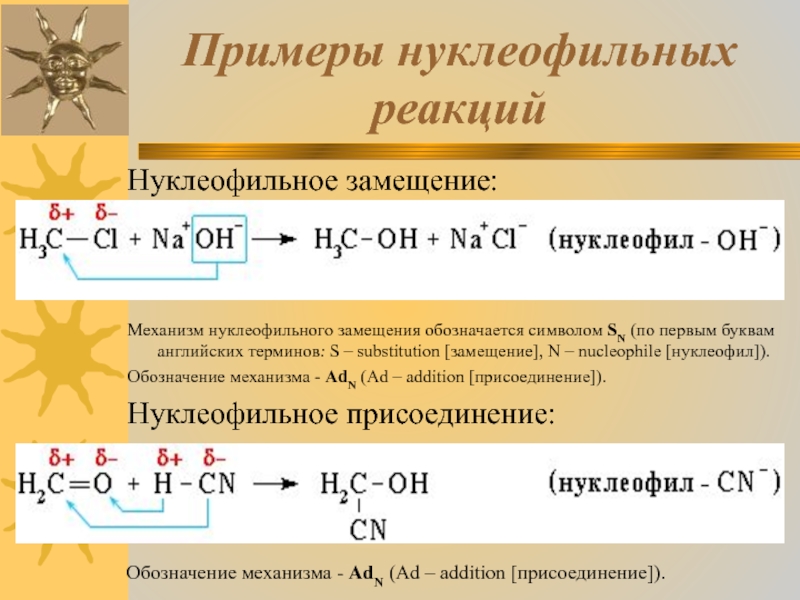
Слайд 20Примеры нуклеофильных реакций
Нуклеофильное замещение:
Механизм нуклеофильного замещения обозначается символом SN (по
первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма - AdN (Ad – addition [присоединение]).
Нуклеофильное присоединение:
Обозначение механизма - AdN (Ad – addition [присоединение]).
Нуклеофильное присоединение:
Обозначение механизма - AdN (Ad – addition [присоединение]).
Слайд 21Использованная литература и Интернет-ресурс
1. Габриелян О.С., Остроумов И.Г., Карцова А.А. Органическая
химия. – Москва. Просвещение. 2004.
2. Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия.- Москва. Дрофа. 2004.
3. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
4. Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
5. Книга для чтения по органической химии (Сост. П.Ф.Буцкус). – Москва. Просвещение. 1985.
6. Методические указания по органической химии для слушателей вечерней химической школы. (МХТИ им. Д.И.Менделеева). – Москва. 1990.
http://www.chemistry.ssu.samara.ru/chem5/index5.htm
2. Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия.- Москва. Дрофа. 2004.
3. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
4. Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
5. Книга для чтения по органической химии (Сост. П.Ф.Буцкус). – Москва. Просвещение. 1985.
6. Методические указания по органической химии для слушателей вечерней химической школы. (МХТИ им. Д.И.Менделеева). – Москва. 1990.
http://www.chemistry.ssu.samara.ru/chem5/index5.htm