Семейство углерода
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока Подгруппа углерода
Содержание
- 1. Презентация урока Подгруппа углерода
- 2. «Строение атома углерода» Ядро атома этого элемента
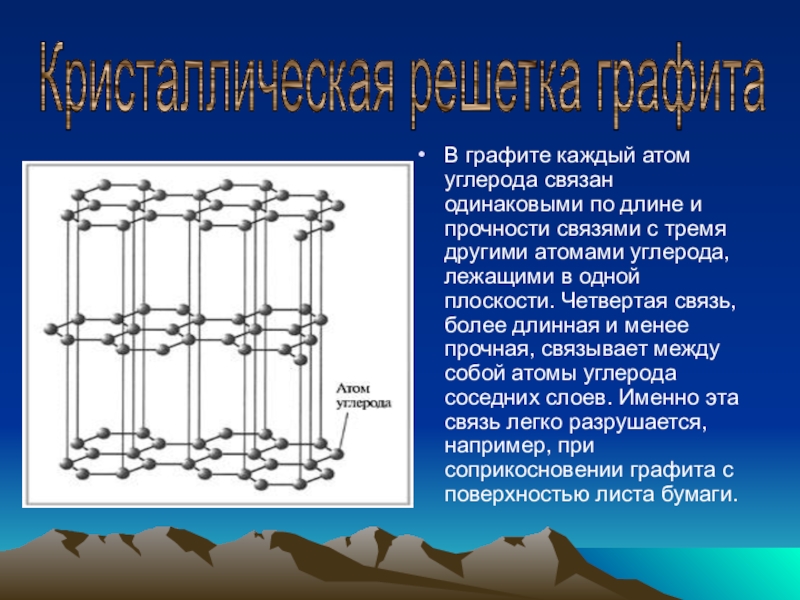
- 3. В графите каждый атом углерода связан одинаковыми
- 4. Рисунки, выполненные: а – углем, б – тушью, в – графитом
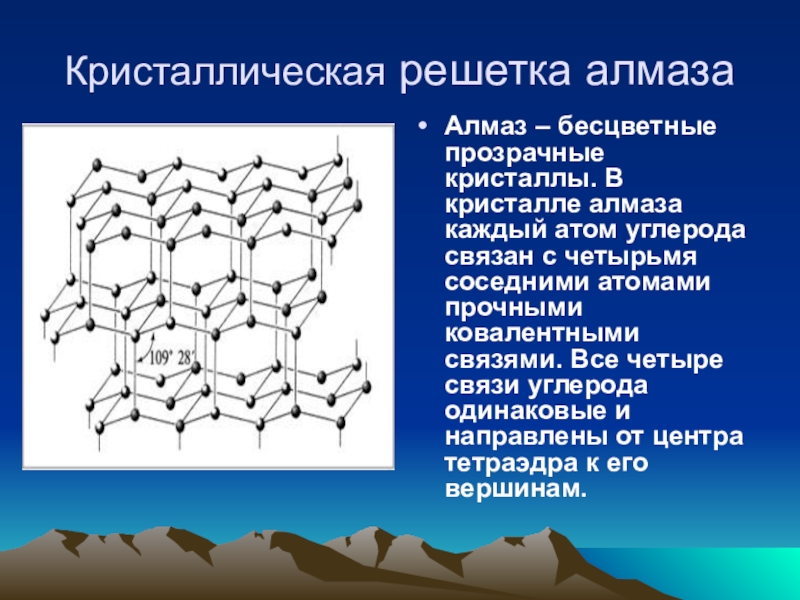
- 5. Кристаллическая решетка алмазаАлмаз – бесцветные прозрачные кристаллы.
- 6. Бриллиантовые украшения – бант, колье и серьги с красными шпинелями
- 7. Алмаз «Орлов», Алмазный фонд
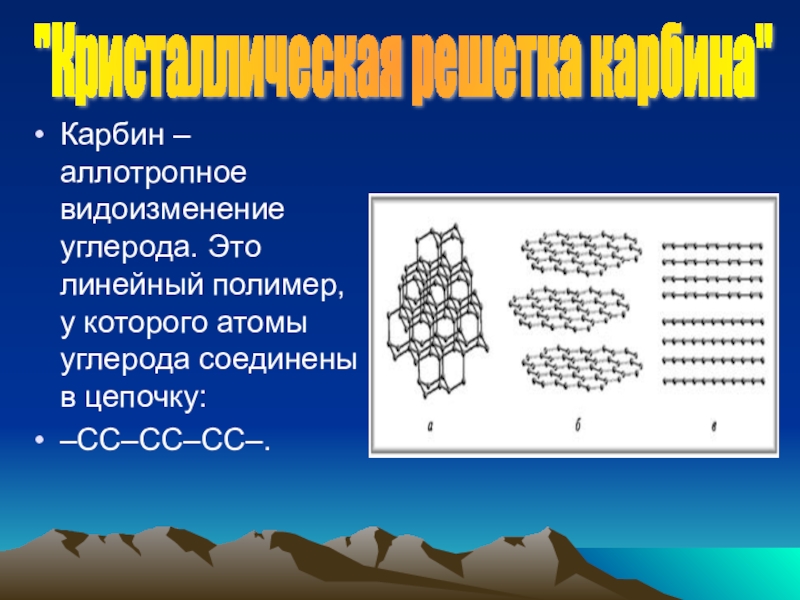
- 8. Карбин – аллотропное видоизменение углерода. Это линейный
- 9. Кристаллическая решетка «футболена» (С60) Была получена четвертая
- 10. Вопросы покупателям: • Какое аллотропное видоизменение углерода
- 11. Применение аллотропных модификаций углерода № Название
- 12. Углерод является неметаллом, взаимодействует с кислородом, водородом,
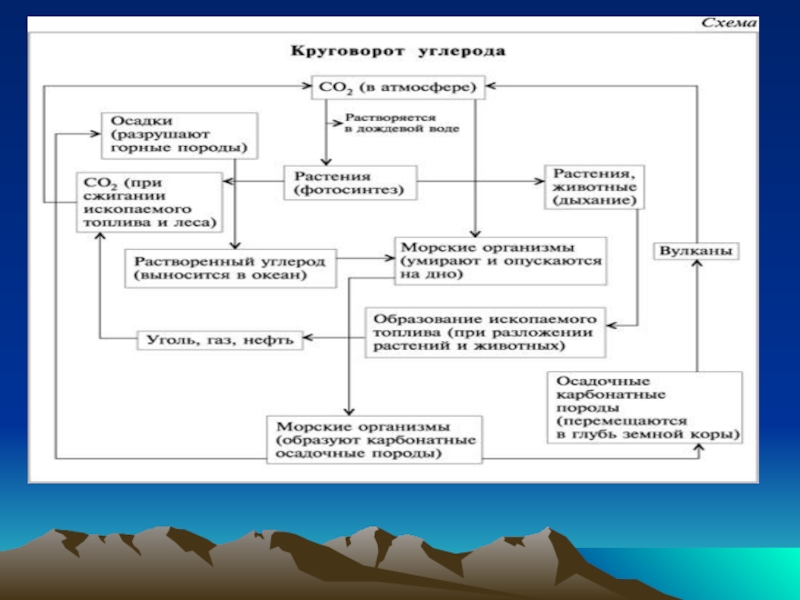
- 13. Слайд 13
- 14. ЗАДАЧА. Вычислить, сколько сгорело угля, если при
- 15. На земле живут три брата Из семейства
- 16. «Книга отзывов аукциона». «Что дал вам урок?»
- 17. Домашнее задание: Выполнить задания №1- 5
Слайд 1
Эпиграф урока.
«Широко простирает химия руки свои в дела человеческие» (М.В.Ломоносов).
Урок
Слайд 2«Строение атома углерода»
Ядро атома этого элемента состоит из 12 нуклонов
На втором энергетическом уровне находятся четыре электрона.
6С* 1s2 | 2s2 2p2
степень окисления (+2)
6C* 1s1 | 2s1 2p3
в возбужденном состоянии степень окисления (+4)
Слайд 3
В графите каждый атом углерода связан одинаковыми по длине и прочности
Кристаллическая решетка графита
Слайд 5Кристаллическая решетка алмаза
Алмаз – бесцветные прозрачные кристаллы. В кристалле алмаза каждый
Слайд 8
Карбин – аллотропное видоизменение углерода. Это линейный полимер, у которого атомы
–СС–СС–СС–.
"Кристаллическая решетка карбина"
Слайд 9Кристаллическая решетка
«футболена» (С60)
Была получена четвертая модификация углерода – молекулярный углерод
Слайд 10Вопросы покупателям:
• Какое аллотропное видоизменение углерода вы, как представитель компании, выберете?
•
• Какое применение найдет в компании выбранное вами вещество?
Слайд 11Применение аллотропных модификаций углерода
№ Название компании
1 ГРЭС
2 ПаАЗ
3 Ферросплавный
завод
4 Экибастузуголь
5 Фармацевтический
комбинат
6 Нефтеперерабатывающий
завод
7 Ювелирпром
8 Карандашная фабрика
Слайд 12
Углерод является неметаллом, взаимодействует с кислородом, водородом, оксидами металлов, проявляя как
C + O2 = CO2,
C + 2H2 = CH4,
C + СO2 = 2CO,
C + 2CuO = CO2 + 2Cu,
2C + Ca = CaC2.
Химические свойства углерода
Слайд 14ЗАДАЧА. Вычислить, сколько сгорело угля, если при этом выделилось 33 250
Дано:
Q = 33 250 кДж.
Найти:
m(C) = ?
Решение
Примем массу угля за х, составим и решим пропорцию:
х г 33 250 (кДж)
12 (г) 402 (кДж)
992,5 г.
Ответ. Сгорело 992,5 г угля.
Слайд 15
На земле живут три брата
Из семейства Карбонатов.
Старший брат – красавец Мрамор
СаСО
3
"О братьях карбонатах"
Слайд 16«Книга отзывов аукциона».
«Что дал вам урок?»
Характеристика Изучаемый объект
Строение Атома углерода ………….. ………….. …………..
Графита ………….. …………. …………..
Алмаза ………….. ………….. …………..
Карбина ………….. ………….. …………..
Фуллерена ………….. ………….. …………..
Свойства Графита ………….. ………….. …………..
Алмаза ………….. ………….. …………..
Карбина ………….. ………….. …………..
Фуллерена ………….. ………….. …………..
Применение Графита ………….. ………….. …………..
Алмаза ………….. ………….. …………..
Карбина ………….. ………….. …………..
Фуллерена ………….. ………….. …………..