2018
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Глюкоза
Содержание
- 1. Презентация по химии на тему Глюкоза
- 2. Глюкоза представляет собой моносахарид со смешанными функциями.
- 3. Строение глюкозыПринадлежность моносахарида к тому или иному
- 4. Если гидроксильная группа расположена справа от цепи,
- 5. Глюкоза может существовать также в циклической форме,
- 6. Циклические α- и β-формы глюкозы представляют собой
- 7. Явление существования веществ в нескольких взаимопревращающихся изомерных
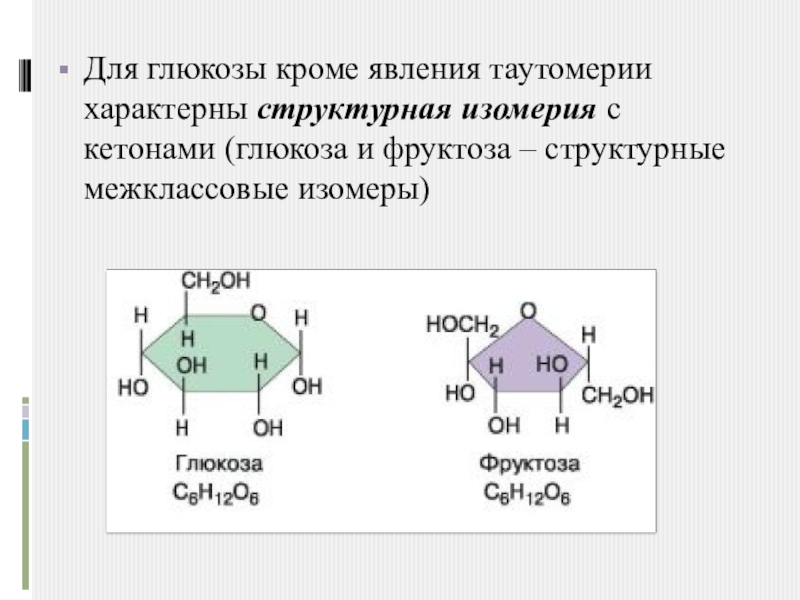
- 8. Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры)
- 9. Физические свойства Глюкоза – бесцветное кристаллическое вещество,
- 10. Химические свойства глюкозыI. Реакции на альдегидную группуРеакция
- 11. Окисление глюкозы гидроксидом меди (II) протекает при нагревании:
- 12. Восстановление глюкозы идет до шестиатомного спирта - сорбита:
- 13. Реакции глюкозы на гидроксильные группы.Глюкоза дает качественную
- 14. Образование простых эфиров со спиртамиПри действии метилового
- 15. Специфические свойстваВажнейшим свойством моносахаридов является их ферментативное брожение,
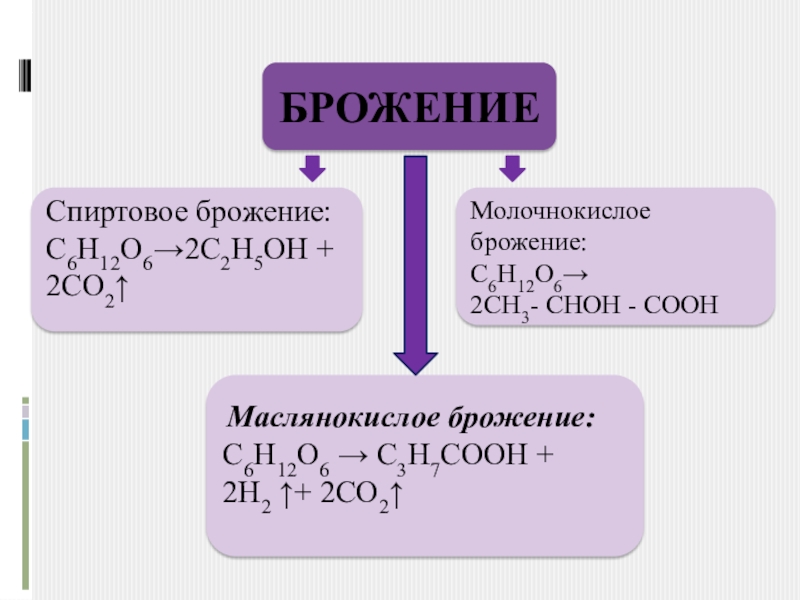
- 16. БРОЖЕНИЕСпиртовое брожение:C6H12O6→2C2H5OH + 2CO2↑ Молочнокислое брожение:C6H12O6→ 2CH3- СНOH - СООН Маслянокислое брожение: C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
- 17. Получение глюкозыВ промышленности – гидролиз крахмала
- 18. Применение глюкозыв кондитерском деле (изготовление мармелада, карамели,
- 19. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Габриелян, О.С. Химия. 10
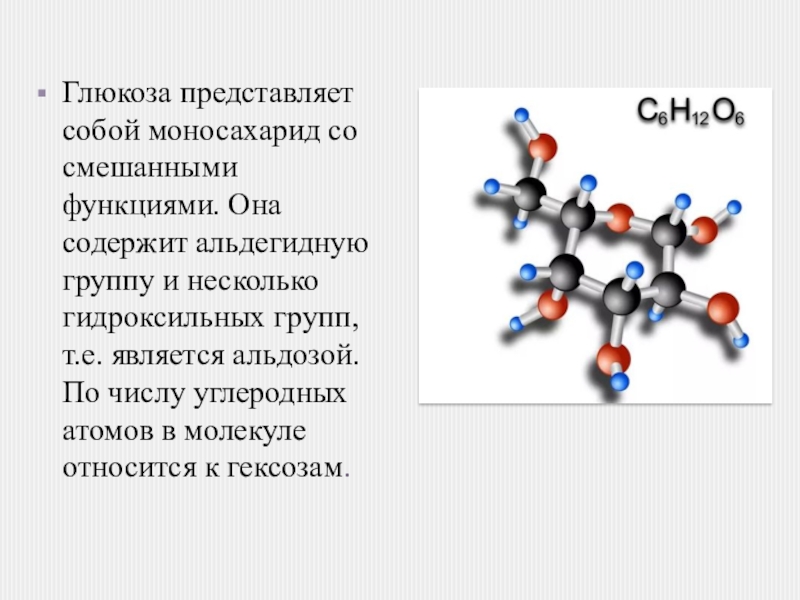
Глюкоза представляет собой моносахарид со смешанными функциями. Она содержит альдегидную группу и несколько гидроксильных групп, т.е. является альдозой. По числу углеродных атомов в молекуле относится к гексозам.
Слайд 1ОГАПОУ «Белгородский техникум промышленности и сферы услуг»
Лопанова Е.В.
Преподаватель химии
г. Белгород
Слайд 2Глюкоза представляет собой моносахарид со смешанными функциями. Она содержит альдегидную группу
и несколько гидроксильных групп, т.е. является альдозой. По числу углеродных атомов в молекуле относится к гексозам.
Слайд 3Строение глюкозы
Принадлежность моносахарида к тому или иному генетическому ряду определяется по
конфигурации его наиболее удаленного от альдегидной группы асимметрического углеродного атома.
Асимметрический атом углерода – это атом, связанный с четырьмя различными заместителями.
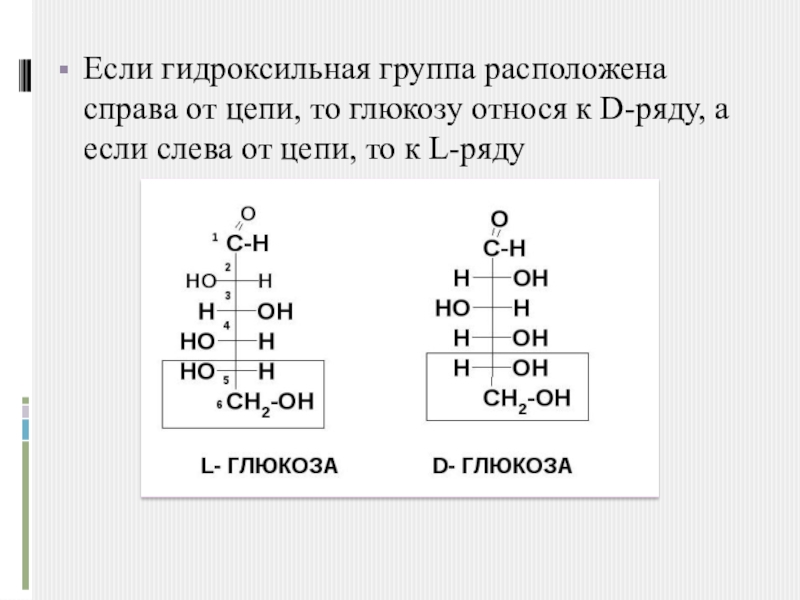
В зависимости от пространственного расположения атомов «Н» и ОН-групп у 5-го атома углерода различают D – глюкозу и L – глюкозу.
Асимметрический атом углерода – это атом, связанный с четырьмя различными заместителями.
В зависимости от пространственного расположения атомов «Н» и ОН-групп у 5-го атома углерода различают D – глюкозу и L – глюкозу.
Слайд 4Если гидроксильная группа расположена справа от цепи, то глюкозу относя к
D-ряду, а если слева от цепи, то к L-ряду
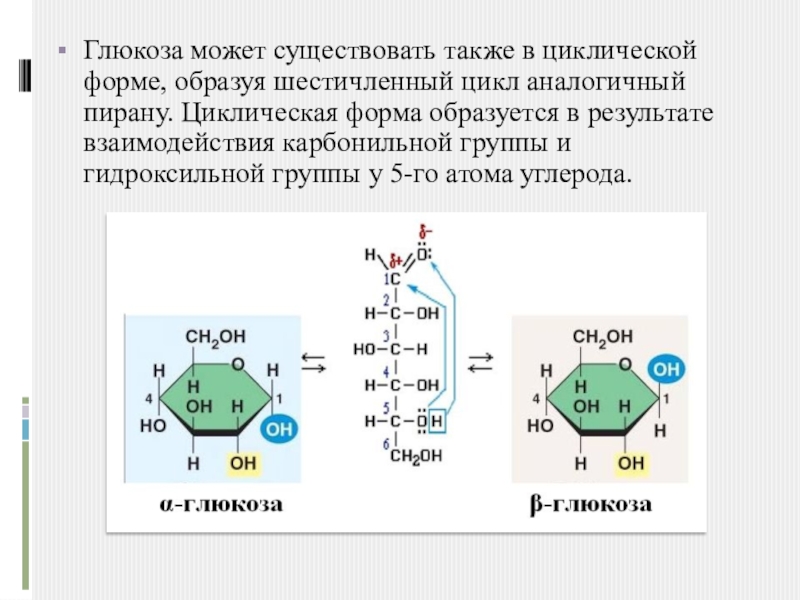
Слайд 5Глюкоза может существовать также в циклической форме, образуя шестичленный цикл аналогичный
пирану. Циклическая форма образуется в результате взаимодействия карбонильной группы и гидроксильной группы у 5-го атома углерода.
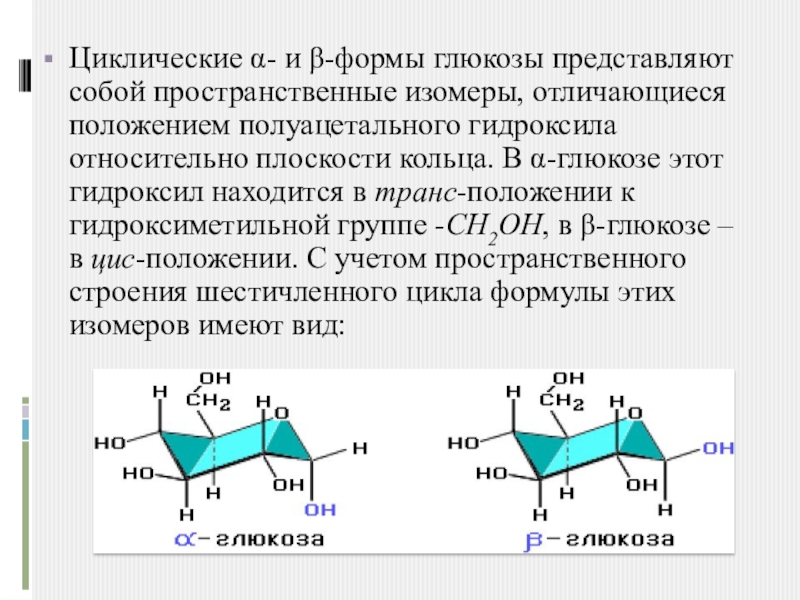
Слайд 6Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением
полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении. С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид:
Слайд 7Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А.
М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией (от греческого tauto – «тот же самый» и meros – «часть».
В твёрдом состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул). Доля альдегидной формы в равновесии незначительна.
В твёрдом состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул). Доля альдегидной формы в равновесии незначительна.
Слайд 8Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза
– структурные межклассовые изомеры)
Слайд 9Физические свойства
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде,
сладкое на вкус (лат. «глюкос» – сладкий).
Слайд 10Химические свойства глюкозы
I. Реакции на альдегидную группу
Реакция серебряного зеркала:
При окислении глюкозы
аммиачным раствором оксида серебра образуется глюконовая кислота
Слайд 13Реакции глюкозы на гидроксильные группы.
Глюкоза дает качественную реакцию многоатомных спиртов –
со свежеприготовленным гидроксидом меди (ΙΙ), образуя ярко-синий раствор глюконата меди (ΙΙ).
Слайд 14
Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного
хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
Слайд 15Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на
осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
Слайд 16БРОЖЕНИЕ
Спиртовое брожение:
C6H12O6→2C2H5OH + 2CO2↑
Молочнокислое брожение:
C6H12O6→
2CH3- СНOH - СООН
Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+
2CO2↑
Слайд 17Получение глюкозы
В промышленности – гидролиз крахмала
(C6H10O5)n + nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории - из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе - фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
Слайд 18Применение глюкозы
в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.),
в текстильной промышленности в качестве восстановителя,
в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.
В пищевой промышленности при квашении капусты, огурцов, при производстве пива.
Слайд 19СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Габриелян, О.С. Химия. 10 класс: учебник [Текст] / О.С.Габриелян.
– 2-е изд., стереотип. – М.: Дрофа, 2014. – 319,[1]с: и.
ISBN 978-5-358-13386-0
Яндекс. Картинки.
ISBN 978-5-358-13386-0
Яндекс. Картинки.












![Презентация по химии на тему Глюкоза СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Габриелян, О.С. Химия. 10 класс: учебник [Текст] / СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Габриелян, О.С. Химия. 10 класс: учебник [Текст] / О.С.Габриелян. – 2-е изд., стереотип. –](/img/thumbs/4d85314feedd44ea6469aadf2887b83e-800x.jpg)





