Разработали:
Ермачкова О.И., учитель биологии и химии
Петрова В.В., учитель биологии и географии, экологии
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к интегрированному уроку по химии и биологии Химические реакции на примере свойств воды
Содержание
- 1. Презентация к интегрированному уроку по химии и биологии Химические реакции на примере свойств воды
- 2. Цель урока: интегрировать знания учащихся о физических
- 3. Задачи урокаобобщить знания учащихся о физических свойствах
- 4. План урока 1.Распространение воды в природе. 2.
- 5. Петрянов И.В.,(российский физико-химик, академик АН СССР)«Разве вода
- 6. 1. Как называется водная оболочка земли?2. Сколько
- 7. Почти 3/4 поверхности нашей планеты заняты водой,
- 8. Вода является самым распространённым веществом на Земле.
- 9. Лавуазье Антуан Лоран (1743— 1794)Является одним из
- 10. Опыты по изучению состава воды проведены А.
- 11. Продолжая опыты по синтезу и разложению воды,
- 12. Дать характеристику воде по ее формуле, используя
- 13. Состав молекулы водыМr (H2O) = 18 г/моль.m(H):m(O)= 1:8.Массовая доля водорода – 11,11%.Массовая доля кислорода – 88,89%.
- 14. Ответьте на следующие вопросы:1. К какому классу
- 15. Строение молекулы воды
- 16. Физические свойства воды
- 17. Вода – вещество уникальное, обладающее аномальными свойствамиСогласно
- 18. Вода – одно из наиболее реакционноспособных веществ.
- 19. Реакция разложенияПри t= 2000°C или
- 20. Реакции замещенияПри этом образуются: в первом случае
- 21. Реакции соединенияВзаимодействует с оксидами металлов и неметаллов
- 22. Обращаем внимание на таблицу растворимости – в некоторых клетках стоят прочерки.Объясните, что это означает?
- 23. Реакции обменаГидролиз – обменное взаимодействие веществ с
- 24. Сформулируйте вывод о возможных химических свойствах воды.
- 25. Вода в живых организмахЖивых организмов, не содержащих
- 26. Химические реакции, протекающие в живых организмахФотосинтез -
- 27. Гликолиз в живых организмах
- 28. ВыводыВода – самое распространенное вещество на Земле.Вода
- 29. Домашнее задание: параграф 33, с.168-172, с.173 упр. 1, задача 2, подготовиться к решению теста по теме.
- 30. Оцените свою работу на каждом этапе урока и запишите результаты в таблицу
Слайд 1Муниципальное бюджетное общеобразовательное учреждение
основная общеобразовательная школа №2
www.ppt4school.ru
Интегрированный урок по теме
«
Слайд 2
Цель урока: интегрировать знания учащихся о физических и химических свойствах воды
Слайд 3Задачи урока
обобщить знания учащихся о физических свойствах воды на основе знаний
закрепить знания о типах химических реакций, признаках и условиях их течения на примерах реакций взаимодействия воды с различными веществами;
продолжить формирование знаний о распространении воды в природе и ее роли в жизни живых организмов на основе знаний из курсов биологии и географии.
Слайд 4План урока
1.Распространение воды в природе.
2. Состав воды
3. Строение
4. Физические свойства воды.
5. Химические свойства воды.
6. Домашнее задание.
Слайд 5Петрянов И.В.,
(российский физико-химик, академик АН СССР)
«Разве вода – это только жидкость,
Океан, покрывающий почти всю планету, всю нашу чудесную Землю, в которой миллион лет назад зародилась жизнь, – это вода»
Слайд 61. Как называется водная оболочка земли?
2. Сколько % составляют воды Мирового
3. Каковы запасы пресной воды на Земле?
Слайд 7Почти 3/4 поверхности нашей планеты заняты водой, из них 96% приходится
Запасы пресной воды составляют всего 0,02-0,03%.
Слайд 8Вода является самым распространённым веществом на Земле.
«Все земное вещество...ею проникнуто
Антуан де Сент-Экзюпери
Слайд 9Лавуазье Антуан Лоран (1743— 1794)
Является одним из основоположников современной химии.
Он
Слайд 10Опыты по изучению состава воды проведены А. Лавуазье 24 июня 1783
А. Лавуазье и его коллега математик и физик П. Лаплас в присутствии группы французских ученых синтезировали воду. При этом масса образовавшейся воды была равна массе водорода и кислорода, участвующих в реакции.
Лаборатория А. Лавуазье
Слайд 11
Продолжая опыты по синтезу и разложению воды, А. Лавуазье и Ж.
Слайд 12Дать характеристику воде по ее формуле, используя алгоритм:
Конкретное вещество.
Качественный состав.
Тип вещества.
Количественный
Относительная молекулярная масса.
Соотношение масс атомов.
Массовые доли элементов в веществе.
Слайд 13Состав молекулы воды
Мr (H2O) = 18 г/моль.
m(H):m(O)= 1:8.
Массовая доля водорода –
Массовая доля кислорода – 88,89%.
Слайд 14Ответьте на следующие вопросы:
1. К какому классу неорганических веществ относится вода?
2.Каков тип химической связи?
3.Какую форму и почему имеет молекула воды?
Слайд 17Вода – вещество уникальное, обладающее аномальными свойствами
Согласно своей относительной молекулярной массе
Вода - единственное вещество, которое при затвердении расширяется. Поэтому плотность льда меньше плотности жидкой воды.
У воды самое высокое поверхностное натяжение из всех жидкостей, кроме ртути. Поверхность воды всегда затянута тончайшей пленкой
Эти аномалии воды можно объяснить тем, что молекулы воды способны соединяться друг с другом, образовывая водородные связи.
Слайд 18Вода – одно из наиболее реакционноспособных веществ.
1. Вспомните, по каким
2. Какие типы химических реакций известны вам по признаку состава и количества исходных веществ и продуктов реакции? (реакции соединения, разложения, замещения, обмена)
3. Какими бывают химические реакции по тепловому эффекту?
Слайд 19 Реакция разложения
При t= 2000°C или при пропускании постоянного электрического
2H2Oэл.ток → 2H2 ↑ + O2↑ (t= 2000◦ C) – эндотермическая р.
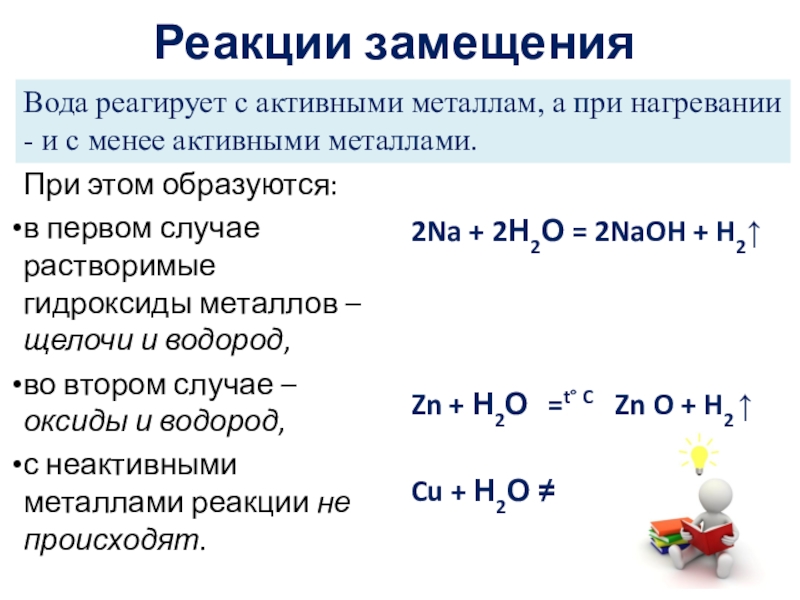
Слайд 20Реакции замещения
При этом образуются:
в первом случае растворимые гидроксиды металлов –
во втором случае – оксиды и водород,
с неактивными металлами реакции не происходят.
2Na + 2Н2О = 2NaOH + H2↑
Zn + Н2О =t° C Zn O + H2 ↑
Cu + Н2О ≠
Вода реагирует с активными металлам, а при нагревании - и с менее активными металлами.
Слайд 21Реакции соединения
Взаимодействует с оксидами металлов и неметаллов с образованием растворимых оснований
взаимодействие с оксидами металлов:
CaO + H2O = Ca(OH)2 + Q
взаимодействие с оксидами неметаллов:
P2O5 + 3H2O = 2H3PO4 ( при нагревании )
Слайд 22Обращаем внимание на таблицу растворимости – в некоторых клетках стоят прочерки.
Объясните,
Слайд 23Реакции обмена
Гидролиз – обменное взаимодействие веществ с водой, приводящее к их
гидролиз сульфида алюминия:
Al2S3 + 6HOH = 2Al(OH)3 ↓+ 3H2S↑
гидролиз карбида кальция:
CaC2 + 2HOH = C2H2↑ + Ca(OH)2↓+ Q
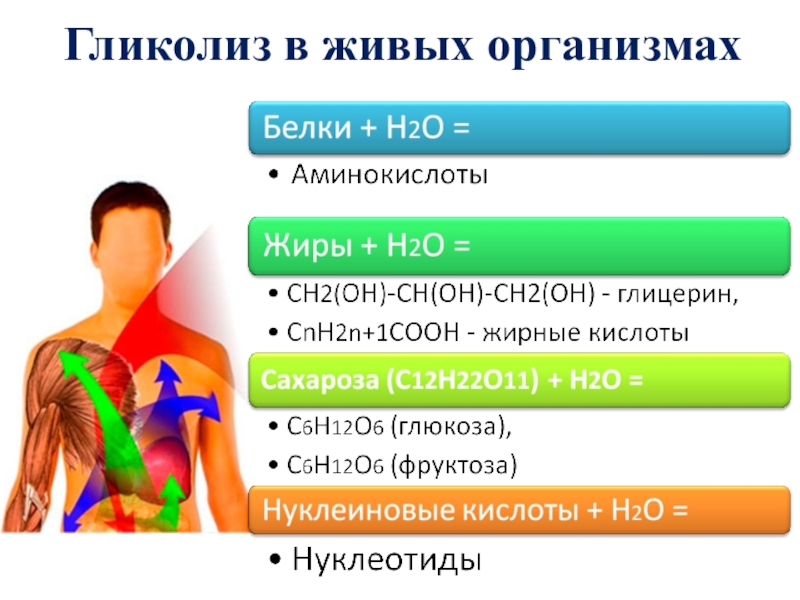
Слайд 25Вода в живых организмах
Живых организмов, не содержащих воду, на Земле не
Вода является основной частью клеток, тканей, растительных и животных соков.
Все биохимические процессы, газообмен в организме осуществляются при наличии воды.
Химический состав клетки
Слайд 26Химические реакции, протекающие в живых организмах
Фотосинтез -
процесс образования органического вещества
Фотолиз - одна из стадий фотосинтеза, разложение воды на свету в зеленых частях растений:
Н2О→Н+ + ОН-
6СО2 + 6Н2О ? С6Н12О6 + 6О2?
глюкоза
Слайд 28Выводы
Вода – самое распространенное вещество на Земле.
Вода – основа всего живого,
Физические свойства воды уникальны, обладают аномальными особенностями.
Вода является одним из самых химически активных, реакционноспособных веществ.
Вода совершает постоянный круговорот, но всё более значительным в нем становится роль человека.