- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 9 классе Углерод
Содержание
- 1. Презентация к уроку химии в 9 классе Углерод
- 2. «УГЛЕРОД»Цели урока:Повторить строение атома и аллотропию углерода.Рассмотреть
- 3. План урока:Строение атомаУглерод – простое веществоАлмазГрафитАморфный углерод Карбин ФуллеренХимические свойства углеродаКруговорот углерода в природеИтоговый тест
- 4. Строение атома2рУглерод – первый элемент главной подгруппы
- 5. Углерод – простое веществоУглерод образует аллотропные модификации:Алмаз Графит Также встречается в виде:«Аморфного» углеродаКарбина Фуллерена
- 6. Аллотропия – способность атомов одного химического элементаобразовывать несколько простых веществ.Эти простые вещества называютсяаллотропными модификациями.
- 7. АлмазИмеет объемную тетраэдрическую атомную решеткуФизические свойства:✵Прозрачное, бесцветное
- 8. Бриллианты.«Портретный» алмазАлмаз «Орлов»Алмаз «Шах»«Держава»Большая императорская коронаДрезденский Зеленый Бриллиант. 41 карат.Самый большой из известных зеленых бриллиантов.
- 9. ГрафитИмеет плоскостную атомнуюкристаллическую решеткуФизические свойства:✵Это темно-серое кристаллическое
- 10. «Аморфный» углеродИмеет сходное с графитом строение, является
- 11. Адсорбция Это способность к поглощению на поверхности
- 12. КарбинЭто порошок глубокого черного цветас вкраплениями более
- 13. ФуллеренЭто экзотическая модификация элементарного углерода, активно изучаемая в настоящее время.
- 14. Химические свойства СокислительвосстанавливаетсяС металлами:4Al + 3C =карбид
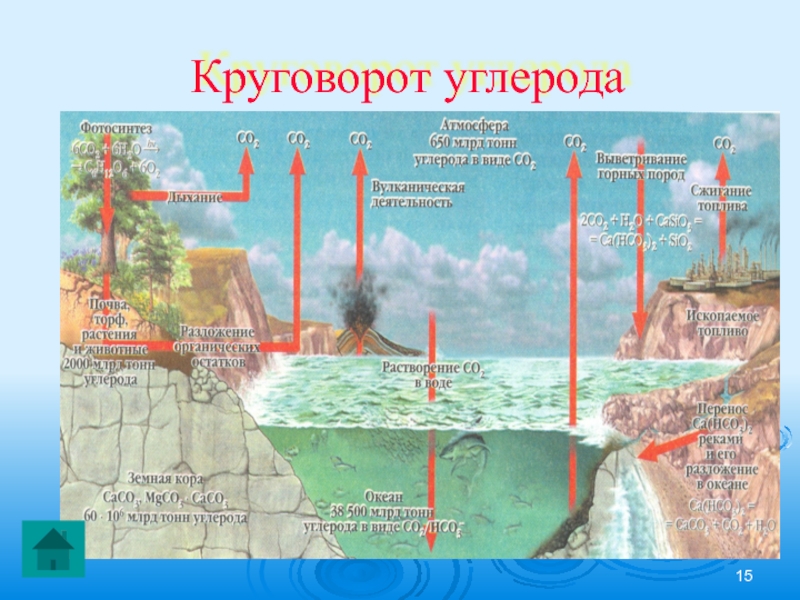
- 15. Круговорот углерода
- 16. Проверь себяЭлектронная формула внешнего энергетического уровня атома
- 17. Правильно!
- 18. Нет! Подумай ещё!
- 19. Домашнее задание§28, упр. 8 стр. 134.Ответить на
- 20. Урок окончен. Спасибо!
Слайд 2«УГЛЕРОД»
Цели урока:
Повторить строение атома и аллотропию углерода.
Рассмотреть строение, сравнение свойств и
Дать понятие об аморфном углероде, карбине и фуллерене.
Познакомить учащихся с явлением адсорбции.
Разобрать химические свойства углерода.
Рассмотреть круговорот углерода в природе.
Слайд 3План урока:
Строение атома
Углерод – простое вещество
Алмаз
Графит
Аморфный углерод
Карбин
Фуллерен
Химические свойства углерода
Круговорот
Итоговый тест
Слайд 4Строение атома
2р
Углерод – первый элемент главной подгруппы
IVгруппы Периодической системы.
Порядковый номер
электронов – 6, протонов – 6, нейтронов – 12 – 6 = 6.
6 электронов располагаются на двух энергетических уровнях.
2s
1s
6
Степень окисления:
+2
-4
Углерод в возбужденном состоянии:
+4
окислительные свойства
восстановительные свойства
1s² 2s
Рассмотрим распределение электронов по орбиталям.
²
²
2р
¹
³
Слайд 5Углерод – простое вещество
Углерод образует аллотропные модификации:
Алмаз
Графит
Также встречается в
«Аморфного»
углерода
Карбина
Фуллерена
Слайд 6Аллотропия – способность атомов
одного химического элемента
образовывать несколько простых веществ.
Эти простые
аллотропными модификациями.
Слайд 7Алмаз
Имеет объемную
тетраэдрическую
атомную решетку
Физические свойства:
✵Прозрачное, бесцветное вещество.
✵Самое твердое из всех
✵Это связано с особо прочной структурой
кристаллической решетки.
✵Обладает сильной лучепреломляемостью и
лучеотражаемостью.
✵Его плотность 3,5 г/см³.
✵Окраска алмазов обусловливается примесями.
✵Большие алмазы имеют названия и историю.
✵Огранённые алмазы – это бриллианты.
✵Масса алмазов измеряется в каратах
(1 карат = 0,2 грамма).
✵Алмаз – химически очень устойчивое вещество.
Слайд 8Бриллианты.
«Портретный» алмаз
Алмаз «Орлов»
Алмаз «Шах»
«Держава»
Большая императорская корона
Дрезденский Зеленый Бриллиант. 41 карат.
Самый большой
Слайд 9Графит
Имеет плоскостную атомную
кристаллическую решетку
Физические свойства:
✵Это темно-серое кристаллическое вещество.
✵ Жирное на ощупь.
✵Обладает
✵Мягкий – оставляет след на бумаге.
✵Это обусловлено слоистой структурой.
✵Непрозрачный.
✵Плотность 1,8 – 2,1 г/см³.
✵Хороший тепло- и электропроводник.
✵Тугоплавкий и жаропрочный.
✵Графит химически инертен.
Слайд 10«Аморфный» углерод
Имеет сходное с графитом строение,
является мелкокристаллическим графитом.
Сортами этого углерода
древесный уголь,
кокс
и сажа.
Получают
при разложении
метана
Получают
при нагревании
каменного угля без
доступа воздуха
Получают
при нагревании
древесины без
доступа воздуха
Древесный уголь обладает
способностью к адсорбции
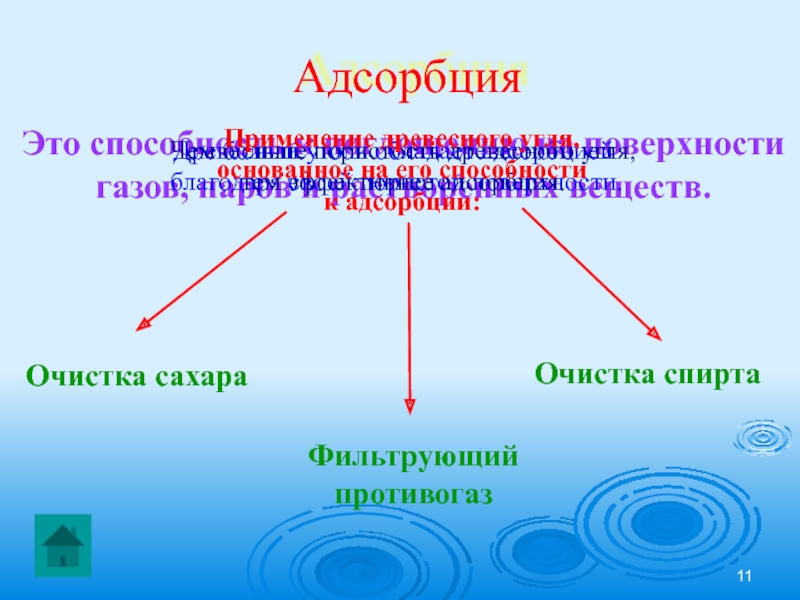
Слайд 11Адсорбция
Это способность к поглощению на поверхности
газов, паров и растворенных
Древесный уголь обладает адсорбцией
благодаря своей пористой поверхности.
Чем больше пористость древесного угля,
тем эффективнее адсорбция.
Применение древесного угля,
основанное на его способности
к адсорбции:
Очистка сахара
Очистка спирта
Фильтрующий
противогаз
Слайд 12Карбин
Это порошок глубокого черного цвета
с вкраплениями более крупных частиц.
Молекула карбина имеет
Это цепочечный полимер, который
встречается в виде двух форм:
полииновой
кумуленовой
Карбин – самая термодинамически устойчивая
форма элементарного углерода.
…- С ≡ С – С ≡ С – С ≡ С – …
…= С = С = С = С = С = С = …
Слайд 13Фуллерен
Это экзотическая модификация
элементарного углерода,
активно изучаемая в настоящее время.
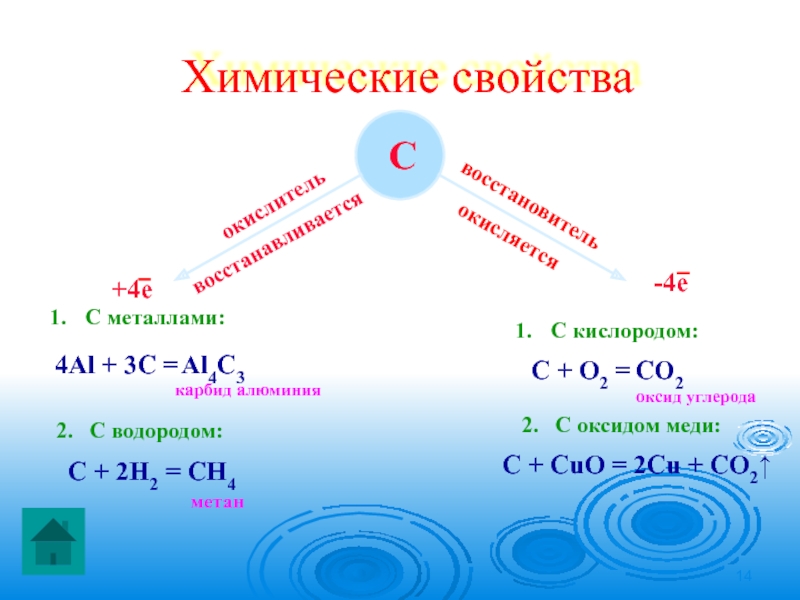
Слайд 14Химические свойства
С
окислитель
восстанавливается
С металлами:
4Al + 3C =
карбид алюминия
2. С водородом:
С
метан
восстановитель
окисляется
С кислородом:
C + О2 =
оксид углерода
2. С оксидом меди:
С + СuО = 2Сu + СО2↑
Al4C3
CО2
Слайд 16Проверь себя
Электронная формула внешнего энергетического уровня
атома углерода соответствует электронной конфигурации:
А.
Б. 2Б. 2s22p2
Г. 2Г. 2s22p4
BB. 2B. 2s22p3
Алмаз имеет следующую кристаллическую решетку:
А. Атомную
Б. Ионную
Г. Молекулярную
В. Металлическую
Степень окисления углерода в ряду
СН4 – С – СО – СО2
А. Не изменяется.
Б. Увеличивается.
В. Уменьшается.
Слайд 19Домашнее задание
§28, упр. 8 стр. 134.
Ответить на вопросы:
почему у алмаза и
почему сейчас стоит проблема глобального потепления климата?
Заполнить таблицу в рабочей тетради.