- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока по химии в 9 классе Коррозия металлов
Содержание
- 1. Презентация урока по химии в 9 классе Коррозия металлов
- 2. Коррозия – самопроизвольное разрушение (окисление) металлов под
- 3. КОРРОЗИЯ МЕТАЛЛОВ
- 4. ЗНАЧЕНИЕ КОРРОЗИИПриводит к разрушению приборов и конструкций,
- 5. Общее представление о коррозии (исторический этап)Химическая сущность коррозии(информационно-экспериментальный этап)Способы защиты металлов от коррозии (практический этап)ПЛАН УРОКА
- 6. ЭТАПЫ УРОКАпрактическийинформационно-экспериментальныйисторический
- 7. I.Общее представление о коррозии (исторический этап).
- 8. Коррозионная стойкость металла зависит от:Самого металлаВлияния среды
- 9. Этапы урокапрактическийинформационно-экспериментальныйисторический
- 10. II. Химическая сущность коррозии (информационно-экспериментальный этап)Коррозионная стойкость
- 11. II. Химическая сущность коррозии (информационно-экспериментальный этап)Коррозионная стойкость
- 12. Химическая(газовая) коррозия – это разрушение металла окислением
- 13. Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
- 14. Электрохимическая коррозия стакан №22. Кислотная среда (окислитель
- 15. Электрохимическая коррозия стакан №3 Zn + 2HCl
- 16. Электрохимическая коррозия стакан №4Fe + 2HCl =FeCl2
- 17. Выводы: При взаимном контакте двух
- 18. Определите, какой металл будет разрушаться в следующих
- 19. Решение проблемы коррозииРыжей крысе – ржавчине, что
- 20. Этапы урокапрактическийинформационно-экспериментальныйисторический
- 21. III. Способы защиты металлов от коррозии
- 22. III. Способы защиты металлов от коррозии (практический
- 23. III. Способы защиты металлов от коррозии (практический
- 24. Домашнее задание§ 10, конспект. Упр.1.(Прага)
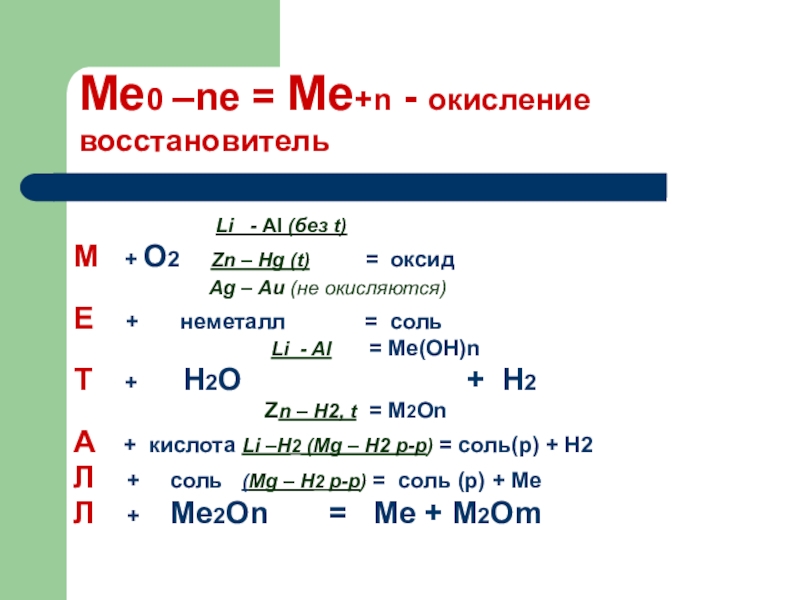
Слайд 1Me0 –ne = Me+n - окисление
восстановитель
М + O2 Zn – Hg (t) = оксид
Ag – Au (не окисляются)
Е + неметалл = соль
Li - Al = Me(OH)n
Т + H2O + H2
Zn – H2, t = M2On
А + кислота Li –H2 (Mg – H2 р-р) = соль(p) + H2
Л + соль (Mg – H2 р-р) = соль (р) + Ме
Л + Mе2On = Mе + M2Om
Слайд 2Коррозия – самопроизвольное разрушение (окисление) металлов под действием факторов окружающей среды
Хвастается новенький металл:
«Как силен я, смел и как удал!
Неподвластен никакой угрозе я.
Кроме рыжей крысы
с именем коррозия».
Слайд 4ЗНАЧЕНИЕ КОРРОЗИИ
Приводит к разрушению приборов и конструкций, машин, крыш памятников, мостов.
Вызывает
Отрицательно влияет на жизнь и здоровье людей.
Чтобы защитить металл от коррозии необходимо знать ХИМИЧЕСКУЮ СУЩНОСТЬ происходящих при этом процессов.
Слайд 5Общее представление о коррозии (исторический этап)
Химическая сущность коррозии(информационно-экспериментальный этап)
Способы защиты металлов
ПЛАН УРОКА
Слайд 8Коррозионная стойкость металла зависит от:
Самого металла
Влияния среды
Коррозионная стойкость металла зависит
Самого металла
Влияния среды
1586г.
1733г.
Делийская колонна,
возраст 2800 лет
(IX в. до н. э.)
Слайд 10II. Химическая сущность коррозии
(информационно-экспериментальный этап)
Коррозионная стойкость металла зависит от:
Самого металла
Делийская колонна ω(Fe) – 99,72%
Слайд 11II. Химическая сущность коррозии
(информационно-экспериментальный этап)
Коррозионная стойкость металла
зависит от:
Влияния среды
/ \
Химическая Электрохимическая
Слайд 12Химическая(газовая) коррозия – это разрушение металла окислением его в окружающей среде
2Zn + O2 = 2ZnO
металл не Плотная оксидная пленка,
разрушается прекращающая доступ O2
(Аl, Pb, Sn) к металлу и дальнейшую
коррозию
3Fe +2O2 = (FeO;Fe2O3)Fe3O4
Разрушение Смесь
металла Рыхлая пленка
приводит к полному
разрушению металла
Слайд 13Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением
Слайд 14Электрохимическая коррозия
стакан №2
2. Кислотная среда
(окислитель – ионы водорода Н+).
Fe
разрушение железа
Fe - 2e = Fe2+ | 1 – окисление
востановитель
2H+ +2e = H2 | 1 – восстановление
окислитель
Слайд 15Электрохимическая коррозия
стакан №3
Zn + 2HCl = ZnCl2 + H2
разрушение цинка
восстановитель
Fe; 2H+ +2e = H2 | 1 – восстановление
окислитель
Слайд 16Электрохимическая коррозия
стакан №4
Fe + 2HCl =FeCl2 + H2
разрушение железа
Fe; Fe- 2e
восстановитель
Cu; 2H+ +2e = H2 | 1 – восстановление
окислитель
Слайд 17
Выводы:
При взаимном контакте двух металлов в среде электролита,
более
Слайд 18Определите, какой металл будет разрушаться в следующих парах
Cu-Zn
Cu-Ag Fe-Zn
Mg-Sn Fe-Cu
Слайд 19Решение проблемы коррозии
Рыжей крысе – ржавчине, что шарит по углам,
Ни одной
Пусть не разевает свой зубастый рот –
Ей больше не достанется «железный бутерброд».
Слайд 21 III. Способы защиты металлов от
коррозии (практический этап)
1. Нанесение защитных
Неметаллических
лаки, краски.
Металлических –
покрытие слоем других металлов Cr, Ni, Sn, Zn, Au
Лужение – покрытие железного листа слоем олова
(консервная банка).
Слайд 22III. Способы защиты металлов от коррозии (практический этап)
2. Использование нержавеющих сталей
скульптура «Рабочий и колхозница»
нержавеющая сталь
обелиск «Покорителям космоса»
титановый сплав
Слайд 23III. Способы защиты металлов от коррозии (практический этап)
3. Протекторная защита -
создание
активным металлом
протектором
4. Обработка среды:
Удаление окислителей (деаэрация – удаление кислорода) (рис.17стр.48).
Использование замедлителей коррозии – ингибиторов.