Красноярск 2018
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока по химии 8 класс с элементами ЦОР на тему Строение электронных оболочек атомов
Содержание
- 1. Презентация урока по химии 8 класс с элементами ЦОР на тему Строение электронных оболочек атомов
- 2. Цель урока: развитие химической компетентности учащихся в области современного представления о строении атома
- 3. Образовательные:Актуализировать знания о планетарной модели атома, гипотезе
- 4. Источники информации: учебник О.С. Габриелян, Химия 8 класс,
- 5. Вспомни!
- 6. 1. Чему равно общее количество электронов в атоме? Назад
- 7. 2. Что такое энергетический уровень? Назад
- 8. 3. Определите число протонов, электронов и нейтронов в данном атоме. Назад
- 9. 4. Определите число протонов, электронов и нейтронов в данном атоме.Назад
- 10. Слайд 10
- 11. Ребята, мы с вами знаем что у
- 12. Слайд 12
- 13. Слайд 13
- 14. Электронная оболочка – это совокупность всех электронов
- 15. Подуровни состоят из орбиталей. Число орбиталей на
- 16. Энергетические уровни, содержащие максимальное число электронов, называются
- 17. ЗАПОМНИТЕ!Электроны, расположенные на последней электронной оболочке, называются
- 18. Форма электронных облаков (орбиталей)Область наиболее вероятного местонахождения
- 19. 1 периодН + 11n=1S1 S1Нe + 22n=1S1
- 20. Электронные облакаС 6 Схема построенаДля построения схемы нажимайте на клавишу «ПРОБЕЛ»Следующий слайд
- 21. Электронные облакаO 8 Схема построенаДля построения схемы нажимайте на клавишу «ПРОБЕЛ»Следующий слайд
- 22. 2 периодLi + 32 1n=1n=21 S2
- 23. 2 периодС + 62 4n=1n=2N +
- 24. § 9 Упр. 2,4Домашнее задание
- 25. Спасибо за внимание!
Слайд 18 класс
Тема урока: Строение электронных оболочек атомов
Выполнила: Зуева Екатерина Васильевна учитель
Слайд 2Цель урока: развитие химической компетентности учащихся в области современного представления о
Слайд 3Образовательные:
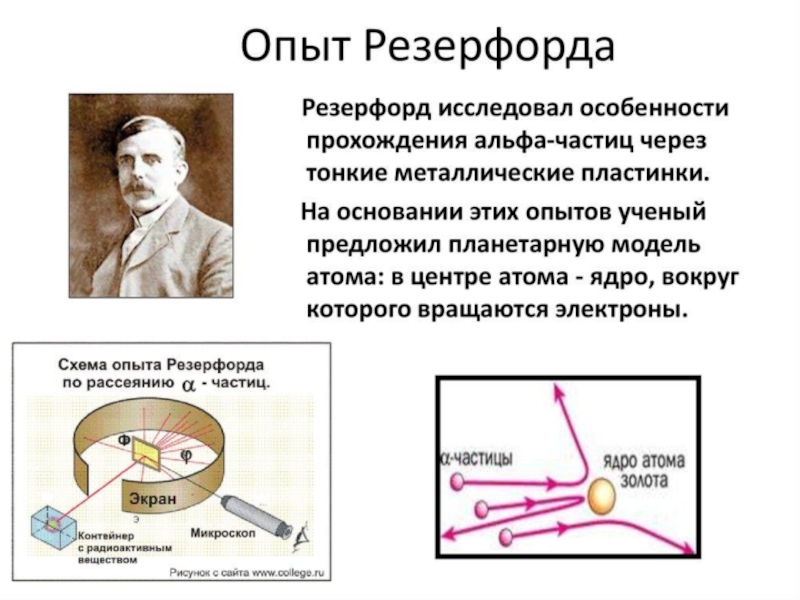
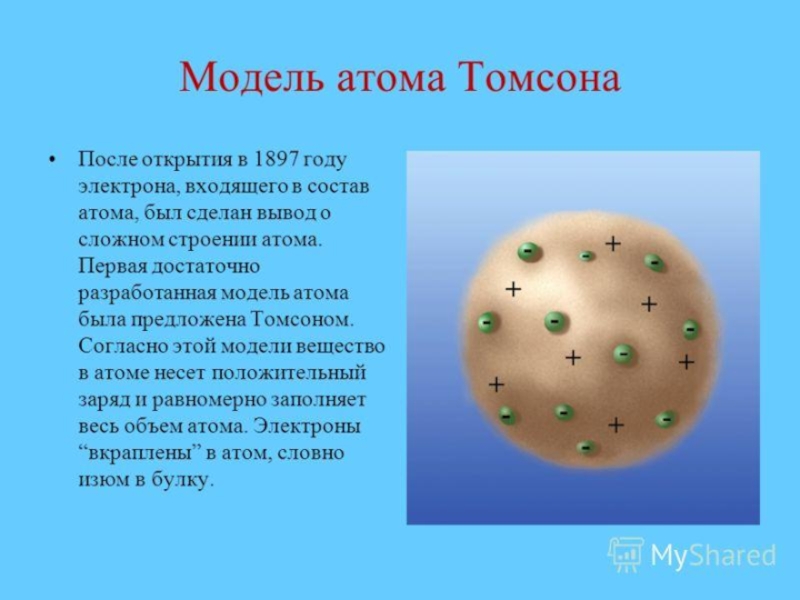
Актуализировать знания о планетарной модели атома, гипотезе Томсона и фундаментальном опыте
Сформировать представления об электронной оболочке атома и энергетических уровнях, рассмотрение электронного строения некоторых элементов, развить умения по составлению электронных формул атомов, определению элементов по их электронным формулам, определение состава атома.
Развивающие:
Сформировать навыки определения состава атома, состава ядра атома по периодической системе химических элементов
Продолжить развитие навыков работы с опорным конспектом, таблицами и схемами
Развивать интеллектуальные и творческие способности учащихся
Воспитательные:
Воспитать интерес к предмету химии при знакомстве с историей развития науки, быть внимательным на уроке, оценивать свои знания и стремиться к развитию их.
Задачи:
Слайд 4Источники информации: учебник О.С. Габриелян, Химия 8 класс, М., Дрофа, 2009; рабочая программа,
Оборудование: компьютер, проектор,
Дидактическое сопровождение: ПСХЭ, индикаторы обратной связи, презентация к уроку.
Ресурсы и оборудование:
Слайд 10
Актуализация
На «3»
Дайте определения понятиям: сложное вещество, простое вещество, атом.
Определите число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота.
На «4»
1. Порядковый номер элемента в таблице Д.И. Менделеева равен 35. Какой это элемент? Чему равен заряд ядра этого атома? Сколько протонов, электронов, нейтронов в его атоме?
На «5»
Дайте полную характеристику глюкозы С6H12O6, используя пример описания углекислого газа CO2 (см.стр 42)
Слайд 11Ребята, мы с вами знаем что у каждого из нас есть
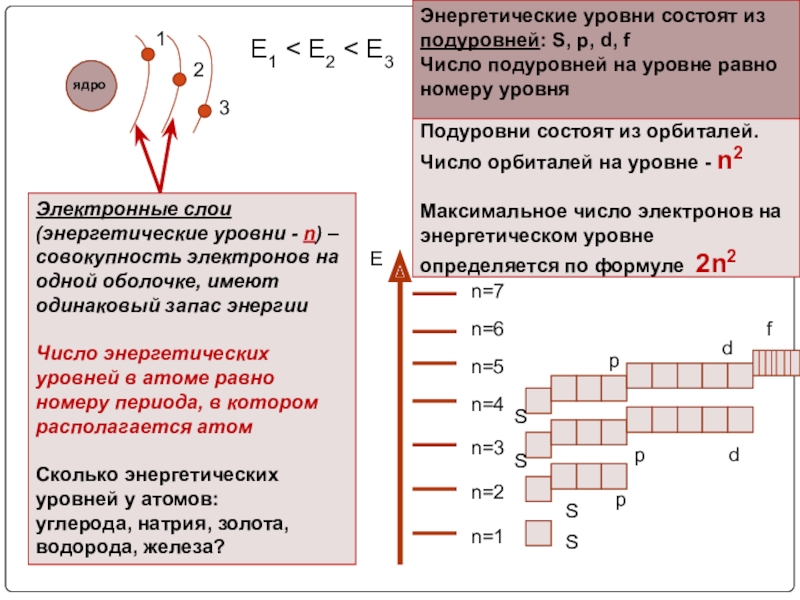
Слайд 14Электронная оболочка – это совокупность всех электронов в атоме, окружающих ядро
Электроны
По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Слайд 15
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное
1
2
3
Е1 < E2 < E3
Электронные слои (энергетические уровни - n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Слайд 16Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
Слайд 17ЗАПОМНИТЕ!
Электроны, расположенные на последней электронной оболочке, называются внешними.
Число внешних электронов для
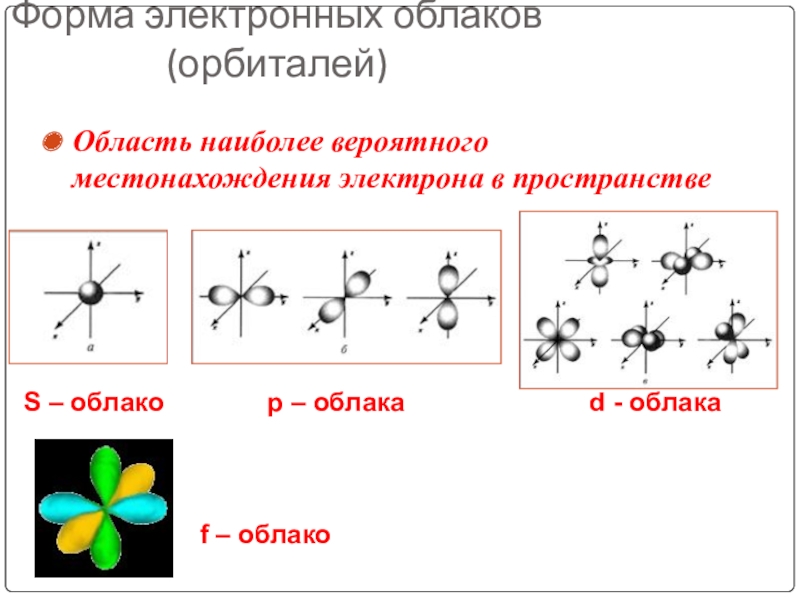
Слайд 18Форма электронных облаков (орбиталей)
Область наиболее вероятного местонахождения электрона в пространстве
S –
f – облако
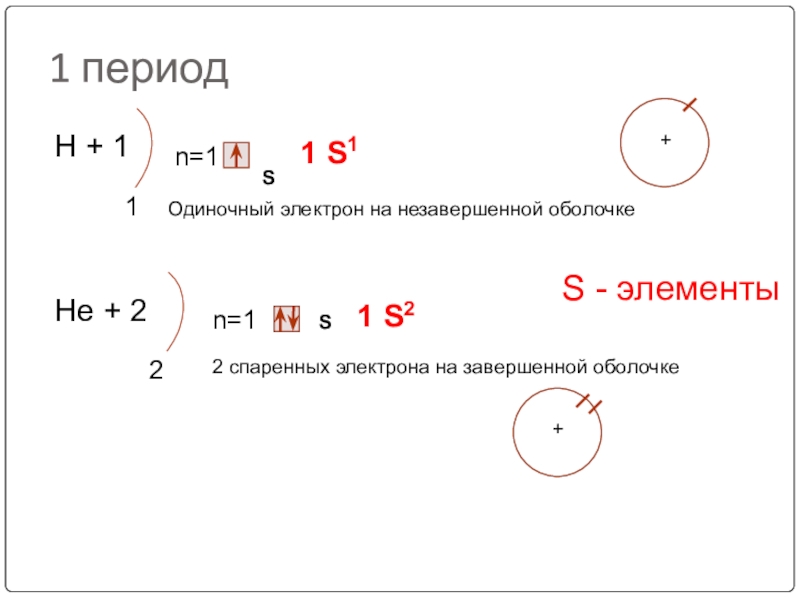
Слайд 191 период
Н + 1
1
n=1
S
1 S1
Нe + 2
2
n=1
S
1 S2
Одиночный электрон на незавершенной
2 спаренных электрона на завершенной оболочке
S - элементы
+
+
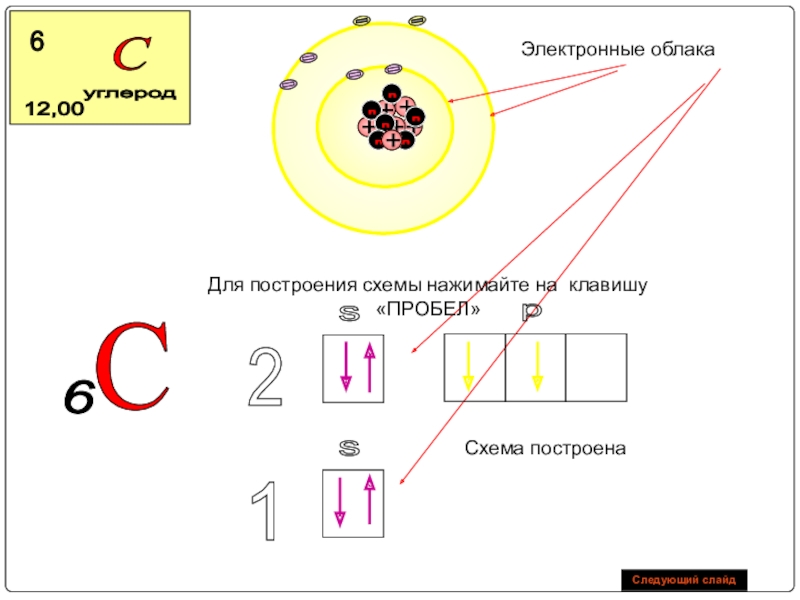
Слайд 20Электронные облака
С
6
Схема построена
Для построения схемы нажимайте на клавишу «ПРОБЕЛ»
Следующий
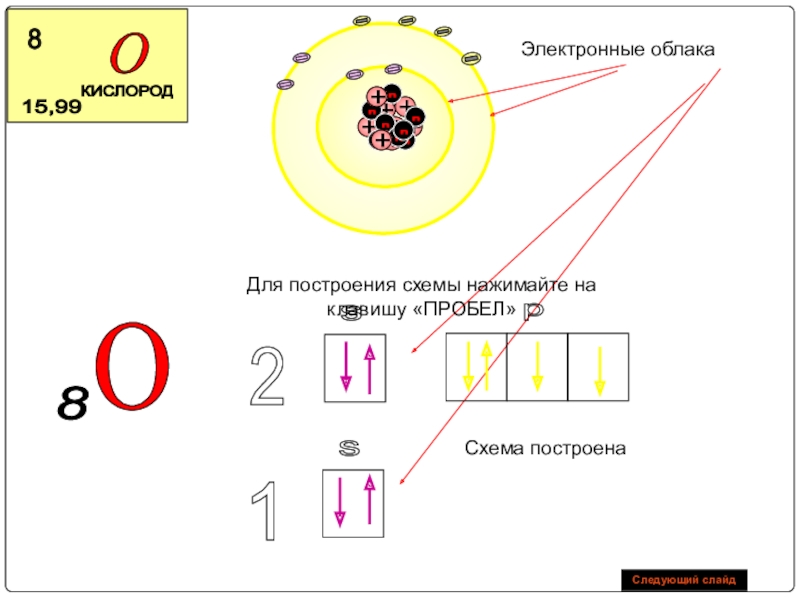
Слайд 21Электронные облака
O
8
Схема построена
Для построения схемы нажимайте на клавишу «ПРОБЕЛ»
Следующий
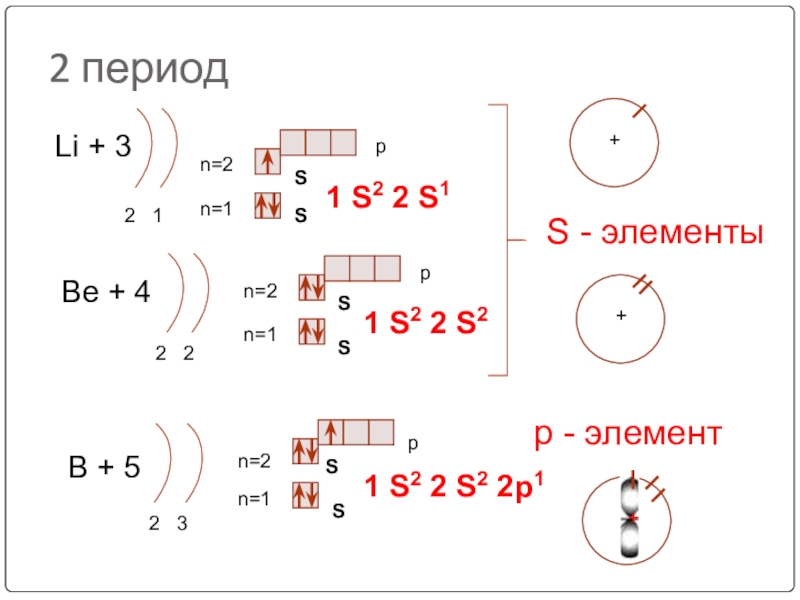
Слайд 222 период
Li + 3
2 1
n=1
n=2
1 S2 2 S1
Be + 4
2
n=1
n=2
1 S2 2 S2
B + 5
2 3
n=1
n=2
1 S2 2 S2 2p1
S - элементы
р - элемент
S
S
S
S
S
S
p
p
p
+
+
+
+
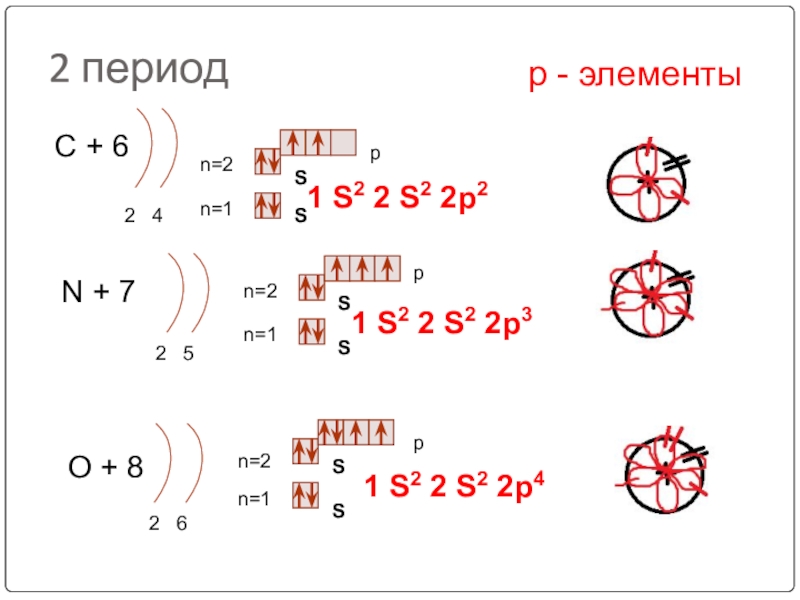
Слайд 232 период
С + 6
2 4
n=1
n=2
N + 7
2 5
n=1
n=2
O +
2 6
n=1
n=2
1 S2 2 S2 2p4
р - элементы
1 S2 2 S2 2p2
1 S2 2 S2 2p3
S
S
S
S
S
S
p
p
p