е р ч к е
Как-то раз я шел со своим другом по людной улице Москвы, и он внезапно воскликнул:
– “Я слышу сверчка”.
– “Да ты с ума сошел”, – ответил я, окинув взором переполненную в час пик центральную улицу города. Повсюду сновали автомобили, работали строители, над головой летали самолеты.
– “Но, я правда слышу сверчка”, – настаивал он, двигаясь к цветочной клумбе, разбитой перед причудливым зданием какого-то учреждения. Потом нагнулся, раздвинул листья растений и показал мне сверчка, беспечно стрекочущего и радующегося жизни.
– “Удивительно”, – отозвался я. – “У тебя, должно быть, фантастический слух”.
– “Да, нет. Все зависит от того, на что ты настроен”, сказал он.
Я желаю вам настроиться на плодотворную, успешную работу сегодня на уроке.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока химии в 9 классе на тему Диссоциация кислот, оснований и солей
Содержание
- 1. Презентация урока химии в 9 классе на тему Диссоциация кислот, оснований и солей
- 2. БЛИЦ ОПРОС!
- 3. Катионы Положительно (+) заряженные частицы
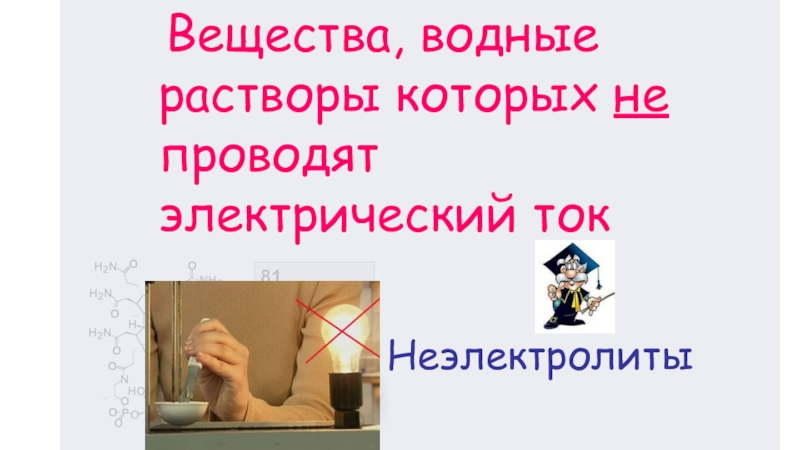
- 4. Неэлектролиты Вещества, водные растворы которых не проводят электрический ток
- 5. Анионы Отрицательно (-) заряженные частицы
- 6. Электролиты Вещества, водные растворы которых проводят электрический ток
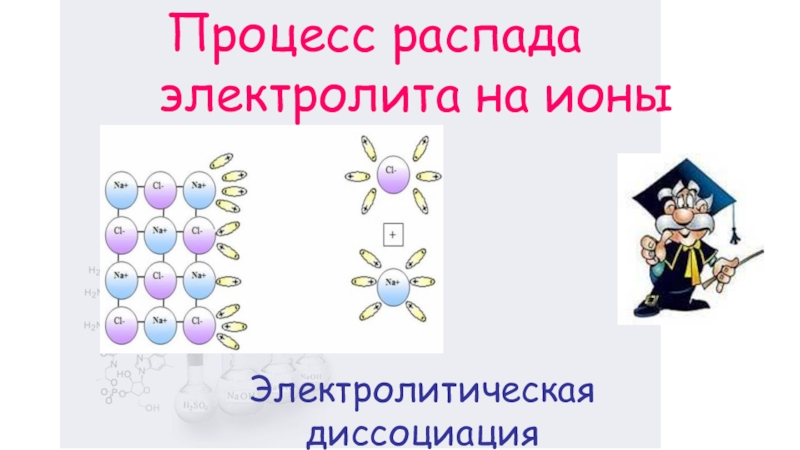
- 7. Электролитическая диссоциация Процесс распада электролита на ионы
- 8. Кто автор теории электролитической диссоциации?В каком году
- 9. Какой вопрос мы будем изучать сегодня?
- 10. Тема урока«Диссоциация кислот, оснований и солей»Определяем цели и задачи урока!
- 11. РАБОТАЕМ В ГРУППАХ1 группа. Как происходит диссоциация
- 12. Осторожно: кислоты и щёлочи – едкие вещества.Разрушают ткани, раздражают кожу, слизистые оболочки.
- 13. Слайд 13
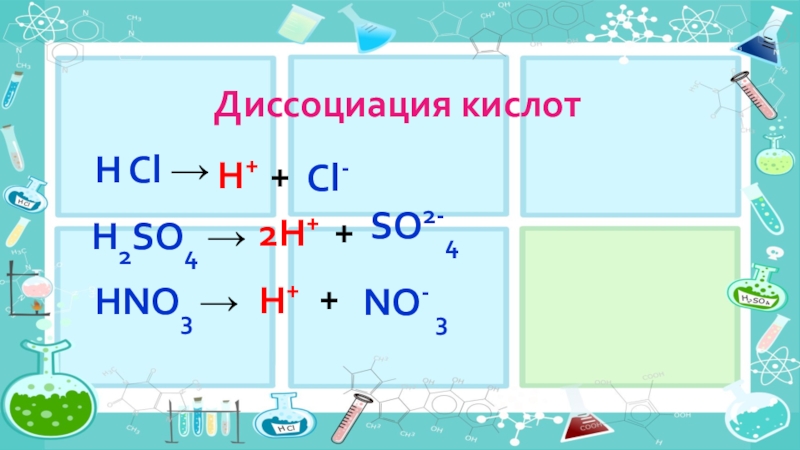
- 14. Диссоциация кислот 2H+ H Cl →H++Cl- H2SO4 →+ SO2-4HNO3 →H++NO- 3
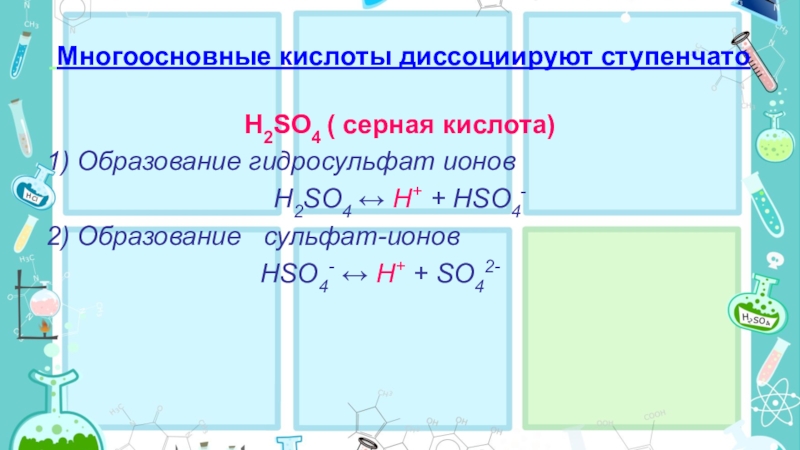
- 15. Многоосновные кислоты диссоциируют ступенчатоH2SO4 ( серная
- 16. Лабораторный опыт № 1
- 17. Слайд 17
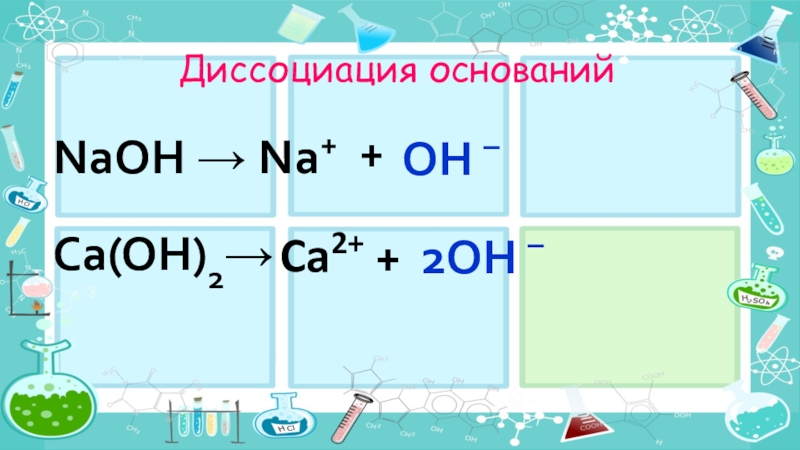
- 18. Диссоциация оснований + NaOH →Na+OH –2OH –Ca(OH)2→Ca2+
- 19. Ступенчатая диссоциация основанийСa(OH)2 (гидроксид кальция)1) Образование гидроксо-ионов
- 20. Лабораторный опыт № 2
- 21. Слайд 21
- 22. Ca2+ Диссоциация солейNaCl →Na+2Na++++Cl- Na2SO4 →SO2- 4CaCl 2→2 Cl-
- 23. Лабораторный опыт № 3
- 24. Самостоятельная работа Напишите уравнения диссоциации следующих
- 25. ВЕК ЖИВИ – ВЕК УЧИСЬ!Домашнее задание:
- 26. РЕФЛЕКСИЯКакая была тема урока?Какую цель и задачи
БЛИЦ ОПРОС!
Слайд 8Кто автор теории электролитической диссоциации?
В каком году была открыта эта теория?
С. Аррениус;
1887 год.
Слайд 11РАБОТАЕМ В ГРУППАХ
1 группа. Как происходит диссоциация кислот?
Чем обусловлены общие химические свойства кислот?
Составить схему диссоциации кислот в общем виде.
2 группа. Как происходит диссоциация оснований?
Чем обусловлены общие химические свойства оснований?
Составить схему диссоциации оснований в общем виде.
3 группа. Как происходит диссоциация солей?
Почему соли не обладают характерными химическими свойствами?
Составить схему диссоциации солей в общем виде.
Составить схему диссоциации кислот в общем виде.
2 группа. Как происходит диссоциация оснований?
Чем обусловлены общие химические свойства оснований?
Составить схему диссоциации оснований в общем виде.
3 группа. Как происходит диссоциация солей?
Почему соли не обладают характерными химическими свойствами?
Составить схему диссоциации солей в общем виде.
Слайд 12Осторожно: кислоты и щёлочи – едкие вещества.
Разрушают ткани, раздражают кожу, слизистые
оболочки.
Слайд 15 Многоосновные кислоты диссоциируют ступенчато
H2SO4 ( серная кислота)
1) Образование гидросульфат ионов
H2SO4
↔ H+ + HSO4-
2) Образование сульфат-ионов
HSO4- ↔ H+ + SO42-
2) Образование сульфат-ионов
HSO4- ↔ H+ + SO42-
Слайд 16
Лабораторный опыт № 1
«Выявление катионов водорода»
В
пробирки налейте по 1—2 мл растворов соляной и серной кислот,
В каждую пробирку добавьте несколько капель раствора лакмуса. По изменению цвета определите кислотность среды.
В каждую пробирку добавьте несколько капель раствора лакмуса. По изменению цвета определите кислотность среды.
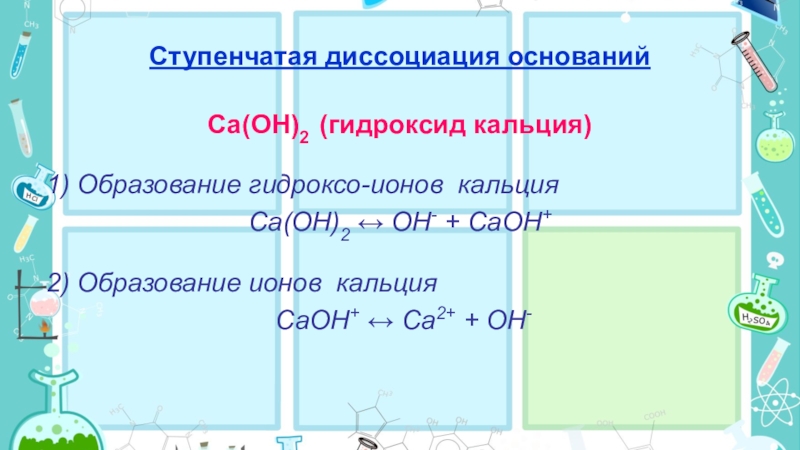
Слайд 19Ступенчатая диссоциация оснований
Сa(OH)2 (гидроксид кальция)
1) Образование гидроксо-ионов кальция
Сa(OH)2 ↔ OH- +
СaOH+
2) Образование ионов кальция
СaOH+ ↔ Сa2+ + OH-
2) Образование ионов кальция
СaOH+ ↔ Сa2+ + OH-
Слайд 20
Лабораторный опыт № 2
«Выявление гидроксид анионов»
В пробирки налейте по 1—2 мл растворов гидроксида натрия и гидроксида кальция,
В каждую пробирку добавьте несколько капель раствора лакмуса. По изменению цвета определите кислотность среды.
В каждую пробирку добавьте несколько капель раствора лакмуса. По изменению цвета определите кислотность среды.
Слайд 23
Лабораторный опыт № 3
«Выявление общих свойств у
солей»
В пробирки налейте по 1—2 мл растворов сульфата натрия и хлорида кальция,
В каждую пробирку добавьте несколько капель раствора лакмуса. Что наблюдаете?
В пробирки налейте по 1—2 мл растворов сульфата натрия и хлорида кальция,
В каждую пробирку добавьте несколько капель раствора лакмуса. Что наблюдаете?
Слайд 24Самостоятельная работа
Напишите уравнения диссоциации
следующих веществ:
ZnCl2, Н3PO4, Al(NO3)3,
Сu(OН)2 , K2SO3, KOН, BaSO4, FeCl3, Al2(SO4)3, Na2S, MgCO3 , Ba(OН)2 , H2SiO3, Na3PO4, AgCl,
Слайд 25ВЕК ЖИВИ – ВЕК УЧИСЬ!
Домашнее задание:
1). Проработать материал §7,
выучить определения; выполнить упражнение 2,тестовые задания, решить задачу 3, – стр. 29
2). Творческое задание:
составить тесты ( 3-5 заданий) по данной теме.
2). Творческое задание:
составить тесты ( 3-5 заданий) по данной теме.
Слайд 26РЕФЛЕКСИЯ
Какая была тема урока?
Какую цель и задачи мы перед собой ставили?
Закончите
предложения
Сегодня на уроке я узнал…
Сегодня на уроке я научился…
У меня пока не всегда получается…
Мне было…
Сегодня на уроке я узнал…
Сегодня на уроке я научился…
У меня пока не всегда получается…
Мне было…