тока через расплав или раствор электролитов.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока химии в 11 классе Электролиз
Содержание
- 1. Презентация урока химии в 11 классе Электролиз
- 2. Электроды К(-) катод (движутся катионы, положительнозаряженные частицы-
- 3. Расплав – присутствуют только ионы вещества
- 4. Алюминий( Al) получают электролизом раствора оксида в расплавленном криолите.
- 5. Электролиз раствора ( кроме вещества присутствует H2O)
- 6. !A (+) 1.В первую очередь окисляются бескислородные
- 7. Слайд 7
- 8. Ме( от Al до H2) Одновременно
- 9. Органические вещества
- 10. Пример электролиза раствора КNO3
- 11. Электролиз растворов
- 12. Электролиз растворов А(+) Порядок окисления ионов
Электроды К(-) катод (движутся катионы, положительнозаряженные частицы- электрод противоположно заряжен –отрицательно) А (+) анод –( движутся анионы отрицательнозаряженные частицы электрод противоположнозаряжен –положительно)
Слайд 1Электролиз
Электролиз - это окислительно-восстановитьный процесс, протекающий на электродах, при пропускании электрического
Слайд 2Электроды
К(-) катод (движутся катионы, положительнозаряженные частицы- электрод противоположно заряжен –отрицательно)
А (+) анод –( движутся анионы отрицательнозаряженные частицы электрод противоположнозаряжен –положительно)
Слайд 3Расплав – присутствуют только ионы вещества
Na2 S
+ 2-
Na2S 2Na+ S
+ 0
K(-) Na +1e Na
2- 0
A(+) S - 2e S
эл.т.
Na2 S 2Na +S
! С помощью электролиза расплавов получают Ме стоящие в электрохимическом ряду до Аl ( включительно).
+ 2-
Na2S 2Na+ S
+ 0
K(-) Na +1e Na
2- 0
A(+) S - 2e S
эл.т.
Na2 S 2Na +S
! С помощью электролиза расплавов получают Ме стоящие в электрохимическом ряду до Аl ( включительно).
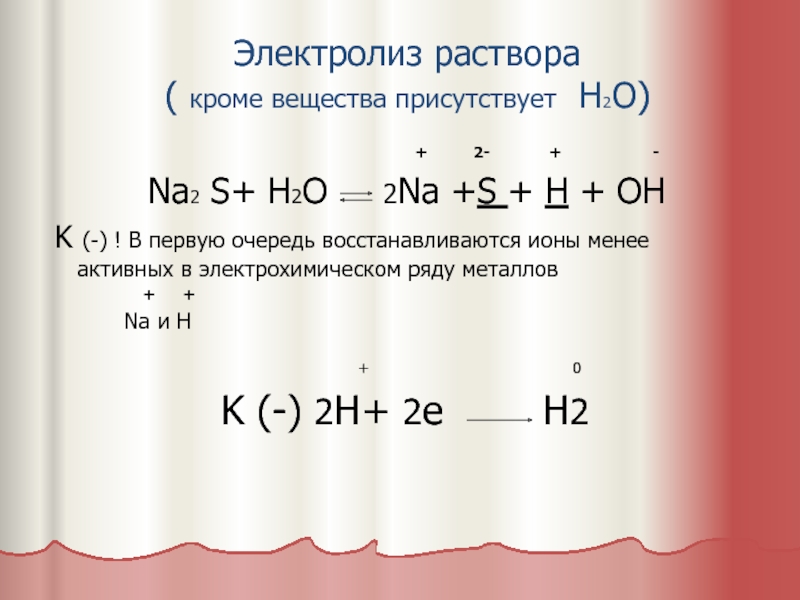
Слайд 5Электролиз раствора
( кроме вещества присутствует H2O)
+ 2- + -
Na2 S+ H2O 2Na +S + H + OH
K (-) ! В первую очередь восстанавливаются ионы менее активных в электрохимическом ряду металлов
+ +
Na и H
+ 0
K (-) 2H+ 2e H2
Na2 S+ H2O 2Na +S + H + OH
K (-) ! В первую очередь восстанавливаются ионы менее активных в электрохимическом ряду металлов
+ +
Na и H
+ 0
K (-) 2H+ 2e H2
Слайд 6
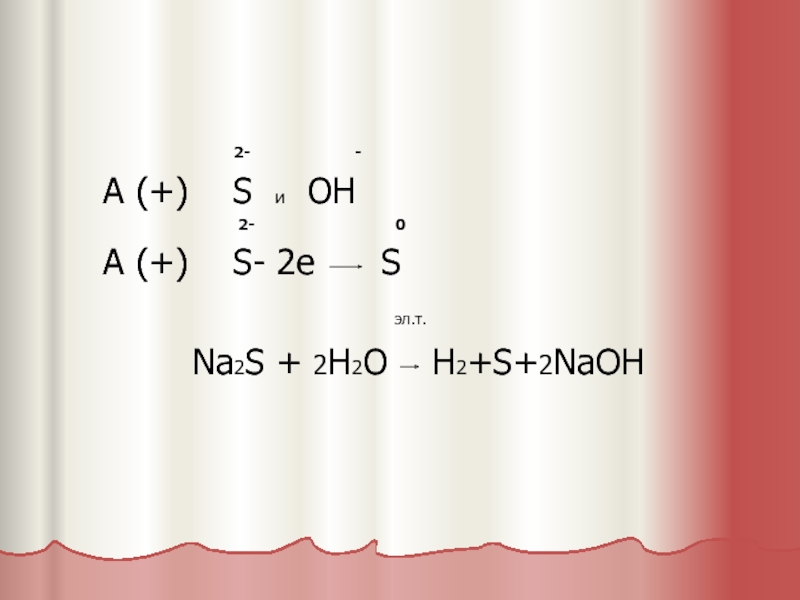
!A (+) 1.В первую очередь окисляются бескислородные ионы.
2-
- - _
( S, J, Br, Cl и анионы органических кислот
- эл.т.
( 2R – COO- 2e CO2+ R – R
2. Во второю очередь гидроксид ионы( в щелочной среде)
-
4OH - 4e O2+ 2H2O
( в кислой или нейтральной) +
2H2 O – 4e O2 + 4 H
3. Не окисляются ионы кислородосодержащих
-
неорганических кислот и F
( S, J, Br, Cl и анионы органических кислот
- эл.т.
( 2R – COO- 2e CO2+ R – R
2. Во второю очередь гидроксид ионы( в щелочной среде)
-
4OH - 4e O2+ 2H2O
( в кислой или нейтральной) +
2H2 O – 4e O2 + 4 H
3. Не окисляются ионы кислородосодержащих
-
неорганических кислот и F
Слайд 8Ме( от Al до H2)
Одновременно разряжаются
+ +
(восстанавливаются) и Ме и Н)
Зависит :1.От Концентрации соли в растворе ( чем выше концентрация соли, тем вероятнее
+
восстановление Ме
2.От Расположения Ме в электрохимическом ряду- чем менее активнее ( чем ближе к Н2) тем вероятнее +
восстановление Ме )
(восстанавливаются) и Ме и Н)
Зависит :1.От Концентрации соли в растворе ( чем выше концентрация соли, тем вероятнее
+
восстановление Ме
2.От Расположения Ме в электрохимическом ряду- чем менее активнее ( чем ближе к Н2) тем вероятнее +
восстановление Ме )
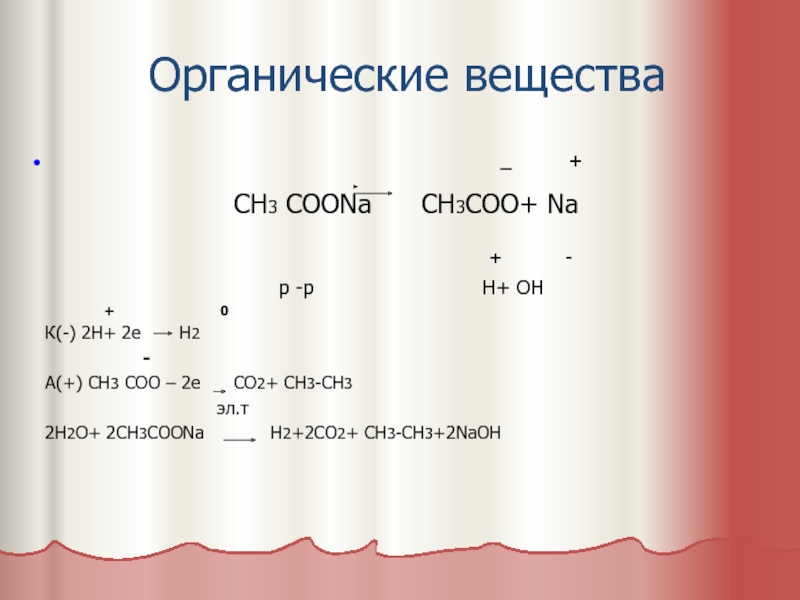
Слайд 9Органические вещества
_ +
СН3 СООNa CH3COO+ Na
+ -
р -р Н+ ОН
+ 0
К(-) 2Н+ 2е Н2
-
А(+) СН3 СОО – 2е СО2+ СН3-СН3
эл.т
2Н2О+ 2СН3COONa H2+2CO2+ CH3-CH3+2NaOH
СН3 СООNa CH3COO+ Na
+ -
р -р Н+ ОН
+ 0
К(-) 2Н+ 2е Н2
-
А(+) СН3 СОО – 2е СО2+ СН3-СН3
эл.т
2Н2О+ 2СН3COONa H2+2CO2+ CH3-CH3+2NaOH
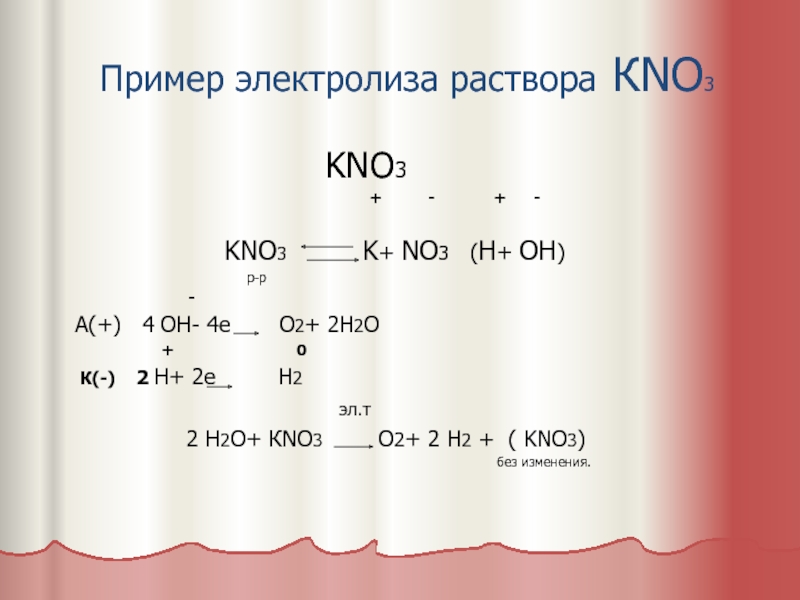
Слайд 10Пример электролиза раствора КNO3
KNO3
+ - + -
KNO3 K+ NO3 (H+ OH)
р-р
-
А(+) 4 ОН- 4е О2+ 2Н2О
+ 0
К(-) 2 Н+ 2е Н2
эл.т
2 Н2О+ КNO3 O2+ 2 H2 + ( KNO3)
без изменения.
+ - + -
KNO3 K+ NO3 (H+ OH)
р-р
-
А(+) 4 ОН- 4е О2+ 2Н2О
+ 0
К(-) 2 Н+ 2е Н2
эл.т
2 Н2О+ КNO3 O2+ 2 H2 + ( KNO3)
без изменения.
Слайд 12Электролиз растворов
А(+) Порядок окисления ионов
0 0 0 0 - 0
1.Бескислородный кислотный остаток (Бес Кост)( J2,Cl2,Br2,S) K ост-е Кост
-
2.Кислородосодержащий кислотный остаток(Кислор Кост) , окисляется ОН
_ + +
4 ОН- 4е О2+ 4Н ( 2Н2О- 4е О2+ 4Н)
1.Бескислородный кислотный остаток (Бес Кост)( J2,Cl2,Br2,S) K ост-е Кост
-
2.Кислородосодержащий кислотный остаток(Кислор Кост) , окисляется ОН
_ + +
4 ОН- 4е О2+ 4Н ( 2Н2О- 4е О2+ 4Н)