- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад учащихся на тему Фосфор ,9класс
Содержание
- 1. Презентация учащихся на тему Фосфор ,9класс
- 2. Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.
- 3. Фосфор занимает 12-е место по распространенности элементов
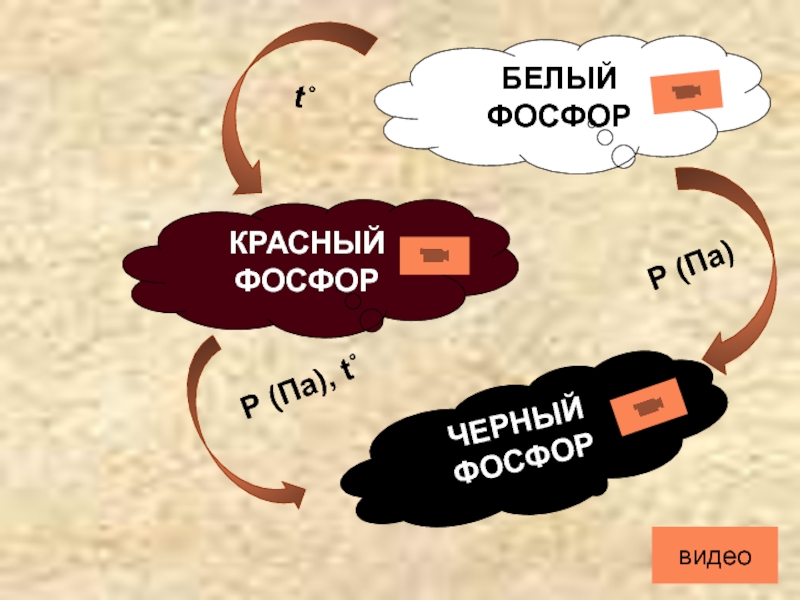
- 4. АллотропияБЕЛЫЙФОСФОРКРАСНЫЙФОСФОРЧЕРНЫЙ ФОСФОРР (Па), t˚Р (Па)t˚видео
- 5. Химические свойства
- 6. Взаимодействие с простыми веществами
- 7. Взаимодействие с металлами.
- 8. Взаимодействие с конц. азотной
- 9. Фосфор в промышленности получают из фосфата кальция
- 10. ПрименениеВ военных целяхСпичечное производствоВзрывчатые веществаФосфорные удобренияМоющие средстваПищевые добавки (БАДы)
Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.
Слайд 2Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.
Слайд 3Фосфор занимает 12-е место по распространенности элементов в природе. Он входит
в состав многих горных пород и содержится в живых организмах (в костях, зубах и т.д.).
Слайд 6 Взаимодействие с простыми веществами - неметаллами. Фосфор может
реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V) , например:
2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5
4P + 5О2 = 2P2О5
Видео
Видео
Слайд 7 Взаимодействие с металлами. При нагревании фосфора с
металлами образуются фосфиды:
3Mg + 2P = Mg3P2
Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфин PH3 по химическим свойствам похож на аммиак NH3.
Слайд 8 Взаимодействие с конц. азотной кислотой: 3Р + 5HNO3
+ 2H2O = 3H3PO4 + 5NO
0
-3
+1
Р0 + 3е → Р-3 1 ок – ль; вос – ние;
Р0 - 1е → Р+1 3 вос – ль; ок – ние;
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2
Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует:
Слайд 9Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из
фосфоритов и фторапатитов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора.
В качестве восстановителя используют кокс (углерод) . Для связывания соединений кальция добавляют кварцевый песок SiO2. Реакция протекает по уравнению:
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 +10CO
Получение