- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Равновесие, обратимость
Содержание
- 1. Презентация по химии Равновесие, обратимость
- 2. По направленности процесса химические реакции делятся на:НеобратимыеОбратимыеХимические
- 3. Признаки необратимостивыпал осадокобразовался газобразовалась вода – очень слабый электролит
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Химическое равновесиеХимическое равновесие – состояние химического обратимого
- 8. Допустим, для опыта взяли газообразные водород и
- 9. Химическое равновесие является динамичным (подвижным), так как
- 10. Французский химик Анри Ле Шателье в 1885
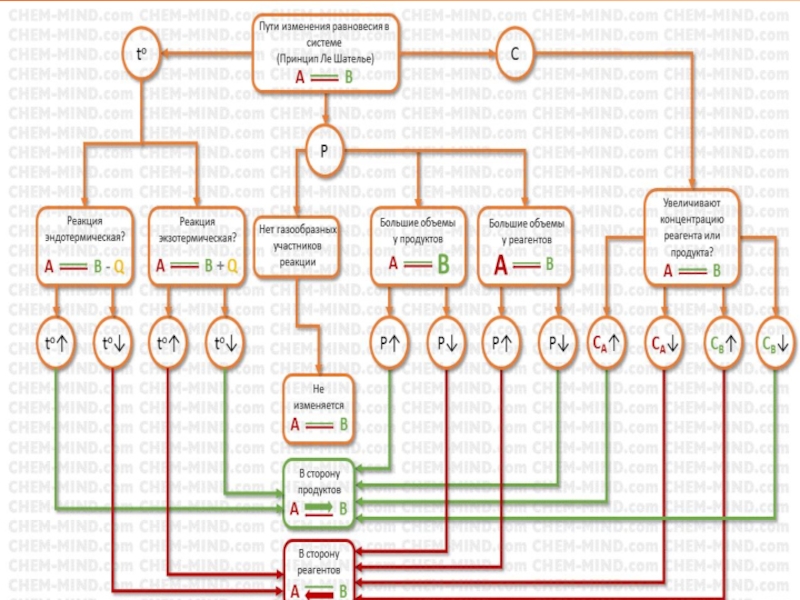
- 11. Принцип Ле ШательеЕсли изменить одно из условий
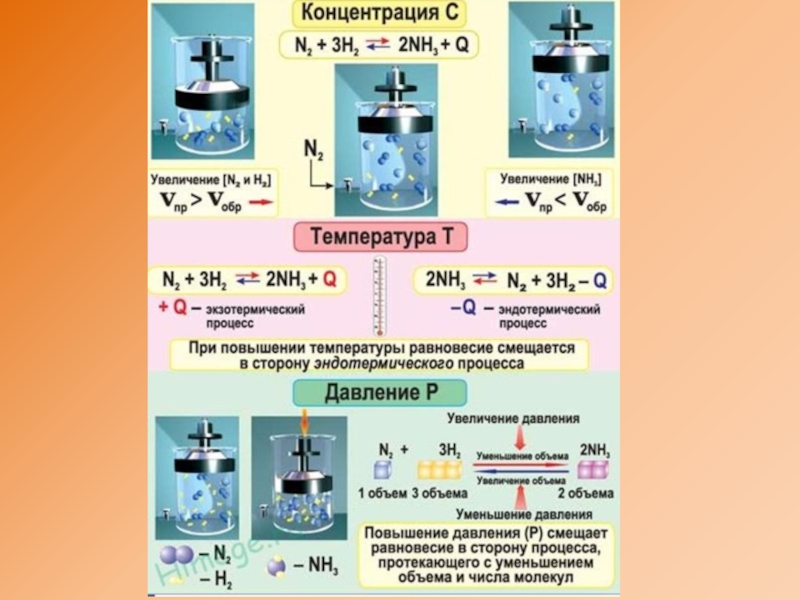
- 12. Изменение равновесных концентрацийЕсли увеличить концентрацию конечных продуктов,
- 13. Влияние изменения давленияПри увеличении давления равновесие смещается
- 14. При комнатной температуре NO2 – темно-коричневый газ
- 15. Влияние изменения температурыПри повышении температуры химическое равновесие
- 16. Слайд 16
- 17. Слайд 17
- 18. Спасибо за сотрудничество!
Слайд 2По направленности процесса химические реакции делятся на:
Необратимые
Обратимые
Химические реакции, которые могут протекать
Химические реакции, продукты которых не способны взаимодействовать друг с другом с образованием исходных веществ. К ним можно отнести все реакции обмена (осадок, газ или малодиссоциирующее вещество) и все реакции горения
H2 + I2 2HI
CaCO3 CaO + CO2
Na2SO4 + BaCl2 BaSO4 + 2NaCl
Слайд 7Химическое равновесие
Химическое равновесие – состояние химического обратимого процесса, при котором скорость
N2 + 3H2 2NH3 + Q
где α, β, γ, δ — показатели степеней, равные коэффициентам в обратимой реакции; Кравн — константа химического равновесия.
Слайд 8Допустим, для опыта взяли газообразные водород и йод. В первый момент
vпр = k1[H2][I2]
Здесь k1 – константа скорости прямой реакции. Постепенно в смеси накапливается продукт реакции HI. Но в этих же условиях йодистый водород с заметной скоростью разлагается на исходные вещества: H2 и I2. В данном конкретном случае кинетические уравнения соответствуют химическим уравнениям прямого и обратного процессов. Скорость обратной реакции (vобр) выражается кинетическим уравнением с константой скорости k2:
vобр = k2[HI]2
Когда йодистого водорода образуется уже достаточно много (т.е. когда его концентрация достигнет определенной величины), скорости прямой и обратной реакции выравниваются:
vпр = vобр
В этом случае говорят, что наступило химическое равновесие. Количество содержащихся в равновесной системе веществ H2, I2 и HI теперь не меняется со временем, если нет внешних воздействий на систему.
Слайд 9Химическое равновесие является динамичным (подвижным), так как при его наступлении реакция
Слайд 10Французский химик Анри Ле Шателье в 1885 г. вывел, а немецкий
Анри Ле Шателье
Фердинанд Браун
Слайд 11Принцип Ле Шателье
Если изменить одно из условий – температуру, давление или
Этот принцип также называют «принцип наоборот»
Слайд 12Изменение равновесных концентраций
Если увеличить концентрацию конечных продуктов, то равновесие смещается в
При уменьшении концентрации конечных продуктов реакция равновесия смещается в сторону их образования (прямая реакция), при уменьшении концентрации исходных продуктов – обратная.
Слайд 13Влияние изменения давления
При увеличении давления равновесие смещается в сторону той реакции,
3H2 + N2 2NH3
Если объемы газообразных продуктов одинаковы – изменение давления не оказывает смещения равновесия.
H2 + Cl2 = 2HCl
2V=2V
Слайд 14При комнатной температуре NO2 – темно-коричневый газ (часто его называют «бурым»
vпр = k1[NO2]2; vобр = k2[N2O4]
Происходящий при этом сдвиг равновесия вправо можно наблюдать экспериментально: при сжатии смеси газов она светлеет, поскольку уменьшается концентрация окрашенного NO2 и возрастает концентрация бесцветного N2O4
Слайд 15Влияние изменения температуры
При повышении температуры химическое равновесие смещается в сторону эндотермической
N2(r) + H2(r) 2NH3(r) + 92 кДж
2NH3(r) N2(r) +H2(r) – 92 кДж