- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Тотығу - тотықсыздану реакциясы
Содержание
- 1. Презентация Тотығу - тотықсыздану реакциясы
- 2. Сабақтың мақсатыОқушылардың тотығу дәрежесі және тотығу-тотықсыздану реакция
- 3. Тотығу – тотықсыздану реакцияларыТотығу - тотықсыздану процесі
- 4. Тотығу – тотықсыздану реакциялары
- 5. Тотығу – тотықсыздану реакциялары 20-
- 6. Тотығу - тотықсыздану реакциялары (ТТР)- – Химиялық реакцияларда әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежесінің өзгеруі.
- 7. Тотығу дәрежесіЖай заттардың құрамына кіретін элемент атомының
- 8. Тотығу – тотықсыздану реакциясын танып білуРеакция теңдеуіндегі
- 9. Тотықтырғыш пен тотықсыздандырғышты танып білу
- 10. Электронды баланс әдісі
- 11. Реакцияның жүруіне ортаның әсері +7Mn
- 12. Реакцияның жүруіне ортаның әсері
- 13. Реакцияның жүруіне ортаның әсері
- 14. Реакцияның жүруіне ортаның әсері
- 15. Электронды баланс әдісі арқылы реакция теңдеуін
- 16. Электронды баланс әдісі арқылы реакция теңдеуін
- 17. Электронды баланс әдісі арқылы реакция теңдеуін
- 18. Электронды баланс әдісі арқылы реакция теңдеуін
- 19. Тотығу - тотықсыздану реакцияларының маңызы
- 20. Ормандағы өртC + O2 → CO2
- 21. фотосинтезО2О2О2О26CO2 + 6H2O → C6H12O6 + 6O2
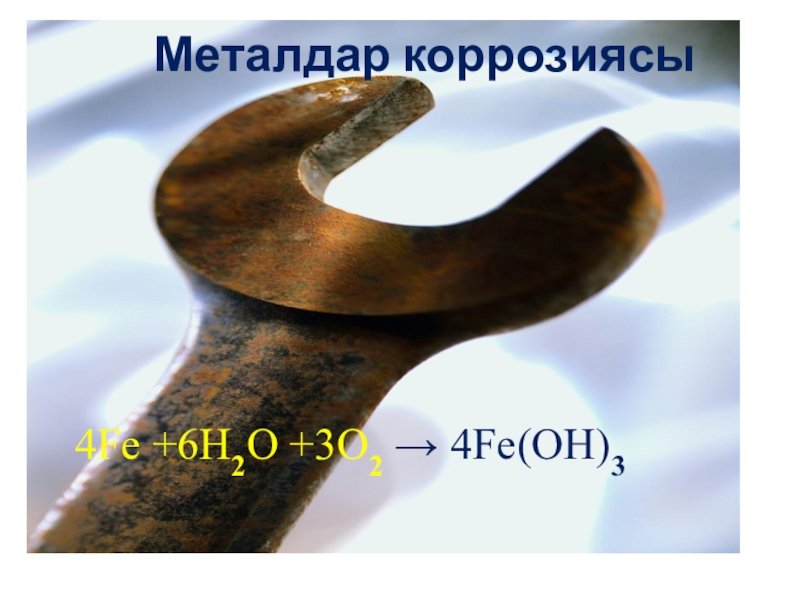
- 22. Металдар коррозиясы4Fe +6H2O +3O2 → 4Fe(OH)3
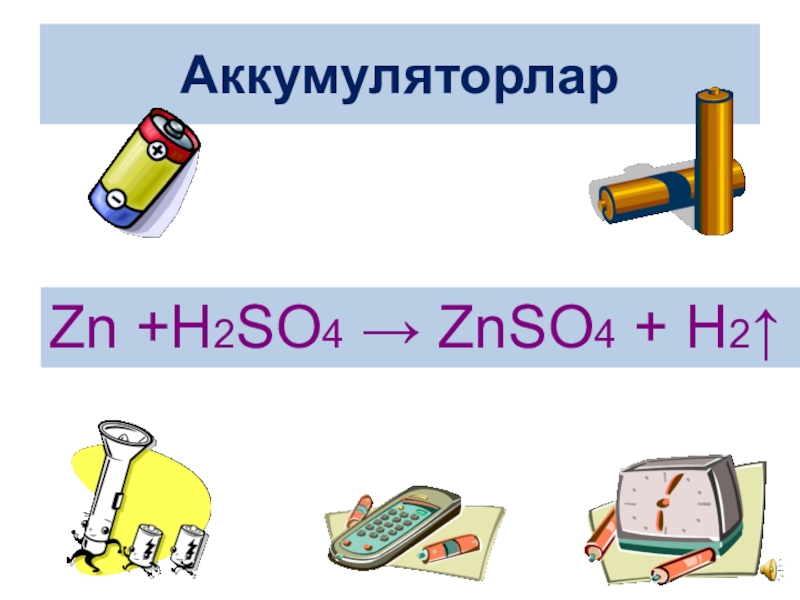
- 23. Аккумуляторлар Zn +H2SO4 → ZnSO4 + H2↑
- 24. Вулкан жанарғысындаS + O2 → SO2
- 25. Отынның жануы
- 26. Глюкозаның ашуыАшу цехыC6H12O6 → 2C2H5OH + 2CO2
- 27. Қопырылғыш заттар6P + 5KClO3 → 3P2O5 + 5KCl
- 28. Слайд 28
- 29. Тотығу – тотықсыздану реакциясын пайдаланып химия өнеркәсібінде,
- 30. Егер тотықтырғыш пен тотықсыздандырғыш кеңістіктерін бөліп, электрондарды
- 31. Екі құтыны ерітінді толтырылған түтікше арқылы жалғастырады.
- 32. Гальвани элементіZn0 + Cu+2SO4 = Zn+2SO4 +
- 33. Электроны өте көп артық мөлшерде болатын электрод
- 34. Гальвани элементіндегі катод теріс зарядталады. Тізбектің сыртқы
- 35. ФАРАДЕЙ (Faraday), Майкл22 қыркүйек 1791 ж –
- 36. Ғылымға үлесі 1820 ж. – магнетизмді
- 37. Ғылымға үлесі Фарадей электрохимияның негізін қалаушылардың
- 38. Фарадей заңыI –ампер бойынша ток күші;t
- 39. Электродты потенциалМеталл мен ерітінді арасында біршама потенциал
- 40. Электродты потенциалМеталдардың стандартты электродтық қатары олардың
- 41. Электродты потенциалСалыстырмалы электрод ретінде стандарт сутегі электроды
- 42. Металдардың электрохимиялық кернеу қатары ( металдардың
- 43. Стандартты электродты потенциал
- 44. Электролиз Электролит ерітіндісі немесе балқымасы арқылы электр тогын жібергенде жүретін тотығу - тотықсыздану реакциясы.Тоқ көзі
- 45. Электролизде катод теріс зарядталады, оған
- 46. Балқыма электролизі NaCl = Na+ + Cl-
- 47. Балқыма электролизі LiH = Li+ + H-К: Li+ +
- 48. Ерітінді электролизіК: 2Н2О + 2е =
- 49. KI ерітіндісінің электролизі Диссоциация: KI
- 50. CuCl2 ерітіндісінің электролизіДиссоциация: CuCl2 = Cu2+
- 51. NaCl ерітіндісінің электролизіДиссоциация:NaCl = Na+ +
- 52. CuSO4 ерітіндісінің электролизі Диссоциация: CuSO4
- 53. Zn(NO3)2 ерітіндісінің электролизіДиссоциация: Zn(NO3)2 = Zn2+
- 54. Мыстың электролиттік рафинирленуі Диссоциация: CuSO4 = Cu2+
- 55. Құрғақ элемент (батарейка)А: Zn + 4NH4+ –
- 56. 1,5 В кернеуі бар фонариктерде, радиоқабылдағыштарда,
- 57. Месопотамия аймағында қазба жұмысын жүргізген кезде жасы
- 58. Электрохимия терминдеріГальвани элементі –тотығу тотықсыздану
- 59. Жаттығу Сулы ерітінділер электролизында инертті
- 60. Жауабы:Сулы ерітінділер электролизында инертті
- 61. Жаттығу :Сулы ерітінділер электролизында инертті
- 62. Жаттығу :Сулы ерітінділер электролизында инертті
- 63. Есеп Электролит ерітіндісі арқылы 30 минут уақыт
- 64. Үй тапсырмасы 1. Кальций хлориді балқымасының
- 65. Пайдаланған әдебиеттер мен ақпарат көздері
Слайд 2Сабақтың мақсаты
Оқушылардың тотығу дәрежесі және тотығу-тотықсыздану реакция жайындағы білімдерін жүйелеу және
Слайд 3Тотығу – тотықсыздану реакциялары
Тотығу - тотықсыздану процесі ең кеңінен тараған және
Слайд 4Тотығу – тотықсыздану реакциялары
Олардың көмегімен сілті, қышқыл және
Слайд 5Тотығу – тотықсыздану реакциялары
20- шы ғасырдың басында ғана
Слайд 6Тотығу - тотықсыздану реакциялары (ТТР)-
– Химиялық реакцияларда әрекеттесуші заттардың құрамына
Слайд 7Тотығу дәрежесі
Жай заттардың құрамына кіретін элемент атомының тотығу дәрежесі нөльге тең.
Оттектің тотығу дәрежесі пероксидтер мен фтор қосылыстарынан басқа қосылыстарында -2 тең.
Қосылыстың құрамындағы барлық атомдардың тотығу дәрежесінің қосындысының жиынтығы нөльге тең.
Иондағы атомдардың тотығу дәрежесінің жиынтық қосындысы ион зарядына тең болады.
Mgº, Cl2º, O2º
+1 +1 -1
HCl, H2O, NaH
-2 -1 +2
H2O, Н2О2, OF2
+1 +6 -2
H2SO4
2(+1)+6+4(-2)=0
+6 -2
SO4
6+4(-2)=-2
Слайд 8Тотығу – тотықсыздану реакциясын танып білу
Реакция теңдеуіндегі барлық элементтердің тотығу дәрежесінің
Элемент атомының тотығу дәрежесі өзгеріске ұшырауын анықтаймыз.
+2 -2 +1 -1 +2 -1 +1 -2
PbO + 2HCl → PbCl2 + H2O
Тотығу дәрежесі өзгерімесе => реакция тотығу - тотықсыздану реакциясы болмайды
һ4 -2 +1 -1 +2 -1 0 +1 -2
PbO2 + 2HCl → PbCl2 + Cl2 + 2H2O
Тотығу дәрежесі өзгеретін болса > реакция тотығу - тотықсыздану реакциясы болып табылады
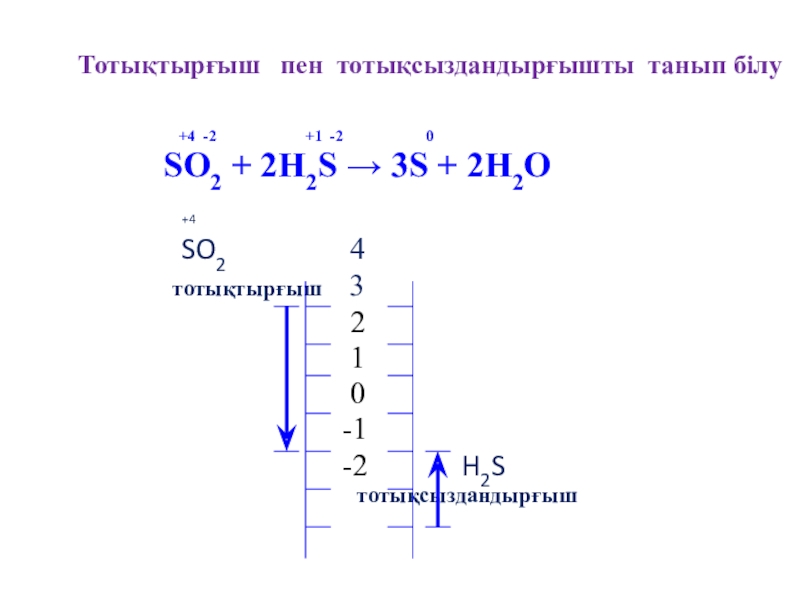
Слайд 9Тотықтырғыш пен тотықсыздандырғышты танып білу
SO2 + 2H2S → 3S + 2H2O
+4
SO2 4
тотықтырғыш 3
2
1
0
-1
-2 H2S
тотықсыздандырғыш
Слайд 10Электронды баланс әдісі
+4
SO2 + 2H2S → 3S + 2H2O
+4 0 +4 _ 0
S → S S +4 e → S 1
_
+4 → 0 e қосып алу – тотықсыздану
+4 +(-4)=0
-2 0 -2 _ 0
S → S S – 2 e → S 2
_
-2 → 0 e беру – тотығу
-2 - (-2)=0
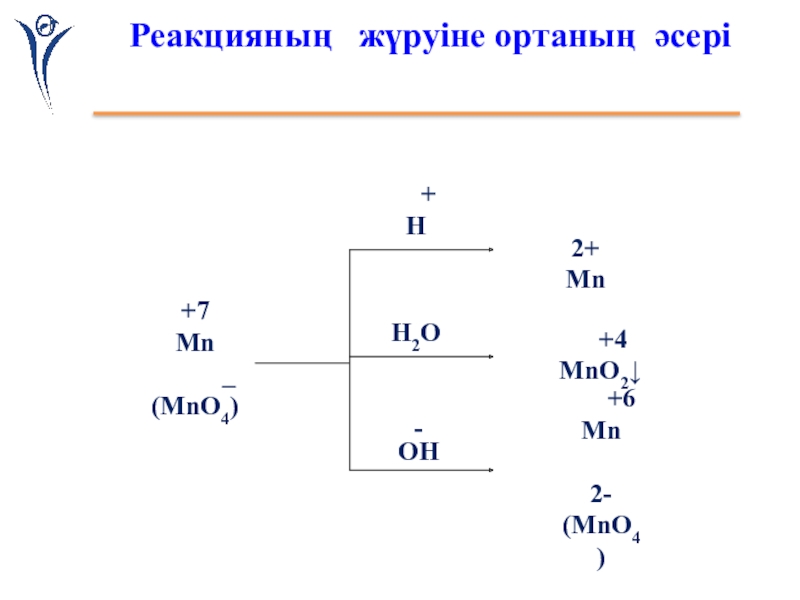
Слайд 12Реакцияның жүруіне ортаның әсері
Қышқылды ортада:
2KMnO4 + 5Na2SO3+3H2SO4=
+ 5 Na2SO4 + 3H2O + K2SO4
2 Mn+7 + 5e- = Mn+2
5 S+4 -2e- = S+6
Слайд 13Реакцияның жүруіне ортаның әсері
Бейтарап ортада:
2KMnO4 + 3Na2SO3+H2O=
2 Mn+7 +3e- =Mn+4
3 S+4 -2e- = S+6
Слайд 14Реакцияның жүруіне ортаның әсері
Сілтілік ортада:
2KMnO4 + Na2SO3+2KOH=
+ H2O
2 Mn+7 + e- =Mn+6
3 S+4 -2e- = S+6
Слайд 15Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Mn тотығу дәрежесі сілтілік ортада
+7 ден +6 дейін өзгереді
FeSO4 сілтілік ортада Fe(OH)3 өзгереді
FeSO4+KMnO4+3KOH→ Fe(OH)3 +K2SO4+K2MnO4
FeSO4 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 16Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Mn тотығу дәрежесі қышқылдық ортада
+7 ден + 2 дейін өзгереді
FeSO4 қышқылдық ортада Fe2 (SO4)3 өзгереді
10FeSO4+2KMnO4+ 8H2SO4→ 5Fe2 (SO4)3 +K2SO4+ 2MnSO4 + 8H2O
FeSO4 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 17Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Mn тотығу дәрежесі қышқылдық ортада
+7 ден + 2 дейін өзгереді
FeSO4 қышқылдық ортада Fe2 (SO4)3 өзгереді
10FeSO4+2KMnO4+ 8H2SO4→ 5Fe2 (SO4)3 +K2SO4+ 2MnSO4 + 8H2O
FeSO4 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 18Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
Fe(OH)2+KMnO4+ H2O…→…+KOH + MnO2
Mn тотығу
+7 ден + 4 дейін өзгереді
Fe(OH)2 бейтарап ортада Fe (OН)3 өзгереді
6Fe(OH)2+2 KMnO4+ 4 H2O → 6Fe (OH)3 + 2KOH + 2MnO2
Fe(OH)2 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 29
Тотығу – тотықсыздану реакциясын пайдаланып
химия өнеркәсібінде, техникада маңызды заттар
–
Осы реакциялар көмегімен химиялық энергия электр энергиясына айналады. Химиялық процестер кезінде электр тоғы түзілетін болса, ондай процестерді электрохимиялық дейді. Электрохимиялық процестерге гальвани элементтерінде, электролиз, металдар коррозиясы кезінде жүретін тотығу – тотықсыздану реакциялары жатады.
Электрохимия
Слайд 30Егер тотықтырғыш пен тотықсыздандырғыш кеңістіктерін бөліп, электрондарды металл өткізгіш бойымен жүргізетін
Электрохимия
Слайд 31Екі құтыны ерітінді толтырылған түтікше арқылы жалғастырады. Мырыш пен мыс пластинкалары
Zn0 – 2e = Zn 2+ (тотығу – (анод процесі)
Мырыштан бөлінген электрондар металл өткізгіш бойымен мыс арқылы CuSO4 - ке беріліп, мыс тотықсызданады:
Cu2+ + 2 e = Cu 0 (тотықсыздану процесі – ( катод процесі)
Электрохимия
Слайд 32
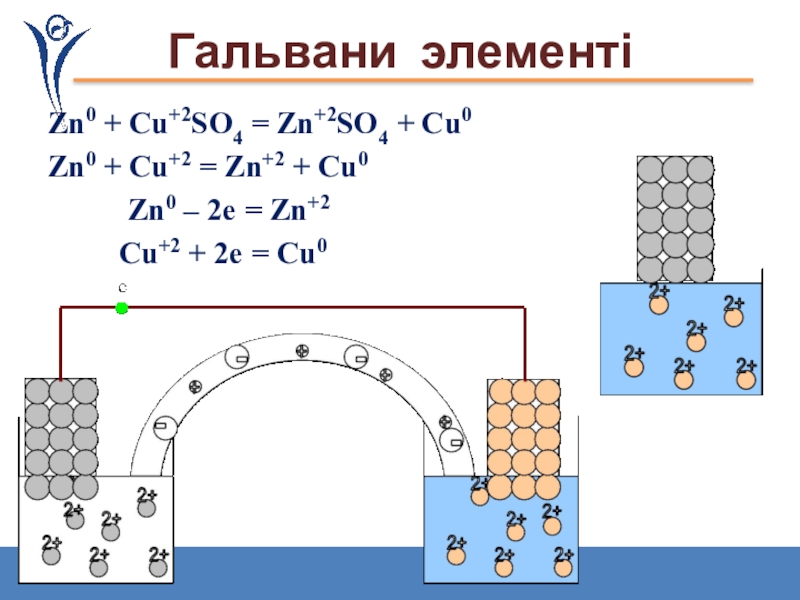
Гальвани элементі
Zn0 + Cu+2SO4 = Zn+2SO4 + Cu0
Zn0 + Cu+2 =
Zn0 – 2е = Zn+2
Cu+2 + 2е = Cu0
Слайд 33Электроны өте көп артық мөлшерде болатын электрод гальвани элементінің теріс полюсі,
Гальвани элементінің теріс полюсі дегеніміз артық мөлшерде электроны анағұрлым көп, өте белсенді металл болып табылады.
Электрохимия
Слайд 34Гальвани элементіндегі катод теріс зарядталады. Тізбектің сыртқы бөлігіндегі электрондар (металдар бойынша
Электрохимия
Слайд 35
ФАРАДЕЙ (Faraday), Майкл
22 қыркүйек 1791 ж –
25 Тамыз 1867 ж
Ағылшын физигі Майкл Фарадей Лондонда металл өңдеушінің жанұясында өмірге келді. Бастауыш мектепті бітірген соң, ол он екі жасынан бастап газет тасушы болып жұмыс істеді. 1804 ж француз эмигранты Рибоның түптеушісі ретінде жұмысқа қабылданды. Ол жастайынан білімге өте құштар болып, өздігінен білім алды. Бір досы Король институтының профессоры Гемфрид Дэвидің лекциясын тыңдауға шақыру билетін алып берді. Бұл лекция білімге құштар жасөспірімнің тағдырына үлкен әсер етті. Дэвидің хаттарына жауап бере отыра, Фарадей Король институтында Дэвидің шәкірті болып қабылданды.
Слайд 36
Ғылымға үлесі
1820 ж. – магнетизмді зерттеді.
1821 ж. –
1831 ж. – тәжірибе арқылы электр күштерін, индуктивті электр тоғын зерттеді.
1832 ж. – химиялық және электрохимиялық құбылыстар арасындағы байланысты зерттеді.
Слайд 37
Ғылымға үлесі
Фарадей электрохимияның негізін қалаушылардың бірі болып табылады.
«Электролит»,
1837 ж. – индукция құбылысын ашты. 1845 ж. – тоқтың әсерінен электрленген сұйықтыққа полярланған жарықтың әсерін түсіндірді.
1855 ж. –кристалл формаларының және температураның магниттік құбылыстарға тәуелділігін анықтап көрсетті.
Слайд 38 Фарадей заңы
I –ампер бойынша ток күші;
t – уақыт процесте секунд
F – Фарадей саны = 96500 Кл/моль;
Э - эквиваленттік масса;
m= Э I t / F
Слайд 39Электродты потенциал
Металл мен ерітінді арасында біршама потенциал айырмасы түзіледі. Металл иондарының
Ме ↔ Mеn+ + ne
Мұнда, n – металдың заряды.
Тепе – теңдік орнаған кездегі металл мен оны қоршаған ерітінді арасында пайда болған потенциалдар айырмасын электродтық потенциал дейді.
Слайд 40Электродты потенциал
Металдардың стандартты электродтық қатары олардың химиялық қасиетін көрсетеді. Металдың
Слайд 41Электродты потенциал
Салыстырмалы электрод ретінде стандарт сутегі электроды қолданылады. Осы сутегі электродына
Слайд 42Металдардың электрохимиялық кернеу қатары
( металдардың белсенділік қатары )
- Е0 металдарда
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
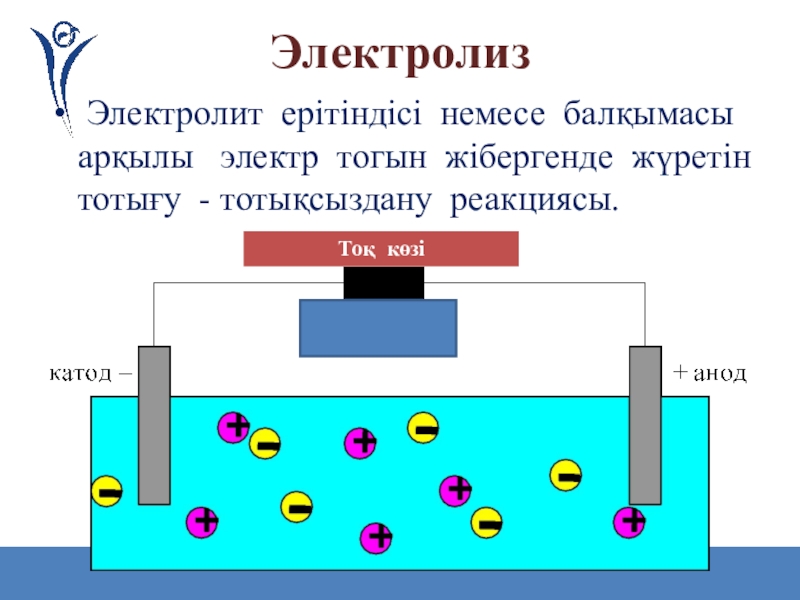
Слайд 44
Электролиз
Электролит ерітіндісі немесе балқымасы арқылы электр тогын жібергенде жүретін
Тоқ көзі
Слайд 45
Электролизде катод теріс зарядталады, оған қарай катиондар қозғалып, сол
Электролиз процесі – эндотермиялық процесс, себебі ол электр энергиясы арқылы жүзеге асады.
Электролиз
Слайд 46
Балқыма электролизі
NaCl = Na+ + Cl-
К-: Na+ +
А+: 2Cl- - 2e = Cl2 ⏐⋅1
Процестер жиынтығы:
2Na+ + 2Cl- = 2Na0+ Cl2
Слайд 47
Балқыма электролизі
LiH = Li+ + H-
К: Li+ + e = Li ⏐⋅2
А: 2H- -
Процестер жиынтығы: 2Li+ + 2H- = 2Li + H2
Жиынтық теңдеуі: 2LiH = 2Li + H2
Rb2CO3 = 2Rb+ + CO32-
К: Rb+ + e = Rb ⏐4
А: 2CO32- - 4e = 2CO2 + O2 ⏐1
Процестер жиынтығы: 4Rb+ + 2CO32- = 4Rb + 2CO2 + O2
Жиынтық теңдеуі: 2Rb2CO3 = 4Rb + 2CO2 + O2
Слайд 48
Ерітінді электролизі
К: 2Н2О + 2е = Н2↑ + 2ОН-
Мn+ +
А: 2Н2О – 4е = О2↑ + 4Н+
Anm- – me = An
СuCl2 NaCl СuSO4 KI Zn(NO3)2
Слайд 49 KI ерітіндісінің электролизі
Диссоциация: KI ↔ K+ + I-
Катод: 2Н2О
Анод: 2l- - 2e = l2
электролиз: 2KI + 2Н2О = H2 + 2KOH + + I2
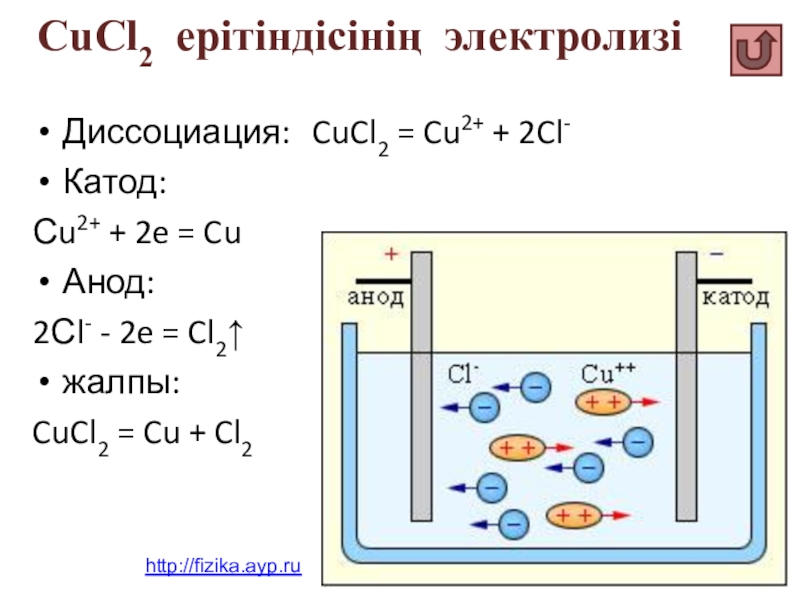
Слайд 50CuCl2 ерітіндісінің электролизі
Диссоциация: CuCl2 = Cu2+ + 2Cl-
Катод:
Сu2+ +
Анод:
2Сl- - 2e = Cl2↑
жалпы:
CuCl2 = Cu + Cl2
http://fizika.ayp.ru
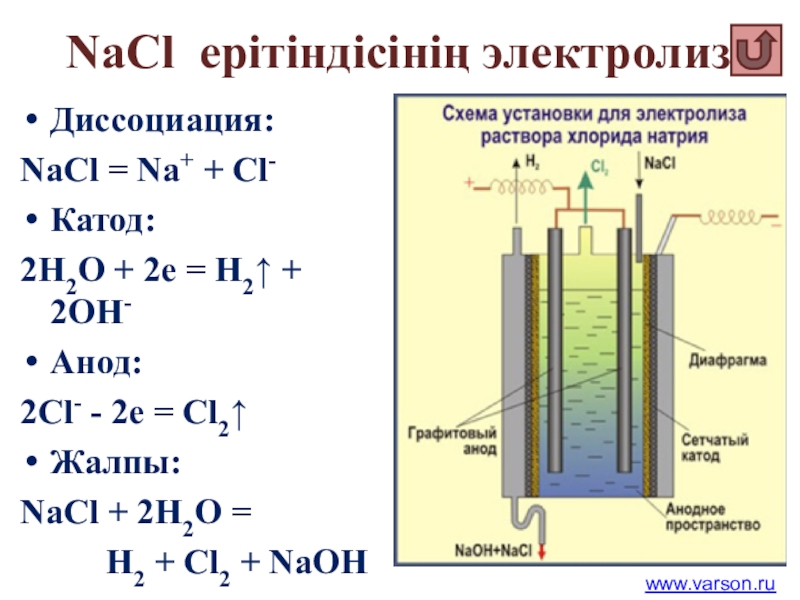
Слайд 51 NaCl ерітіндісінің электролизі
Диссоциация:
NaCl = Na+ + Cl-
Катод:
2Н2О + 2е =
Анод:
2Сl- - 2e = Cl2↑
Жалпы:
NaCl + 2H2O =
H2 + Cl2 + NaOH
www.varson.ru
Слайд 52 CuSO4 ерітіндісінің электролизі
Диссоциация: CuSO4 ↔ Cu2+ + SO42-
Катод: Cu2+
Анод: 2Н2О – 4е = О2↑ + 4Н+ ⏐1
электролиз: 2CuSO4 + 2Н2О = 2Cu0 + О2↑ + 2H2SO4
Слайд 53 Zn(NO3)2 ерітіндісінің электролизі
Диссоциация: Zn(NO3)2 = Zn2+ + 2NO3-
Катод: 2Н2О + 2е
Анод: 2Н2О – 4е = О2↑ + 4Н+ ⏐1
жиыны: 6H2O = О2↑ + 2H2↑ + 4OH- + 4Н+ 4Н2О
жалпы : 2H2O 2H2↑ + О2↑
Катод: Zn2+ + 2e = Zn ⏐2
Анод: 2Н2О – 4е = О2↑ + 4Н+ ⏐1
жиыны : 2Zn2+ + 2H2O = 2Zn + О2↑ + 4Н+
жалпы : 2Zn(NO3)2 + 2H2O = 2Zn + О2↑ + 4HNO3
Zn(NO3)2 + 2H2O = Zn + H2 + O2 + 2HNO3 !!!
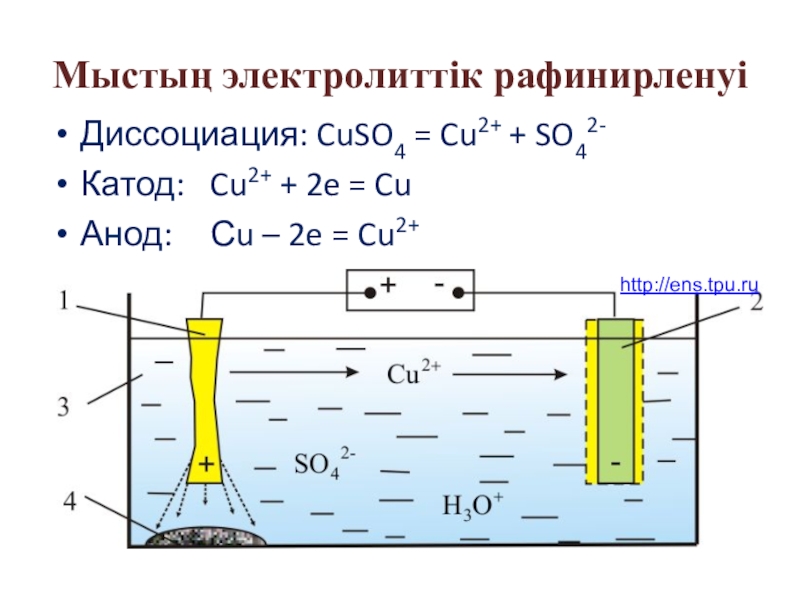
Слайд 54Мыстың электролиттік рафинирленуі
Диссоциация: CuSO4 = Cu2+ + SO42-
Катод: Cu2+ + 2e
Анод: Сu – 2e = Cu2+
http://ens.tpu.ru
Слайд 55Құрғақ элемент (батарейка)
А: Zn + 4NH4+ – 2e = [Zn(NH3)4]2+ +
К: MnO2 + H+ + e = MnOOH
Zn + 4NH4Cl + 2MnO2 = [Zn(NH3)4]Cl2 + 2MnOOH + 2HCl
U = 1,5 В
Электролит – ылғал паста MnO2, және NH4Cl, көмір
Катод – графит (стержень) немесе MnO2
Анод – Zn (батарейканың сыртқы
қабығы)
Слайд 561,5 В кернеуі бар фонариктерде, радиоқабылдағыштарда, балалар ойыншығында, будильникте т.б.
Слайд 57
Месопотамия аймағында қазба жұмысын жүргізген кезде жасы 2200 жыл болатын
Слайд 58
Электрохимия терминдері
Гальвани элементі –тотығу тотықсыздану реакцияларында химиялық энергияны
Электрод – бұл тотығу н/е тотықсыздану жүретін металдан немесе графиттен жасалған (көбінесе стержень н/е пластиналар ).
Катод – тотықсыздану жүретін электрод.
Анод – тотығу процесі жүретін электрод.
Слайд 59Жаттығу
Сулы ерітінділер электролизында инертті электродтарды қолданған
Заттың формуласы Анодтағы өнімдер
А) NaCl 1) Cl2
B) NaClO4 2) Cl2 , O2
C) NaOH 3) O2
D) NaBr 4) H2 , Br2
5) O2, Br2
6) Br2
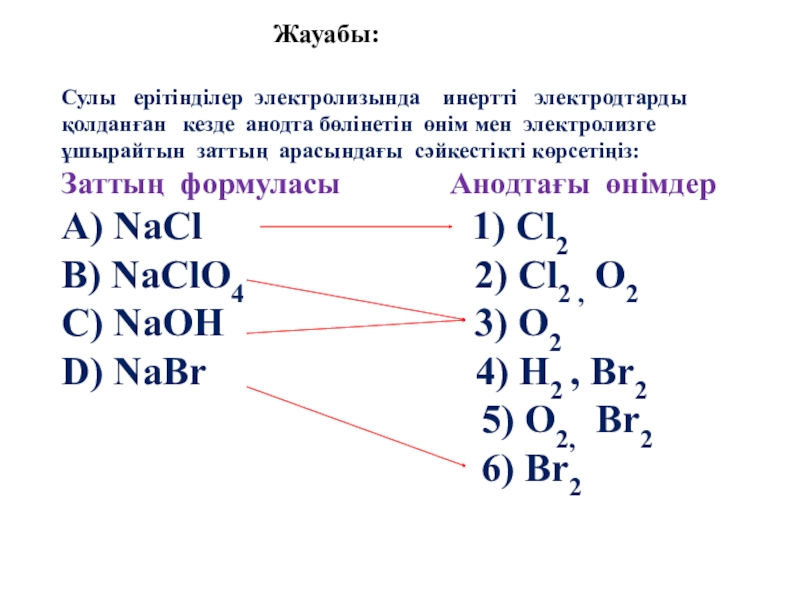
Слайд 60Жауабы:
Сулы ерітінділер электролизында инертті электродтарды қолданған кезде
Заттың формуласы Анодтағы өнімдер
А) NaCl 1) Cl2
B) NaClO4 2) Cl2 , O2
C) NaOH 3) O2
D) NaBr 4) H2 , Br2
5) O2, Br2
6) Br2
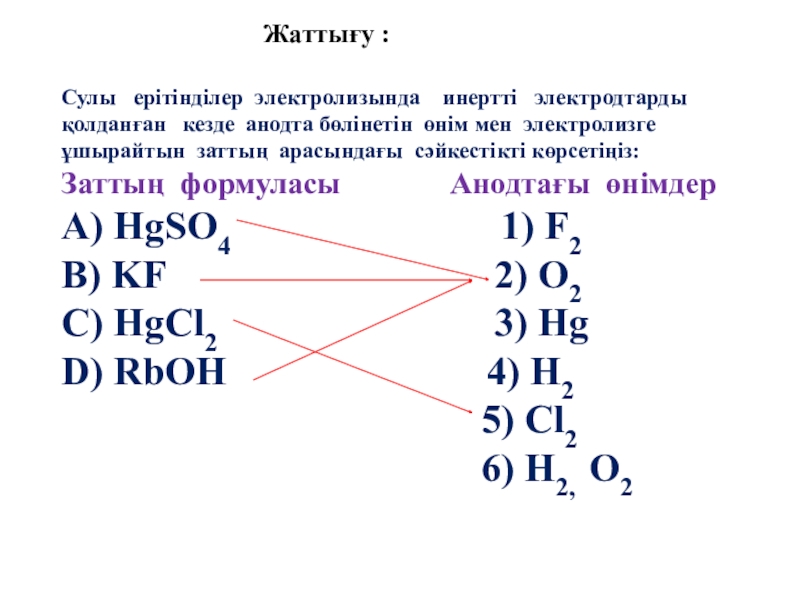
Слайд 61Жаттығу :
Сулы ерітінділер электролизында инертті электродтарды қолданған
Заттың формуласы Анодтағы өнімдер
А) HgSO4 1) F2
B) KF 2) O2
C) HgCl2 3) Hg
D) RbOH 4) H2
5) Cl2
6) H2, O2
Слайд 62Жаттығу :
Сулы ерітінділер электролизында инертті электродтарды қолданған
Заттың формуласы Анодтағы өнімдер
А) HgSO4 1) F2
B) KF 2) O2
C) HgCl2 3) Hg
D) RbOH 4) H2
5) Cl2
6) H2, O2
Слайд 63Есеп
Электролит ерітіндісі арқылы 30 минут уақыт бойы
2,5 A тоқ
Шешуі:
m=2,77 г, I = 2,5 A, t= 30 мин = 1800 сек
Э = m F / (It) = 2,77 * 96500 / (2,5 * 1800) = 59,4 г / моль
Слайд 64Үй тапсырмасы
1. Кальций хлориді балқымасының электролизі теңдеуін
2. Темірдің (ІІ) хлориді ерітіндісінің электролизі теңдеуін жазып, катод пен анодта бөлінетін өнімдерді көрсетіңіз.
3. Электронды баланс әдісін қолданып реакция теңдеуін аяқтаңыз.
Есеп
Күміс нитратының электролит ерітіндісі арқылы 30 минут уақыт бойы 6 A тоқ күшін жұмсаған кезде ерітіндіден бөлініп шыққан металл күмістің массасын анықтаңыз.
Слайд 65Пайдаланған әдебиеттер мен ақпарат көздері
1. Габриелян О.С. Химия: пособие для
2. Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.: ООО «Издательство АСТ», 2000
3. Новошинский И.И., Новошинская Н.С. Переходные металлы. – Краснодар: «Советская Кубань», 2006
4.http://www1.ege.edu.ru/
5. httphttp://http://wwwhttp://www.http://www.ithttp://www.it-http://www.it-nhttp://www.it-n.http://www.it-n.ru (сообщества «Химоза» и «Подготовка к ЕГЭ по химии»)
Н.Л. Глинка. Задачи и упражнения Общей химии
Ленинград * «Химия» 1980













































![Презентация Тотығу - тотықсыздану реакциясы Құрғақ элемент (батарейка)А: Zn + 4NH4+ – 2e = [Zn(NH3)4]2+ + Құрғақ элемент (батарейка)А: Zn + 4NH4+ – 2e = [Zn(NH3)4]2+ + 4H+К: MnO2 + H+ + e =](/img/thumbs/5f7cd85d715fd795c3c1d3f38847c21f-800x.jpg)