- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Типы химических реакций
Содержание
- 1. Презентация Типы химических реакций
- 2. ЦЕЛЬ: сформировать представление о типах химических реакций,
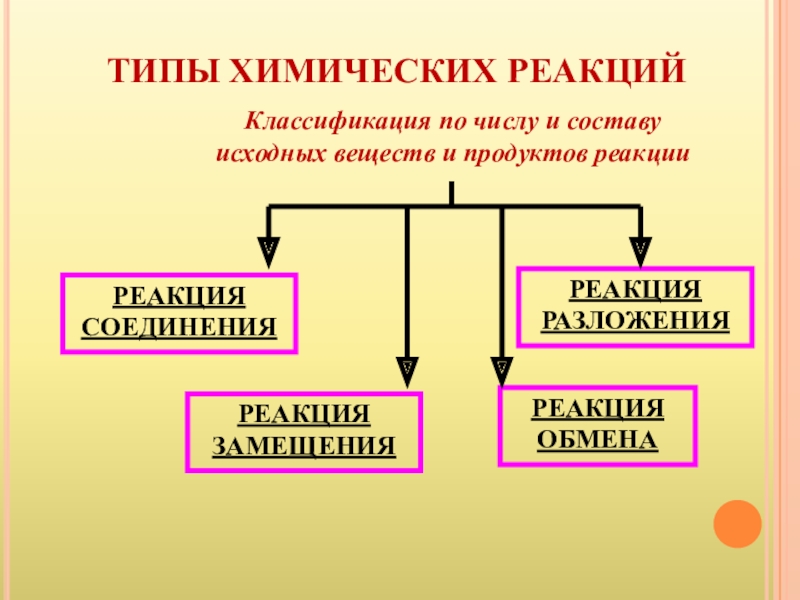
- 3. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙРЕАКЦИЯ СОЕДИНЕНИЯРЕАКЦИЯ РАЗЛОЖЕНИЯРЕАКЦИЯ ЗАМЕЩЕНИЯРЕАКЦИЯ ОБМЕНАКлассификация по числу и составу исходных веществ и продуктов реакции
- 4. Реакции соединения – это реакции,
- 5. ПРИМЕРЫуравнений реакций соединения:2Fe + O2 = 2FeOCaO + H2O = Ca(OH)2
- 6. CaO + CO2 = CaCO3CuO + H2 = Cu + H2O2Al + 3Cl2 = 2AlCl3
- 7. РЕАКЦИИ РАЗЛОЖЕНИЯ Реакции разложения – это
- 8. Продуктами реакции могут быть как простые, так
- 9. H23NH3 = N2 +2H2O =
- 10. РЕАКЦИИ ЗАМЕЩЕНИЯ Реакции между простым
- 11. K + Cl2 = KClMg+ HCl= MgCl2
- 12. Mg(OH)2 + H2SO4 =MgSO4 + 2H2O CuCl2+2NaOH=Cu(OH)2↓+2NaClРЕАКЦИИ ОБМЕНА
- 13. KOH + HNO3 →CuO + HCl →Na3PO4 + CaCl2 →Fe(OH)3 + H2SO4 →
- 14. Составьте уравнения реакций по схемам:HCl+AgNO3=AgCl+HNO3Fe(OH)2=FeO
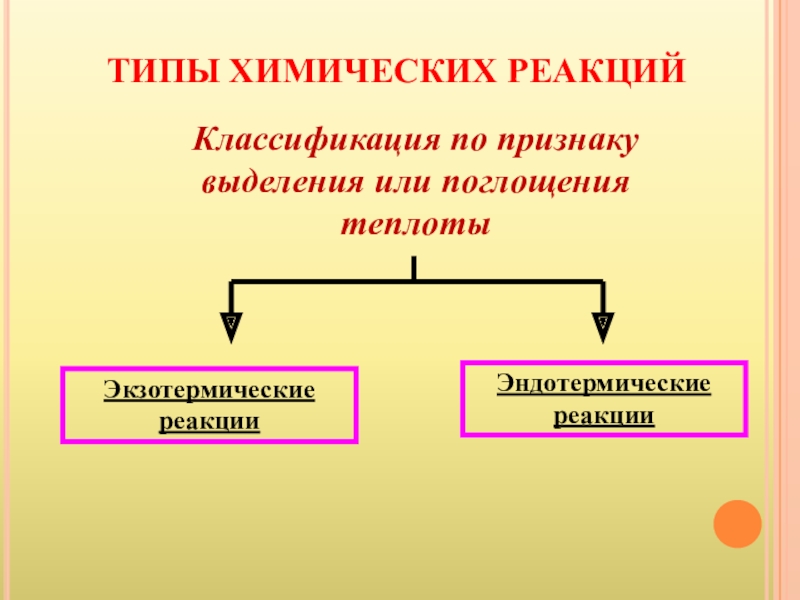
- 15. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙЭкзотермические реакцииЭндотермические реакцииКлассификация по признаку выделения или поглощения теплоты
- 16. ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ Реакции, которые протекают
- 17. H2↑ + Cl2 HClCaCO3 t CaO+ CO2↑Fe(OH)3 t Fe2O3+ H2OCO+ O2 CO2222322
- 18. Составьте уравнения реакций по схемам:2Ca
- 19. 2H2O2 = 2H2O + O2CuSO4 + Fe
- 20. 2H2O2 = 2H2O + O2CuSO4 + Fe
- 21. CaO + CO2 = CaCO3ZnO + H2SO4
Слайд 2ЦЕЛЬ: сформировать представление о типах химических реакций, научить распознавать тип химической
Слайд 3ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
РЕАКЦИЯ СОЕДИНЕНИЯ
РЕАКЦИЯ РАЗЛОЖЕНИЯ
РЕАКЦИЯ ЗАМЕЩЕНИЯ
РЕАКЦИЯ ОБМЕНА
Классификация по числу и составу
Слайд 4 Реакции соединения – это реакции, в результате которых из
2Ca + O2 = 2CaO
MgO + CO2 = MgCO3
РЕАКЦИИ СОЕДИНЕНИЯ
Слайд 7РЕАКЦИИ РАЗЛОЖЕНИЯ
Реакции разложения – это реакции, в результате которых
MgCO3 = MgO+CO2
Fe (ОН)3= Fe2О3 + Н2О
Слайд 8Продуктами реакции могут быть как простые, так и сложные вещества.
CaCO3
HgO = Hg +O2↑
2
2
Слайд 10
РЕАКЦИИ ЗАМЕЩЕНИЯ
Реакции между простым и сложным веществом, при
Fe + CuSO4 = Cu + FeSO4
Zn + 2HCl =ZnCl2 + H2↑
Слайд 11K + Cl2 = KCl
Mg+ HCl= MgCl2 + H2↑
Na2O + P2O5=
Fe(OH)3 = Fe2O3+ H2O
Fe2O3+ Mg= MgO+ Fe
3
2
2
2
2
3
2
3
3
2
Слайд 12 Mg(OH)2 + H2SO4 =MgSO4 + 2H2O
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
РЕАКЦИИ ОБМЕНА
Реакции обмена - это
ZnO + H2SO4 = ZnSO4 + H2O
Слайд 14 Составьте уравнения реакций по схемам:
HCl+AgNO3=AgCl+HNO3
Fe(OH)2=FeO + H2O
H2 + СиO
2Al+6HCl=2AlCl3+3H2↑
Соляная кислота+нитрат серебра→хлорид серебра+азотная кислота
Гидроксид железа (II) → оксид железа (II) + вода
Водород + оксид меди → медь + вода
Алюминий + соляная кислота → хлорид алюминия+водород
Слайд 15ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Экзотермические реакции
Эндотермические реакции
Классификация по признаку выделения или поглощения теплоты
Слайд 16ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ
Реакции, которые протекают с выделением теплоты, называют
H2(г.) + Cl2(г.) = 2HCl (г.) + Q
Эндотермические реакции
Реакции, которые протекают с поглощением теплоты, называют эндотермическими
N2(г.) + O2(г.) = 2NO (г.) - Q
Слайд 18 Составьте уравнения реакций по схемам:
2Ca + O2 = 2CaO
Mg+H2SO4=MgSO4+H2↑
Cu(OH)2=CuO
H2 + CuO = Cu + H2O
2Fe+3H2SO4=Fe2(SO4)3+3H2↑
Кальций + кислород → оксид кальция
Магний + серная кислота → сульфат магния + водород
Гидроксид меди (II) → оксид меди (II) + вода
Водород + оксид меди (II) → медь + вода
Железо (III)+серная кислота→сульфат железа (III)+водород
Слайд 192H2O2 = 2H2O + O2
CuSO4 + Fe = Cu + FeSO4
MgO
Cu(NO3)2+Fe = Cu +Fe(NO3)2
H2SO4+2KOH = K2SO4+2H2O
2K + H2SO4 = K2SO4+H2↑
CaCO3 = CaO + CO2
Слайд 202H2O2 = 2H2O + O2
CuSO4 + Fe = Cu + FeSO4
BaO
2HgO = 2Hg + O2
H2SO4 + 2KOH = K2SO4+2H2O
2H2 + O2 = 2H2O
CaCO3 = CaO + CO2
Слайд 21CaO + CO2 = CaCO3
ZnO + H2SO4 = ZnSO4 + H2O
Fe
2H2O = 2H2 + O2
CuO + H2 = Cu + H2O
СuO + 2HCl = CuCl2 + H2O
Cu(OH)2 = CuO + H2O
BaCl2+Na2SO4=BaSO4+2NaCl