- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Теория электролитической диссоциации
Содержание
- 1. Презентация Теория электролитической диссоциации
- 2. Электролитическая диссоциация - процесс распада электролита на ионы при растворении в воде или расплавлении.
- 3. В разработке основных положений ТЭД участвовали следующие
- 4. Слайд 4
- 5. Слайд 5
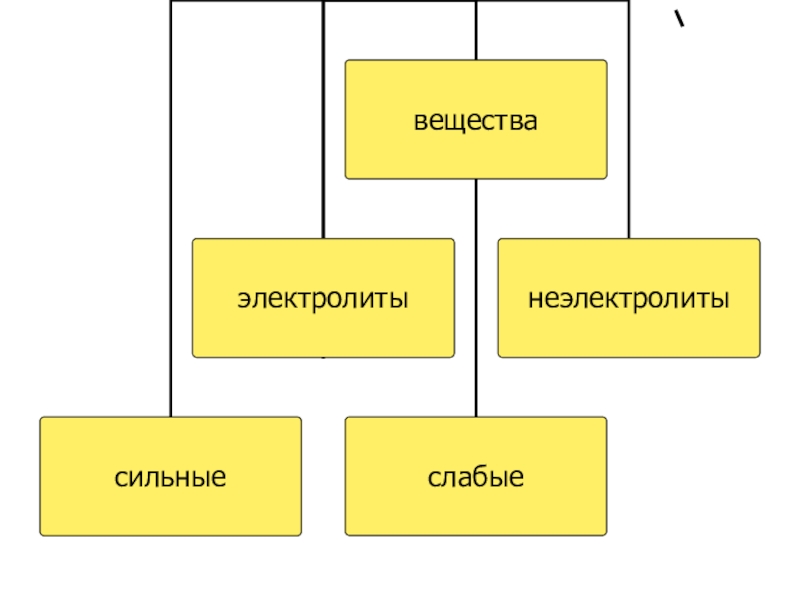
- 6. Электролиты – вещества, растворы или расплавы которых проводят электрический ток.К ним относятся: расворимыеСолиКислотыОснования
- 7. Степень электролитической диссоциации – отношение числа распавшихся молекул к общему числу растворенных молекул.
- 8. К слабым электролитам относятся:водаH2S, H2SO3, H2CO3, H3PO4;Органические кислоты.Все остальные кислоты – сильные электролиты.
- 9. Неэлектролиты – вещества, растворы которых
- 10. Основные положения теории электролитической диссоциации.
- 11. I Положение: при растворении
- 12. II Положение: под действием электрического тока положительнозаряженные
- 13. III Положение: причиной диссоциации электролита в
- 14. IV. Положение: Электролитическая диссоциация –
- 15. V. Положение: Не все
- 16. VI положение: Химические свойства растворов электролитов
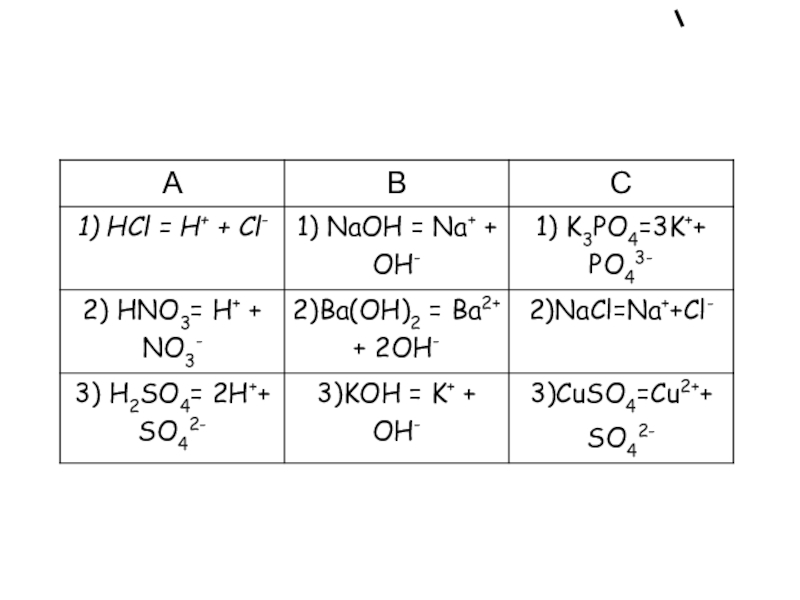
- 17. Запишите уравнения диссоциации кислот, солей, оснований
- 18. Слайд 18
- 19. ПРОВЕРЬ СВОИ ЗНАНИЯ Пользуясь таблицей растворимости,
- 20. Открываем дневники и записываем домашнее задание §
Электролитическая диссоциация - процесс распада электролита на ионы при растворении в воде или расплавлении.
Слайд 2 Электролитическая диссоциация - процесс распада электролита на ионы при растворении в
воде или расплавлении.
Слайд 3
В разработке основных положений ТЭД участвовали следующие ученые:
С. Аррениус,
И. А.
Каблуков,
В. А. Кистяковский,
Д. И. Менделеев.
В. А. Кистяковский,
Д. И. Менделеев.
Слайд 6
Электролиты – вещества, растворы или расплавы которых проводят электрический
ток.
К ним относятся: расворимые
Соли
Кислоты
Основания
К ним относятся: расворимые
Соли
Кислоты
Основания
Слайд 7
Степень электролитической диссоциации – отношение числа распавшихся молекул к
общему числу растворенных молекул.
Слайд 8
К слабым электролитам относятся:вода
H2S, H2SO3, H2CO3, H3PO4;
Органические кислоты.
Все остальные кислоты –
сильные электролиты.
Слайд 9
Неэлектролиты – вещества, растворы которых не проводят электрический ток.
К
ним относятся:органические в-ва,
Сахар, глюкоза
газы и др.
Сахар, глюкоза
газы и др.
Слайд 11 I Положение: при растворении в воде электролиты диссоциируют на положительные и
отрицательные ионы.
электролит—> КАТИОНЫ + АНИОНЫ
КАТИОНЫ – положительнозаряженные ионы (Na+,Cu 2+, NH4+)
АНИОНЫ - отрицательнозаряженные ионы (Cl-, SO42-, NO3-)
Слайд 12II Положение: под действием электрического тока положительнозаряженные ионы двигаются к катоду,
а отрицательнозаряженные к аноду.
катионы(+)?катод (-)
анионы(-) ?анод (+)
Слайд 13III Положение:
причиной диссоциации электролита в водных растворах является
его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической в нем.
В краткой форме:
NaCl ?Na+ + Cl-
HCl? H+ + Cl-
В краткой форме:
NaCl ?Na+ + Cl-
HCl? H+ + Cl-
Слайд 14IV. Положение:
Электролитическая диссоциация – процесс обратимый для слабых электролитов.
HNO2 <—> H+ + NO2-
Слайд 15V. Положение:
Не все электролиты в одинаковой мере диссоциируют
на ионы.
Какая количественная величина характеризует диссоциацию веществ?
Факторы влияющие на степень диссоциации:
природа электролита;
температура;
концентрация вещества.
Какая количественная величина характеризует диссоциацию веществ?
Факторы влияющие на степень диссоциации:
природа электролита;
температура;
концентрация вещества.
Слайд 16VI положение:
Химические свойства растворов электролитов определяются свойствами тех ионов,
которые они образуют при диссоциации
Слайд 19ПРОВЕРЬ СВОИ ЗНАНИЯ
Пользуясь таблицей растворимости, приведите примеры трех веществ,
которые в растворах образуют сульфат-ионы. Запишите уравнения электролитической диссоциации этих веществ.
Слайд 20Открываем дневники и записываем домашнее задание
§ 1-3, положения ТЭД выучить
наизусть;
Определения выучить наизусть;
Задание №3,4,5 страница 23 (письменно).
Определения выучить наизусть;
Задание №3,4,5 страница 23 (письменно).