- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад строение органических соединений. Особенности строения атома углерода
Содержание
- 1. Презентация строение органических соединений. Особенности строения атома углерода
- 2. Изомерия (от др.-греч. ἴσος — «равный», и
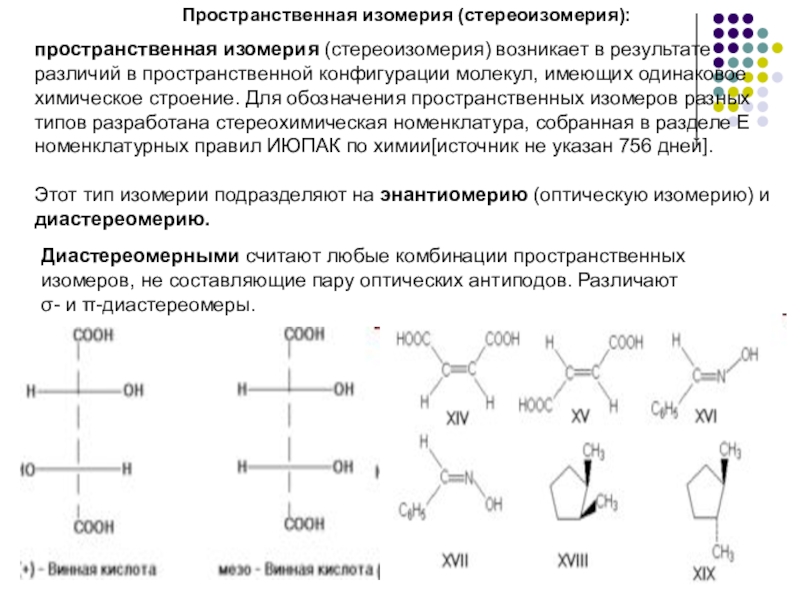
- 3. Пространственная изомерия (стереоизомерия):пространственная изомерия (стереоизомерия) возникает в
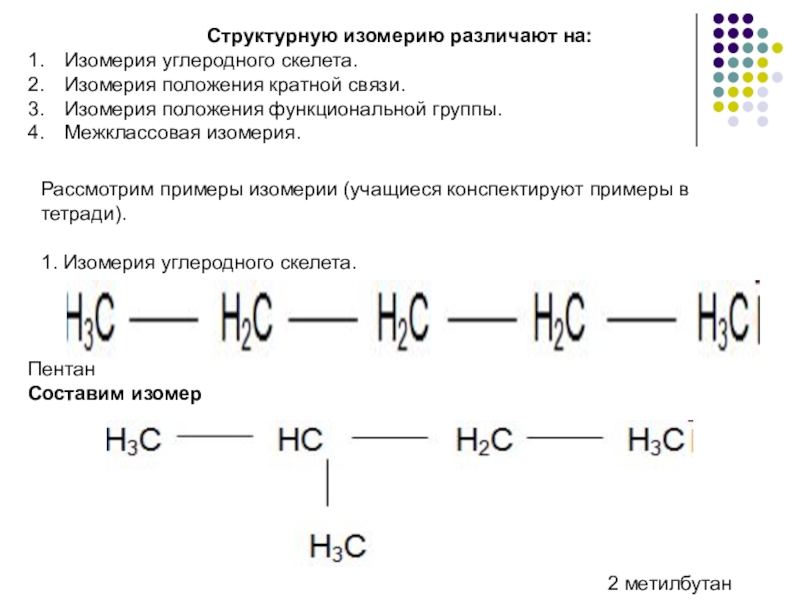
- 4. Структурную изомерию различают на:Изомерия углеродного скелета.Изомерия положения
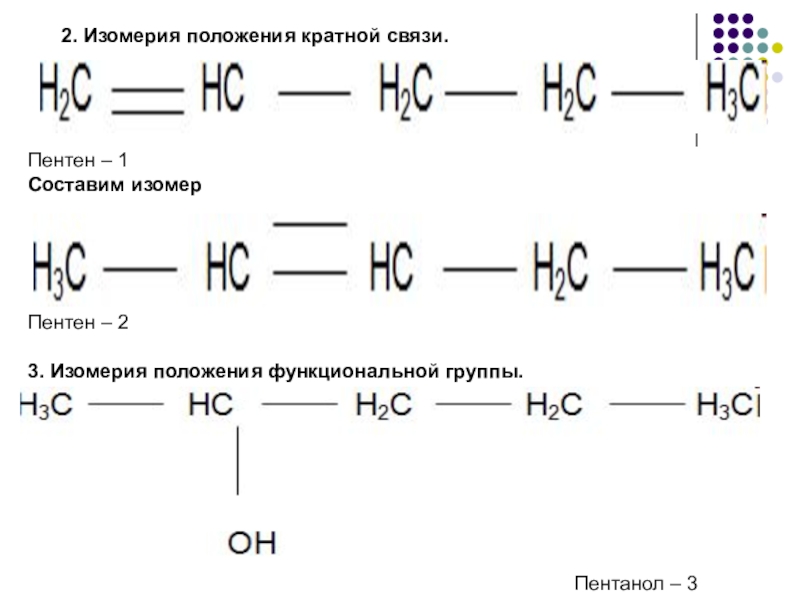
- 5. 2. Изомерия положения кратной связи.Пентен – 1Составим
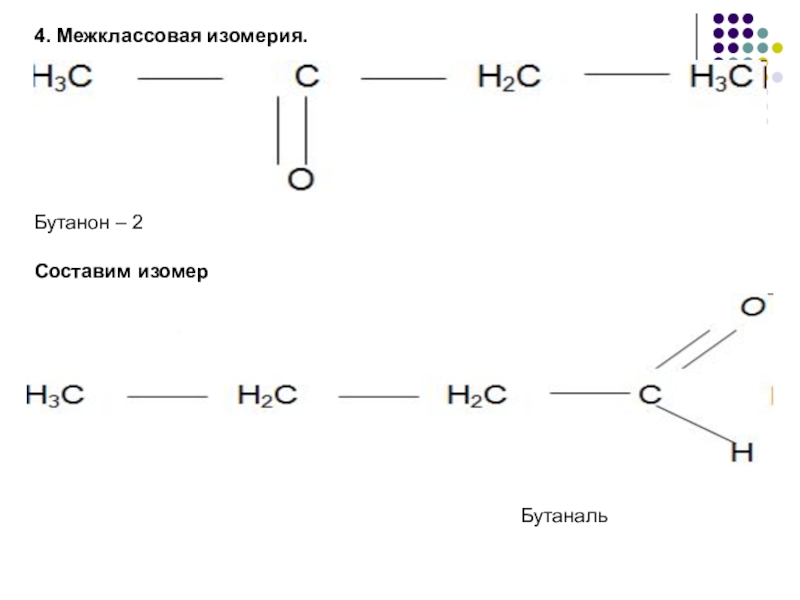
- 6. 4. Межклассовая изомерия.Бутанон – 2Составим изомерБутаналь
- 7. Пространственная изомерия подразделяется на:Геометрическая изомерия.Оптическая изомерия.Рассмотрим примеры
- 8. Бутен-2 (транс-изомер)2. Оптическая изомерия.Явление изомерии возникает, если
- 9. Электронные эффекты - смещение электронной плотности в
- 10. Таким образом, заместители (X или Y) вызывают
- 11. –I-эффект проявляют заместители, которые содержат более электроотрицательные
- 12. Слайд 12
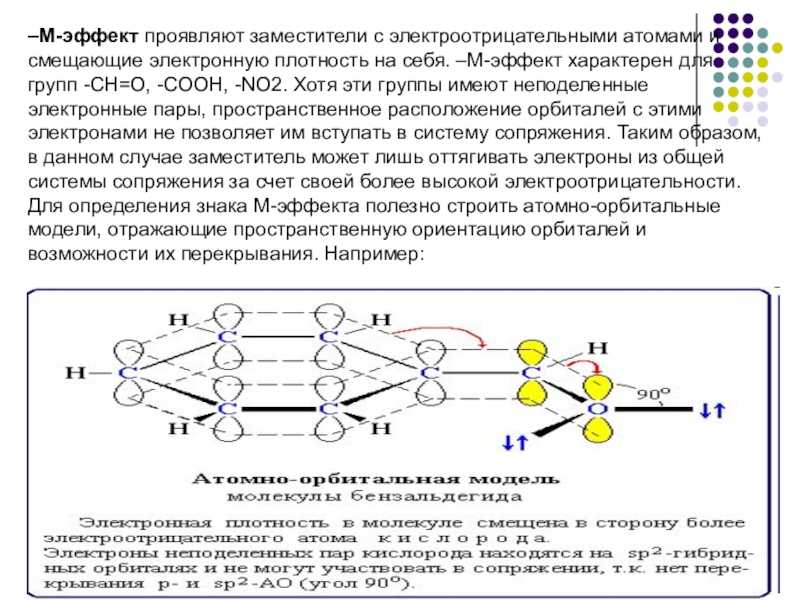
- 13. –М-эффект проявляют заместители с электроотрицательными атомами и
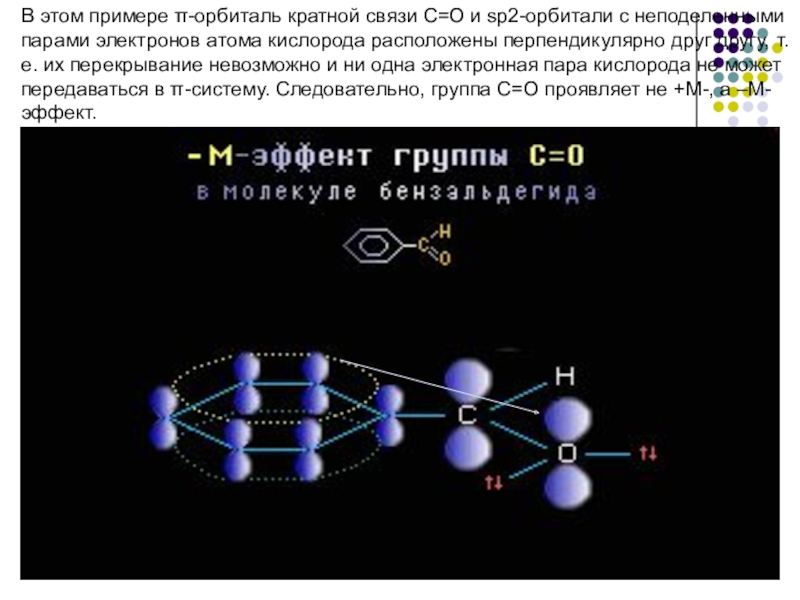
- 14. В этом примере π-орбиталь кратной связи C=O
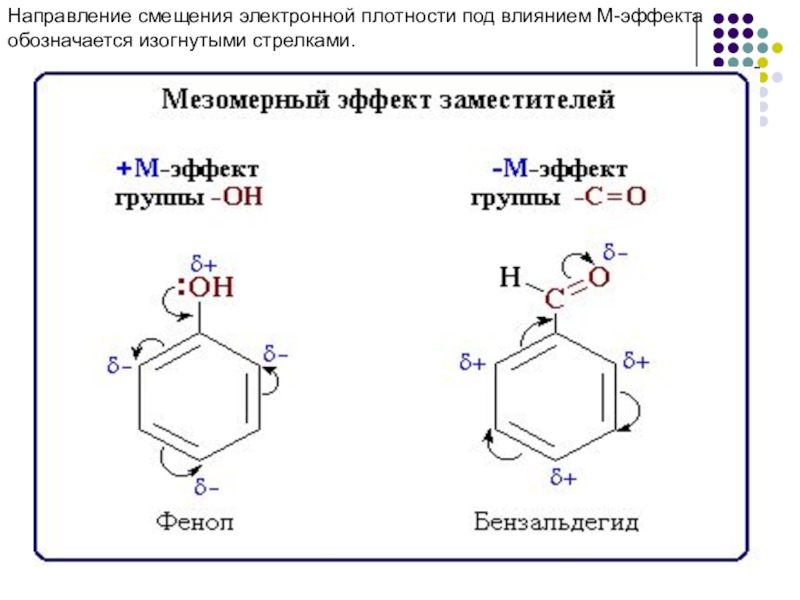
- 15. Направление смещения электронной плотности под влиянием М-эффекта обозначается изогнутыми стрелками.
Слайд 2Изомерия (от др.-греч. ἴσος — «равный», и μέρος — «доля, часть»)
Структурная изомерия
Изомерия углеводородной цепи (углеродного скелета):
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
Изомерия функциональной группы (межклассовая изомерия):
Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
зомерия положения
Изомерия положения:
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Слайд 3Пространственная изомерия (стереоизомерия):
пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной
Этот тип изомерии подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
Слайд 4Структурную изомерию различают на:
Изомерия углеродного скелета.
Изомерия положения кратной связи.
Изомерия положения функциональной
Межклассовая изомерия.
Рассмотрим примеры изомерии (учащиеся конспектируют примеры в тетради).
1. Изомерия углеродного скелета.
Пентан
Составим изомер
2 метилбутан
Слайд 52. Изомерия положения кратной связи.
Пентен – 1
Составим изомер
Пентен – 2
3.
Пентанол – 3
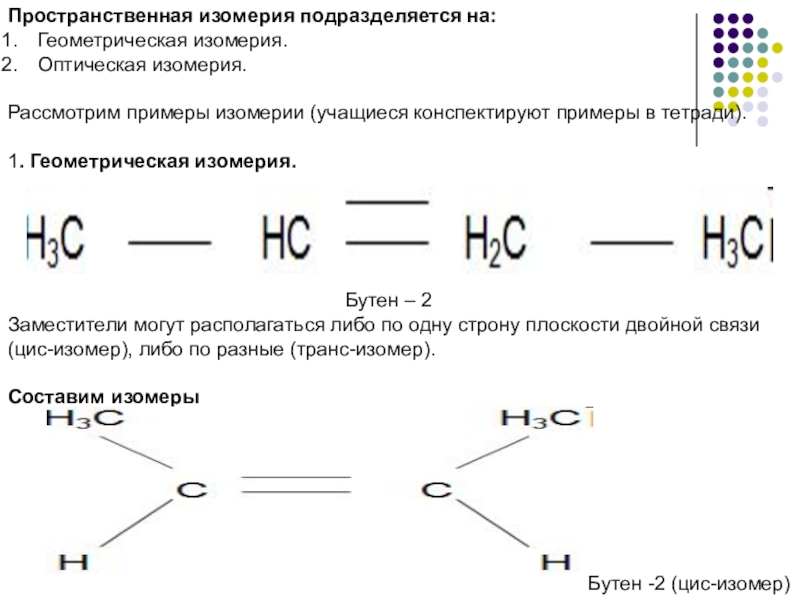
Слайд 7Пространственная изомерия подразделяется на:
Геометрическая изомерия.
Оптическая изомерия.
Рассмотрим примеры изомерии (учащиеся конспектируют примеры
1. Геометрическая изомерия.
Бутен – 2
Заместители могут располагаться либо по одну строну плоскости двойной связи (цис-изомер), либо по разные (транс-изомер).
Составим изомеры
Бутен -2 (цис-изомер)
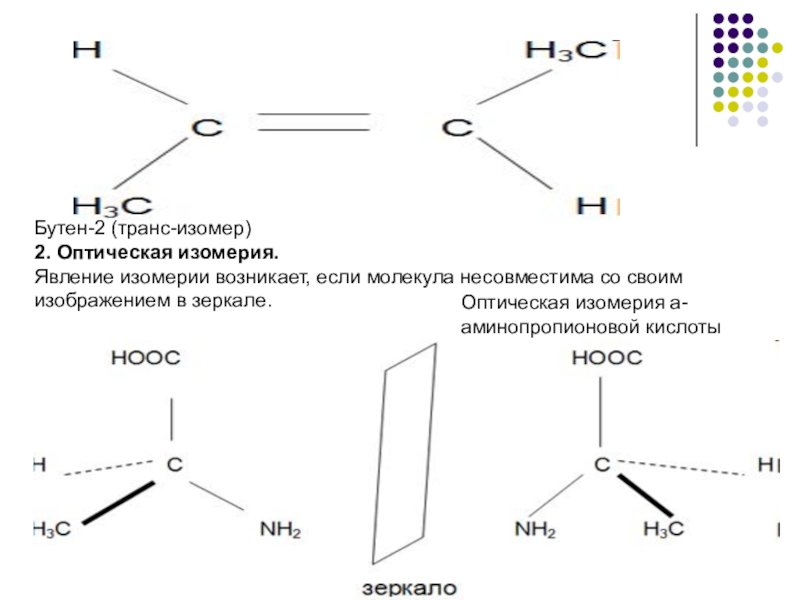
Слайд 8Бутен-2 (транс-изомер)
2. Оптическая изомерия.
Явление изомерии возникает, если молекула несовместима со своим
Оптическая изомерия а-аминопропионовой кислоты
Слайд 9Электронные эффекты - смещение электронной плотности в молекуле, ионе или радикале
Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода.
Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Индуктивный эффект — смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов.
Известно, что полярная ковалентная связь образуется между атомами с различной электроотрицательностью. Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах. Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов, индуцируемых заместителем:
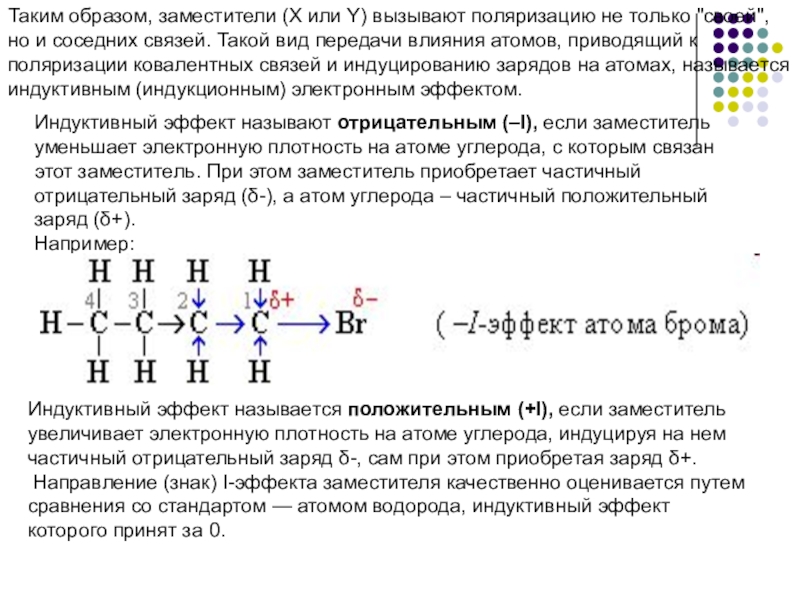
Слайд 10Таким образом, заместители (X или Y) вызывают поляризацию не только "своей",
Индуктивный эффект называют отрицательным (–I), если заместитель уменьшает электронную плотность на атоме углерода, с которым связан этот заместитель. При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+).
Например:
Индуктивный эффект называется положительным (+I), если заместитель увеличивает электронную плотность на атоме углерода, индуцируя на нем частичный отрицательный заряд δ-, сам при этом приобретая заряд δ+.
Направление (знак) I-эффекта заместителя качественно оценивается путем сравнения со стандартом — атомом водорода, индуктивный эффект которого принят за 0.
Слайд 11–I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода:
-F,
+I-эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью:
-Mg-, -Li; алифатические углеводородные радикалы (-CH3, -C2H5) и т.п.
Мезомерный эффект - смещение электронной плотности по цепи делокализованных (сопряженных) π-связей
Этот эффект проявляют заместители, связанные с sp2- или sp-гибридизованным атомом. Благодаря подвижности π-электронов, М-эффект передается по цепи сопряжения без затухания.
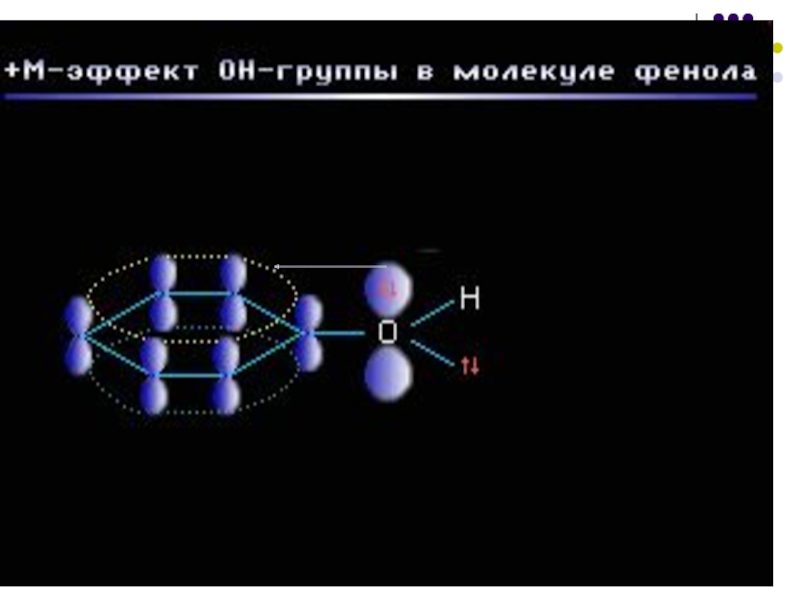
+М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения. +М-эффект характерен для групп -OH и -NH2. Так, в молекуле фенола C6H5OH группа -OH проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения:
Слайд 13–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на
Для определения знака М-эффекта полезно строить атомно-орбитальные модели, отражающие пространственную ориентацию орбиталей и возможности их перекрывания. Например: