- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Соли , общая характеристика
Содержание
- 1. Презентация Соли , общая характеристика
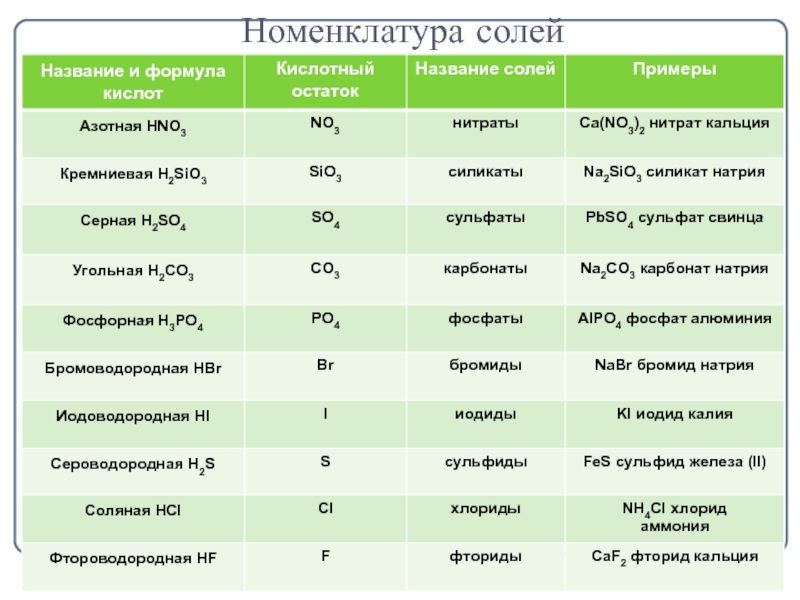
- 2. Определение солейСоли - это сложные вещества, состоящие из ионов металлов и кислотных остатков.
- 3. Номенклатура солей
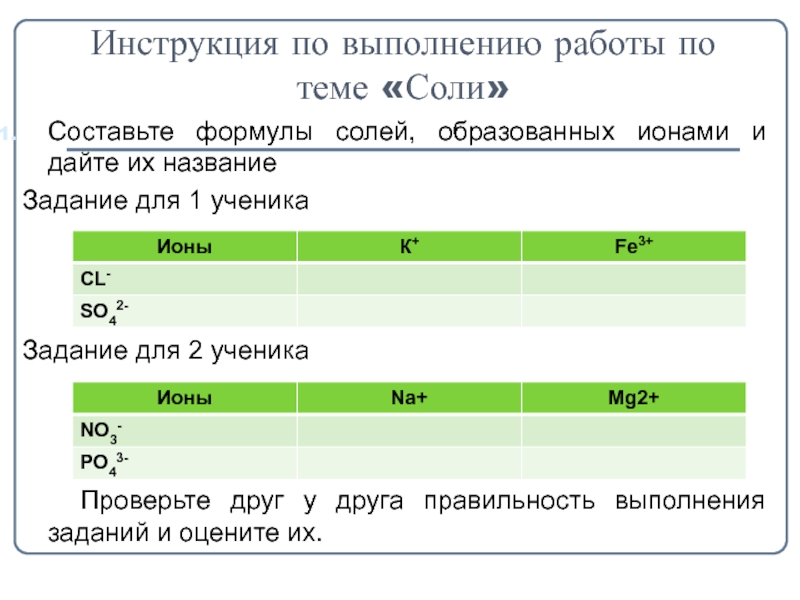
- 4. Инструкция по выполнению работы по теме «Соли»Cоставьте
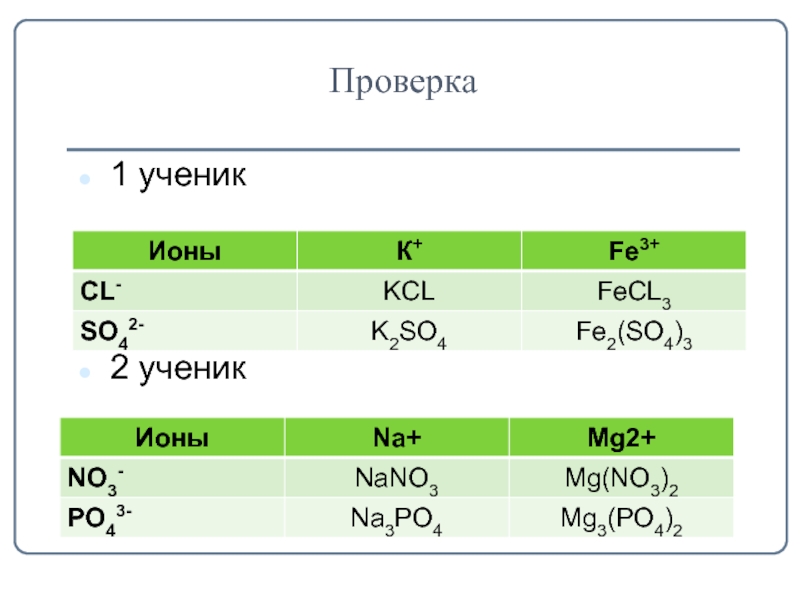
- 5. Проверка1 ученик2 ученик
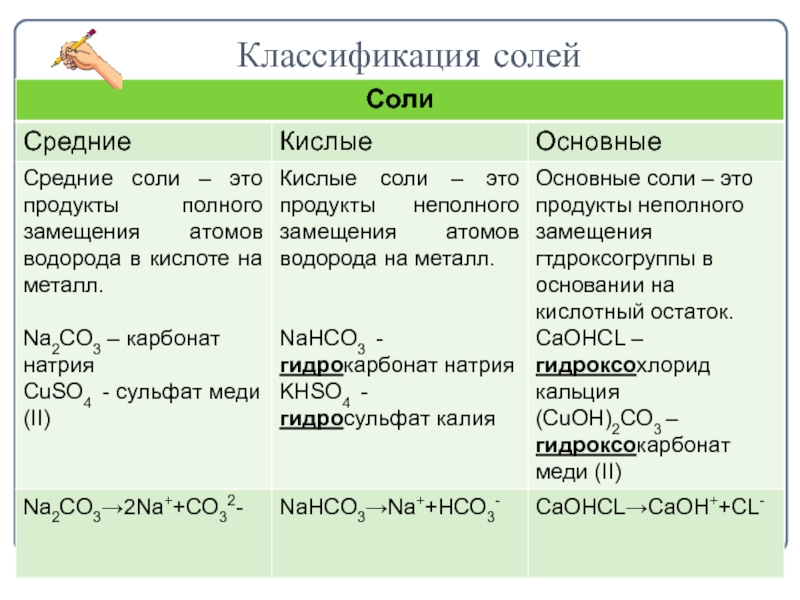
- 6. Классификация солей
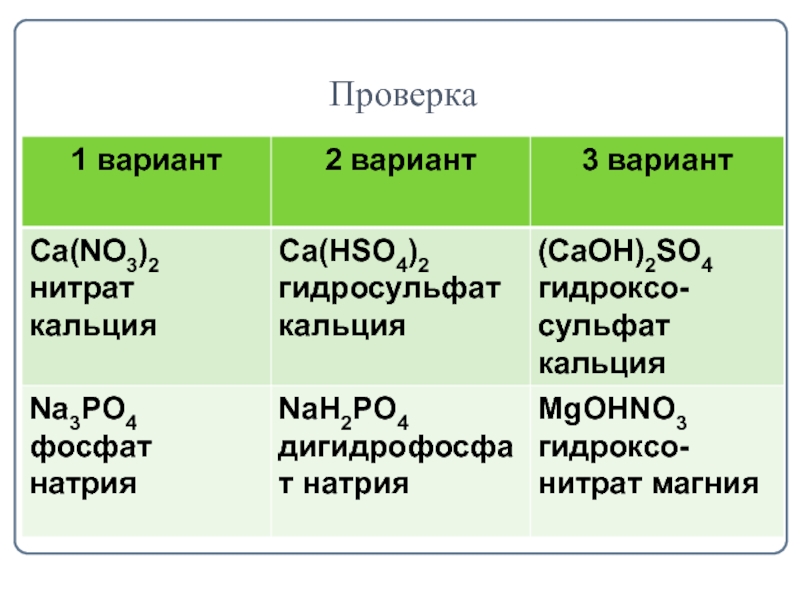
- 7. Классификация солейЗадание: Из перечня формул Сa(HSO4)2, (CaOH)2SO4,
- 8. Проверка
- 9. Химические свойства солей1. Соль + кислота →
- 10. Химические свойства солей Обе соли (и реагирующая
- 11. Химические свойства солей1. HgCl2 + Cu →
- 12. Инструкция по проведению химического исследования1. Проделайте химическую
- 13. Инструкция по проведению химического исследования3. Проделайте химическую
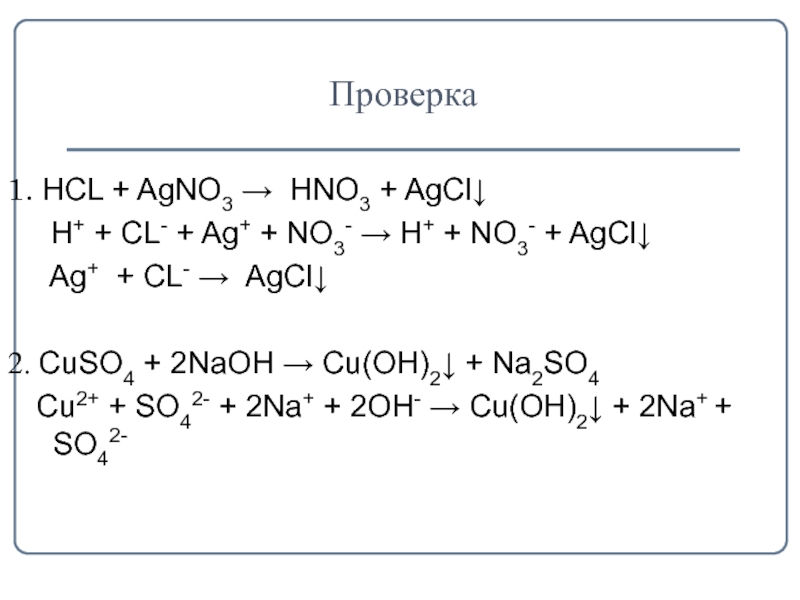
- 14. Проверка1. HCL + AgNO3 → HNO3 +
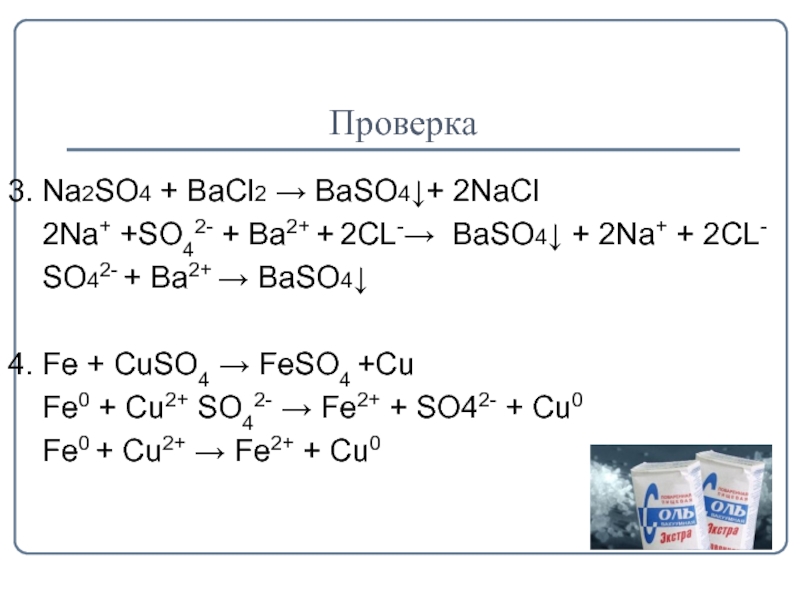
- 15. Проверка3. Na2SO4 + BaCl2 → BaSO4↓+ 2NaCl
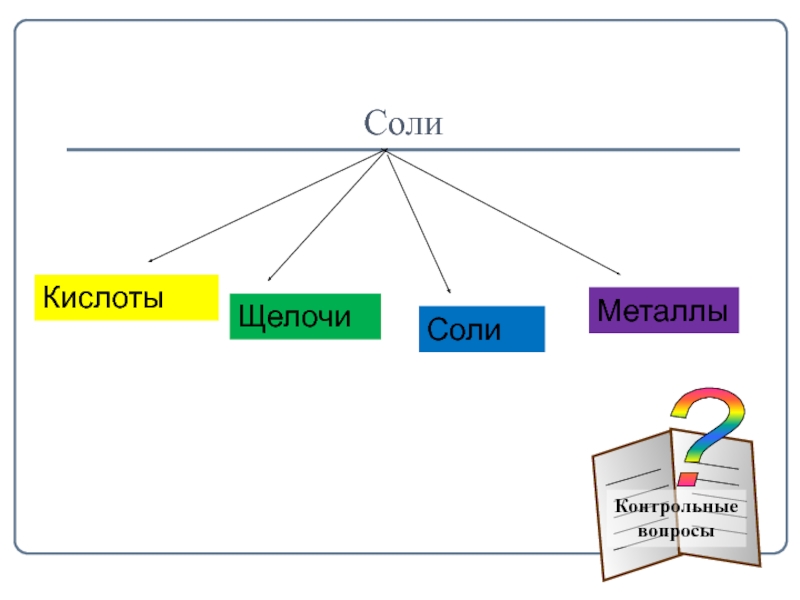
- 16. СолиКислотыЩелочиСолиМеталлы
- 17. Домашнее задание.§ 41, упр. 2,4.
- 18. Благодарю всех за внимание!
Определение солейСоли - это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Слайд 2Определение солей
Соли - это сложные вещества, состоящие из ионов металлов и
кислотных остатков.
Слайд 4Инструкция по выполнению работы по теме «Соли»
Cоставьте формулы солей, образованных ионами
и дайте их название
Задание для 1 ученика
Задание для 2 ученика
Проверьте друг у друга правильность выполнения заданий и оцените их.
Задание для 1 ученика
Задание для 2 ученика
Проверьте друг у друга правильность выполнения заданий и оцените их.
Слайд 7Классификация солей
Задание:
Из перечня формул Сa(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3
выпишите отдельно
1 вариант - формулы средних солей,
2 вариант - формулы кислых солей,
3 вариант - формулы основных солей.
Дайте их название.
Проверьте друг у друга результаты работы.
1 вариант - формулы средних солей,
2 вариант - формулы кислых солей,
3 вариант - формулы основных солей.
Дайте их название.
Проверьте друг у друга результаты работы.
Слайд 9Химические свойства солей
1. Соль + кислота → другая соль + кислота
(реакция обмена)
2. Соль + щелочь → другая соль + другое основание (реакция обмена)
3. Соль1 + соль2 → соль3 + соль4 (реакция обмена)
4. Соль + металл → другая соль + другой металл (реакция замещения)
2. Соль + щелочь → другая соль + другое основание (реакция обмена)
3. Соль1 + соль2 → соль3 + соль4 (реакция обмена)
4. Соль + металл → другая соль + другой металл (реакция замещения)
Слайд 10Химические свойства солей
Обе соли (и реагирующая и образующая в результате реакции
) должны быть растворимыми;
Металлы не должны взаимодействовать с водой, поэтому металлы Ι и ΙΙ групп ПСХЭ Д.И.Менделеева – щелочные и щелочноземельные – не вытесняют другие металлы из растворов их солей
Металлы не должны взаимодействовать с водой, поэтому металлы Ι и ΙΙ групп ПСХЭ Д.И.Менделеева – щелочные и щелочноземельные – не вытесняют другие металлы из растворов их солей
K Ca Na Mg Al Zn Cr Fe Pb H2 Cu Hg Ag Au
Слайд 11Химические свойства солей
1. HgCl2 + Cu → CuCl2 + Hg
Hg2+ + 2Cl- + Cu0 → Cu2+ + 2Cl- + Hg0
Hg2+ + Cu0 → Cu2+ + Hg0
2. FeSO4 + Cu →
Hg2+ + Cu0 → Cu2+ + Hg0
2. FeSO4 + Cu →
Слайд 12Инструкция по проведению химического исследования
1. Проделайте химическую реакцию взаимодействия раствора нитрата
серебра AgNO3 с соляной кислотой HCL. Что наблюдаете? Составьте уравнение реакции в молекулярном и ионных видах.
2. Проделайте химическую реакцию взаимодействия раствора сульфата меди (ΙΙ) СuSO4 с раствором гидроксида натрия NaOH. Что наблюдаете? Составьте уравнение реакции в молекулярном и ионных видах.
2. Проделайте химическую реакцию взаимодействия раствора сульфата меди (ΙΙ) СuSO4 с раствором гидроксида натрия NaOH. Что наблюдаете? Составьте уравнение реакции в молекулярном и ионных видах.
Слайд 13Инструкция по проведению химического исследования
3. Проделайте химическую реакцию взаимодействия раствора сульфата
натрия Na2SO4 с раствором хлорида бария ВаСL2. Составьте уравнение реакции в молекулярном и ионных видах.
4. Проделайте химическую реакцию взаимодействия сульфата меди (ΙΙ) CuSO4 с железом Fe. Составьте уравнение реакции в молекулярном и ионных видах.
5. Проверьте правильность уравнений реакций.
4. Проделайте химическую реакцию взаимодействия сульфата меди (ΙΙ) CuSO4 с железом Fe. Составьте уравнение реакции в молекулярном и ионных видах.
5. Проверьте правильность уравнений реакций.
Слайд 14Проверка
1. HCL + AgNO3 → HNO3 + AgCl↓
Н+
+ СL- + Ag+ + NO3- → H+ + NO3- + AgCl↓
Ag+ + СL- → AgCl↓
2. СuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Сu2+ + SO42- + 2Na+ + 2OH- → Cu(OH)2↓ + 2Na+ + SO42-
Ag+ + СL- → AgCl↓
2. СuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Сu2+ + SO42- + 2Na+ + 2OH- → Cu(OH)2↓ + 2Na+ + SO42-
Слайд 15Проверка
3. Na2SO4 + BaCl2 → BaSO4↓+ 2NaCl
2Na+ +SO42- +
Ba2+ + 2CL-→ BaSO4↓ + 2Na+ + 2CL-
SO42- + Ba2+ → BaSO4↓
4. Fе + CuSO4 → FеSO4 +Cu
Fe0 + Cu2+ SO42- → Fe2+ + SO42- + Cu0
Fe0 + Cu2+ → Fe2+ + Cu0
SO42- + Ba2+ → BaSO4↓
4. Fе + CuSO4 → FеSO4 +Cu
Fe0 + Cu2+ SO42- → Fe2+ + SO42- + Cu0
Fe0 + Cu2+ → Fe2+ + Cu0