- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Соли и их классификация
Содержание
- 1. Презентация Соли и их классификация
- 2. Классификация солейСредние соли – продукты полного замещения
- 3. Классификация солей Двойные соли – соли, содержащие
- 4. К средним солям относится каждое из двух
- 5. Установите соответствие между формулой соли и её
- 6. Установите соответствие между солью и классом (группой)
- 7. Формулы только основных солей указаны в ряду, KHCO3, Na2Cr2O7, (CUOH)2SO4CuCl2, NaHSO3, (AlOH)Cl2Ca(HCO3)2, ZnS, (FeOH)Cl(FeOH)NO3, (CuOH)2CO3, MgOHCl
- 8. Способы получения средних солейОснования + кислота: 3NaOH +
- 9. Способы получения средних солейСоль + кислота: BaCl2 +
- 10. Способы получения средних солейМеталл + неметалл: Mg +
- 11. Нерастворимая соль образуется при взаимодействииKOH(р-р) и H3PO4(р-р)
- 12. Разложение средних солейРазложение карбонатов 2 группы главной
- 13. Получение кислых солейВзаимодействие избытка кислоты с основанием: H3PO4
- 14. Установите соответствие между реагирующими веществами и продуктами
- 15. Получение основных солейВзаимодействие кислоты с избытком основания: Fe(OH)3
- 16. Переход одних солей в другие Средние →
- 17. Переход одних солей в другиеСредние→ основные: CuCl2 +
- 18. Сероводород объемом 5,6 л (н.у.) прореагировал без
- 19. Оксид фосфора(V) массой 1,42 г растворили в
Классификация солейСредние соли – продукты полного замещения атомов водорода в кислоте химическим элементом металлом (состоят из катионов металла и анионов кислотного остатка) Na2SO4, K3PO4Кислые соли - продукты неполного замещения атомов водорода в кислоте химическим элементом металлом
Слайд 2Классификация солей
Средние соли – продукты полного замещения атомов водорода в кислоте
химическим элементом металлом (состоят из катионов металла и анионов кислотного остатка)
Na2SO4, K3PO4
Кислые соли - продукты неполного замещения атомов водорода в кислоте химическим элементом металлом (в анион кислотного остатка входит водород)
NaHSO4, K2HPO4
Основные соли - продукты неполного замещения гидроксогрупп в гидроксиде металла кислотными остатками (катион содержит гироксогруппы)
CuOHCl, AlOH(NO3)2
Na2SO4, K3PO4
Кислые соли - продукты неполного замещения атомов водорода в кислоте химическим элементом металлом (в анион кислотного остатка входит водород)
NaHSO4, K2HPO4
Основные соли - продукты неполного замещения гидроксогрупп в гидроксиде металла кислотными остатками (катион содержит гироксогруппы)
CuOHCl, AlOH(NO3)2
Слайд 3Классификация солей
Двойные соли – соли, содержащие два катиона
KAl(SO4)2
Смешанные соли –
соли, содержащие два аниона
CaOCl2
Комплексные соли – соли, содержащие ион комплексообразователя, связанный с лигандами
Na[Al(OH)4]
CaOCl2
Комплексные соли – соли, содержащие ион комплексообразователя, связанный с лигандами
Na[Al(OH)4]
Слайд 4
К средним солям относится каждое из двух веществ
Fe(OH)2Cl и Fe(HSO4)2
MgCl2 и Mg(OH)NO3
KHCO3 и NaHSiO3
K3PO4 и BaSiO3
Слайд 5
Установите соответствие между формулой соли и её принадлежностью к определённой группе.
А)
ZnSO4 1) кислая
Б) Cu2(OH)2CO3 2) средняя
В) KAl(SO4)2 3)основная
Г) NaHSO4 4) двойная
5)комплексная
Б) Cu2(OH)2CO3 2) средняя
В) KAl(SO4)2 3)основная
Г) NaHSO4 4) двойная
5)комплексная
Слайд 6
Установите соответствие между солью и классом (группой) солей, к которому она
принадлежит.
А) Сa(OCl)Cl 1) основные
Б) NaH2PO4 2) кислые
В) Al(OH)SO4 3) средние
Г) Fe(SCN)2 4) двойные
5) смешанные
А) Сa(OCl)Cl 1) основные
Б) NaH2PO4 2) кислые
В) Al(OH)SO4 3) средние
Г) Fe(SCN)2 4) двойные
5) смешанные
Слайд 7
Формулы только основных солей указаны в ряду,
KHCO3, Na2Cr2O7, (CUOH)2SO4
CuCl2, NaHSO3,
(AlOH)Cl2
Ca(HCO3)2, ZnS, (FeOH)Cl
(FeOH)NO3, (CuOH)2CO3, MgOHCl
Ca(HCO3)2, ZnS, (FeOH)Cl
(FeOH)NO3, (CuOH)2CO3, MgOHCl
Слайд 8Способы получения средних солей
Основания + кислота:
3NaOH + H3PO4 = Na3PO4 +
3H2O
Основный оксид + кислота:
MgO + H2SO4 = MgSO4 + H2O
Кислотный оксид + щелочь:
SO3 + 2NaOH = Na2SO4 + H2O
Кислотный оксид + основный оксид:
SO3 + Na2O = Na2SO4
Основный оксид + кислота:
MgO + H2SO4 = MgSO4 + H2O
Кислотный оксид + щелочь:
SO3 + 2NaOH = Na2SO4 + H2O
Кислотный оксид + основный оксид:
SO3 + Na2O = Na2SO4
Слайд 9Способы получения средних солей
Соль + кислота:
BaCl2 + H2SO4 = BaSO4↓ +
2HCl
Раствор соли + раствор соли:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Раствор соли + раствор щелочи:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
Раствор соли + раствор соли:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Раствор соли + раствор щелочи:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
Слайд 10Способы получения средних солей
Металл + неметалл:
Mg + S = MgS
Металл +
раствор соли:
Mg + CuSO4 = MgSO4 + Cu
Металл + кислота:
Mg + H2SO4 = MgSO4 + H2
Mg + CuSO4 = MgSO4 + Cu
Металл + кислота:
Mg + H2SO4 = MgSO4 + H2
Слайд 11
Нерастворимая соль образуется при взаимодействии
KOH(р-р) и H3PO4(р-р)
HCl(р-р) и Mg(NO3)2(р-р)
HNO3(р-р)
и CuO
Ca(OH)2(р-р) и CO2
Ca(OH)2(р-р) и CO2
Слайд 12Разложение средних солей
Разложение карбонатов 2 группы главной подгруппы:
CaCO3 = CaO +
CO2
Разложение нитратов:
2NaNO3 = 2NaNO2 +O2
2Cu(NO3)2 = 2CuO + 4NO2 +O2
2AgNO3 = 2Ag + 2NO2 + O2
Разложение других солей:
2KMnO4 = K2MnO4 + MnO2 + O2
2KClO3 = 2KCl + 3O2
Разложение нитратов:
2NaNO3 = 2NaNO2 +O2
2Cu(NO3)2 = 2CuO + 4NO2 +O2
2AgNO3 = 2Ag + 2NO2 + O2
Разложение других солей:
2KMnO4 = K2MnO4 + MnO2 + O2
2KClO3 = 2KCl + 3O2
Слайд 13Получение кислых солей
Взаимодействие избытка кислоты с основанием:
H3PO4 + NaOH = NaH2PO4
+ H2O
Взаимодействие избытка кислотного оксида с основанием:
CO2 + KOH = KHCO3
Взаимодействие избытка кислотного оксида с основанием:
CO2 + KOH = KHCO3
Слайд 14
Установите соответствие между реагирующими веществами и продуктами из взаимодействия.
А) KOH +
SO3(изб) → 1) KHSO4
Б) KOH + SO3(нед) → 2) K2SO3
В) KOH + CO2(изб) → 3) K2CO3 и H2O
Г) KOH + CO2(нед) → 4) K2SO4 и H2O
5) KHCO3
6) KHSO3
Б) KOH + SO3(нед) → 2) K2SO3
В) KOH + CO2(изб) → 3) K2CO3 и H2O
Г) KOH + CO2(нед) → 4) K2SO4 и H2O
5) KHCO3
6) KHSO3
Слайд 15Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl
+ H2O
Взаимодействие избытка соли со щелочью:
Cu(NO3)2 +NaOH = CuOHNO3 + NaNO3
Взаимодействие избытка соли со щелочью:
Cu(NO3)2 +NaOH = CuOHNO3 + NaNO3
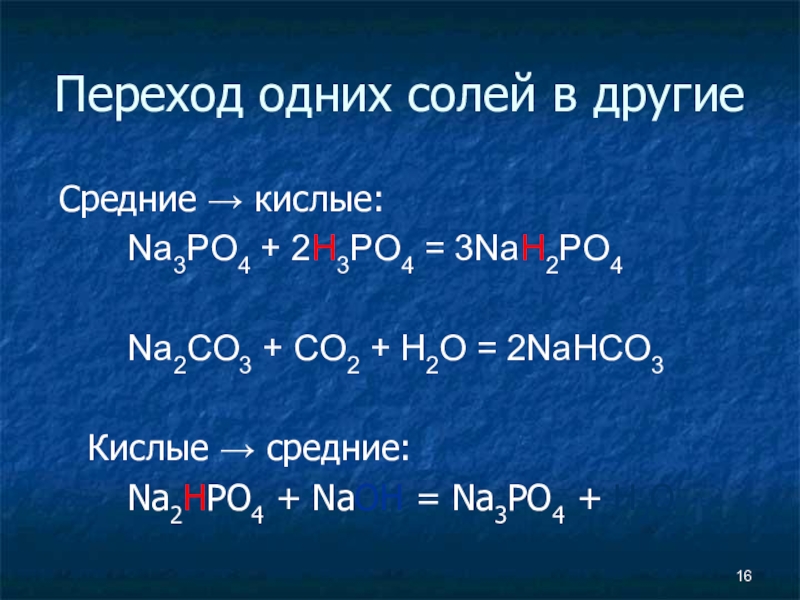
Слайд 16Переход одних солей в другие
Средние → кислые:
Na3PO4 + 2H3PO4
= 3NaH2PO4
Na2CO3 + CO2 + H2O = 2NaHCO3
Кислые → средние:
Na2HPO4 + NaOH = Na3PO4 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
Кислые → средние:
Na2HPO4 + NaOH = Na3PO4 + H2O
Слайд 17Переход одних солей в другие
Средние→ основные:
CuCl2 + NaOH = CuOHCl +
NaCl
Основные → средние:
CuOHCl + HCl = CuCl2 + H2O
Основные → средние:
CuOHCl + HCl = CuCl2 + H2O
Слайд 18
Сероводород объемом 5,6 л (н.у.) прореагировал без остатка с 59,02 мл
раствора гидроксида калия с массовой долей 20% (плотность 1,186 г/мл). Определить массу соли, полученной в результате этой химической реакции.
Слайд 19
Оксид фосфора(V) массой 1,42 г растворили в 60 г 8,2%-ной ортофосфорной
кислоты и полученный раствор прокипятили. Какая соль и в каком количестве образуется, если к полученному раствору добавить 3,92 г гидроксида калия?