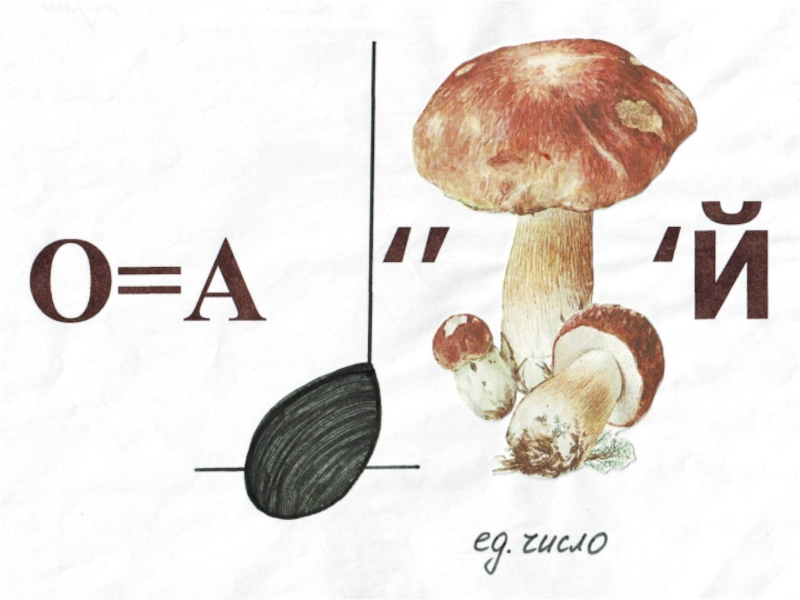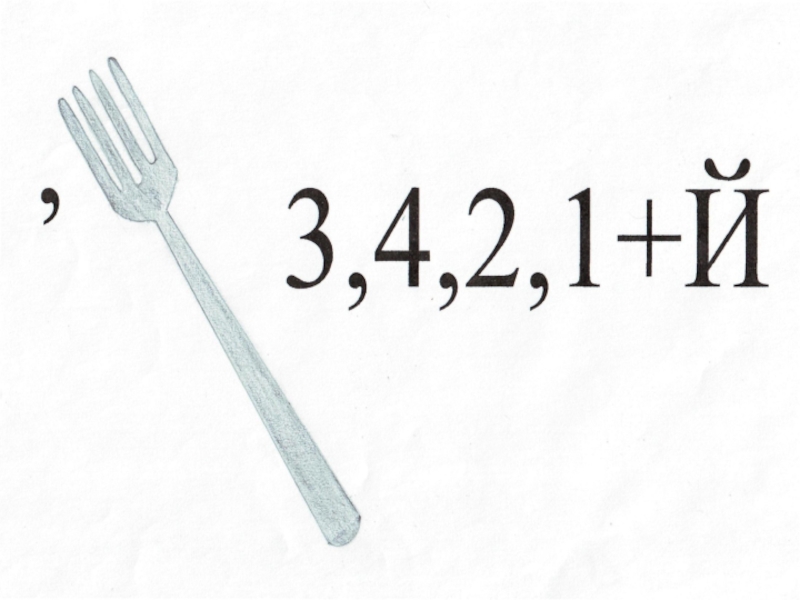2 вариант
Б А
В В
Б В
В Б
А А
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
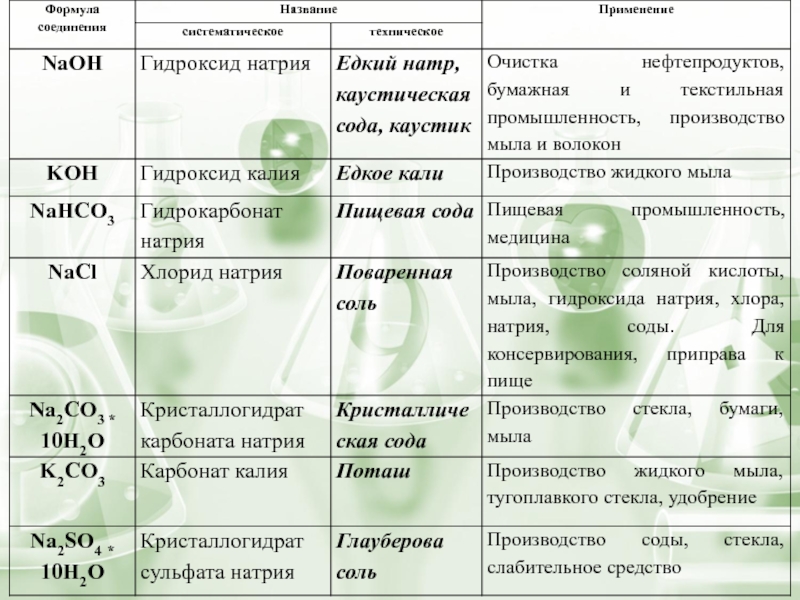
Презентация, доклад Соединения щелочных металлов
Содержание
- 1. Презентация Соединения щелочных металлов
- 2. Слайд 2
- 3. Слайд 3
- 4. Ответы к тесту1 вариант
- 5. Тема урока: СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
- 6. Оксид натрия представляет
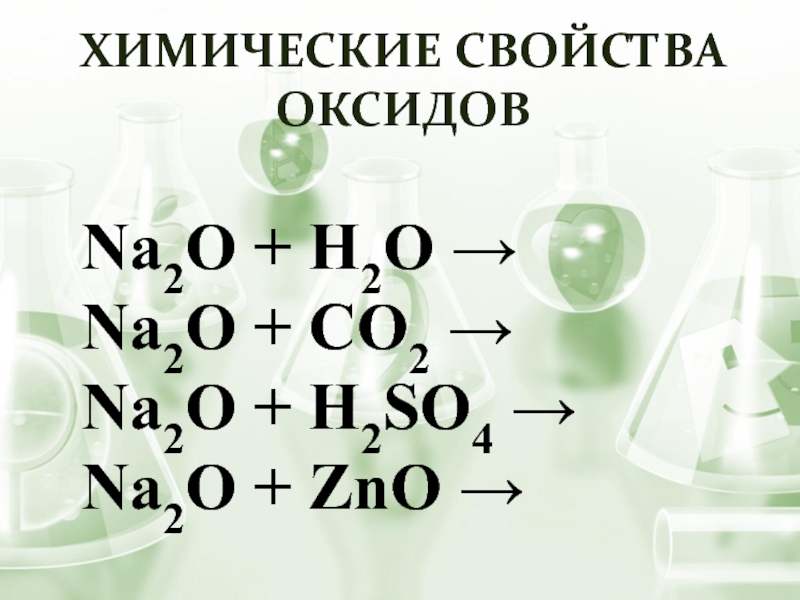
- 7. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
- 8. Общая формула гидроксидов щелочных металлов:МOH
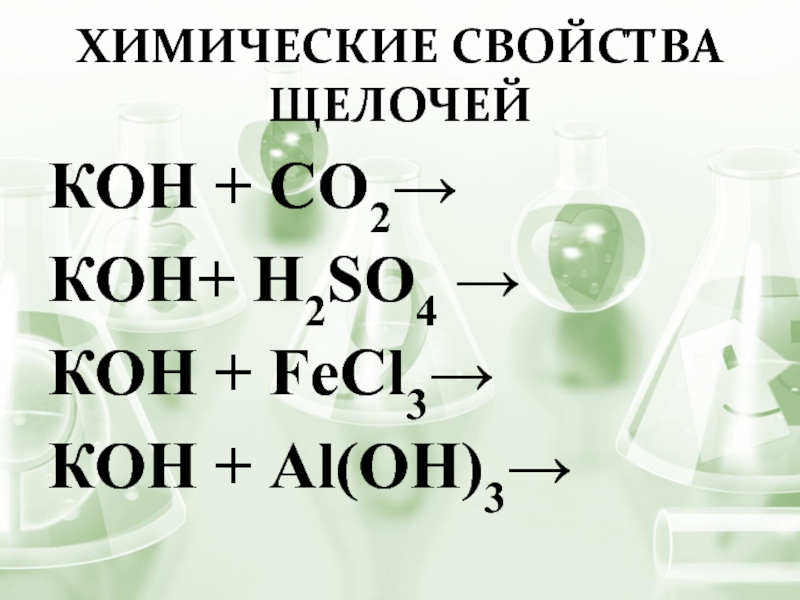
- 9. КОН + CO2→КОН+ H2SO4 →КОН + FeCl3→КОН + Al(OH)3→Химические свойства щелочей
- 10. КОН Гидроксид калия (едкий кали) Применяют при производстве жидкого мыла
- 11. NaOHЕдкий натр применяется в огромном множестве отраслейпромышленности
- 12. Для омыления жиров при производстве мыла, шампуня и других моющих средств
- 13. В качестве агента для растворения засоров
- 14. В химических отраслях промышленности — для нейтрализациикислот и
- 15. хлориды Хлорид натрия – поваренная сольNaCl Древнегреческий
- 16. Слайд 16
- 17. Когда человека мучает изжога, он пользуется раствором
- 18. Задание на «3»
- 19. Задание на «4»а) K2O + H2O→
- 20. Задание на «5»Na→ Na2O2 →Na2O→ NaOH→Na2CO3→NaCl2Na +
- 21. ДОМАШНЕЕ ЗАДАНИЕПараграф 14 упр. 1,5Напишите
Ответы к тесту1 вариант 2 вариантБ
Слайд 6 Оксид натрия представляет собой бесцветные кристаллы. Хранить
оксиды лучше всего в безводном бензоле.
Общая формула оксидов
щелочных металлов:
М2O
Характер оксида:
основный
Слайд 8Общая формула гидроксидов
щелочных металлов:
МOH
Твердое белое кристаллическое
вещество, хорошо растворимое в воде. Процесс растворения сопровождается выделением достаточного количества теплоты.
Слайд 11NaOH
Едкий натр применяется в огромном множестве отраслейпромышленности и для бытовых нужд:
Каустик
применяется в целлюлозно-бумажной промышленности.
В производстве бумаги, картона, искусственных волокон, древесно-волоконных плит
В производстве бумаги, картона, искусственных волокон, древесно-волоконных плит
Слайд 13 В качестве агента для растворения засоров канализационных
труб в виде
сухих гранул или в составе гелей. Гидроксид натрия
дезагрегирует засор и способствует лёгкому продвижению его
далее по трубе.
дезагрегирует засор и способствует лёгкому продвижению его
далее по трубе.
Слайд 14В химических отраслях промышленности — для нейтрализации
кислот и кислотных оксидов, как реагент
или катализатор в
химических реакциях, в нефтепереработке —для производства масел, очистке нефти.
химических реакциях, в нефтепереработке —для производства масел, очистке нефти.
Слайд 15хлориды
Хлорид натрия – поваренная соль
NaCl
Древнегреческий поэт Гомер, назвал поваренную
соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты»
Поваренную соль применяют при производство химических веществ: соляной кислоты, гидроксида натрия
хлора, соды, для консервирования,
приправа к пище, производство мыла, в медицине
Слайд 17Когда человека мучает изжога, он пользуется раствором питьевой соды. Вычислить массу
соды, требуемой для нейтрализации 1,02г соляной кислоты, вызвавшей повышенную кислотность желудка. Ответ: 2,34г
Дано: Решение: m (HCl) = 1,02г NaHCO3 + HCl → NaCl + H2O+ CO2 Найти: n(HCl)=m/M =1,02/ 36,5=0,02795 моль m(NaHCO3) = ?г n(NaHCO3) = 0,02795 моль
m(NaHCO3) = 0,02795 моль* 84 = 2,3478г
Дано: Решение: m (HCl) = 1,02г NaHCO3 + HCl → NaCl + H2O+ CO2 Найти: n(HCl)=m/M =1,02/ 36,5=0,02795 моль m(NaHCO3) = ?г n(NaHCO3) = 0,02795 моль
m(NaHCO3) = 0,02795 моль* 84 = 2,3478г
Слайд 19Задание на «4»
а) K2O + H2O→ 2KOH
б)Na2O + Ba(OH)2→
в) Li2O
+ 2HCl→ 2LiCl + Н2О
г)Na2O + SO3→ Na2SO4
д) 2NaOH + ZnO→ Na2ZnO2 + Н2О
е) KOH + BaCl2→
ж)2LiOH + H2SO4→ Li2SO4 + 2Н2О
з)NaOH + CaO→
г)Na2O + SO3→ Na2SO4
д) 2NaOH + ZnO→ Na2ZnO2 + Н2О
е) KOH + BaCl2→
ж)2LiOH + H2SO4→ Li2SO4 + 2Н2О
з)NaOH + CaO→
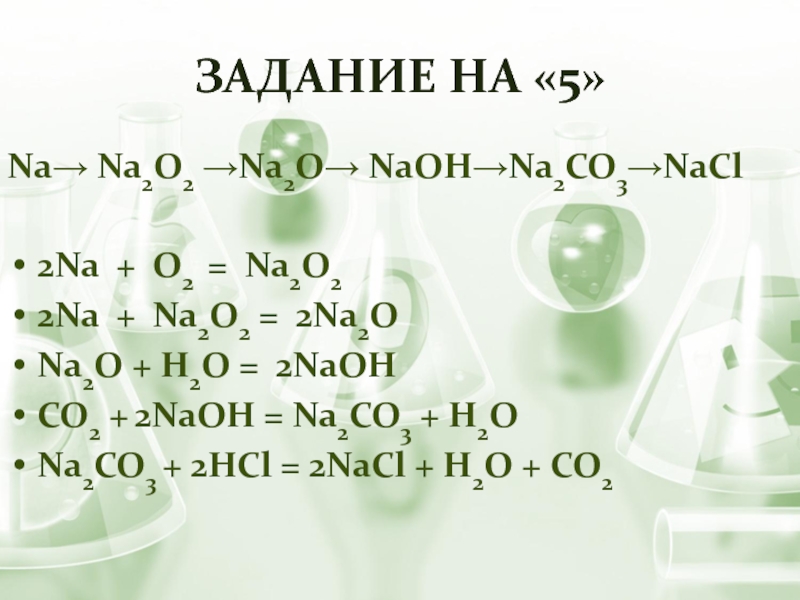
Слайд 20Задание на «5»
Na→ Na2O2 →Na2O→ NaOH→Na2CO3→NaCl
2Na + O2 = Na2O2
2Na +
Na2O2 = 2Na2O
Na2O + H2O = 2NaOH
CO2 + 2NaOH = Na2CO3 + Н2О
Na2CO3 + 2HCl = 2NaCl + Н2О + CO2
Na2O + H2O = 2NaOH
CO2 + 2NaOH = Na2CO3 + Н2О
Na2CO3 + 2HCl = 2NaCl + Н2О + CO2
Слайд 21ДОМАШНЕЕ ЗАДАНИЕ
Параграф 14 упр. 1,5
Напишите сочинение –рассуждение на тему
«МНОГО СОЛИ - МАЛО КАЛИЯ, МАЛО КАЛИЯ - МНОГО БОЛЕЗНЕЙ»
или «ОТКУДА В ЛЮДЯХ ЛЮБОВЬ К СОЛЕНОМУ»