- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Скорость химической реакции
Содержание
- 1. Презентация Скорость химической реакции
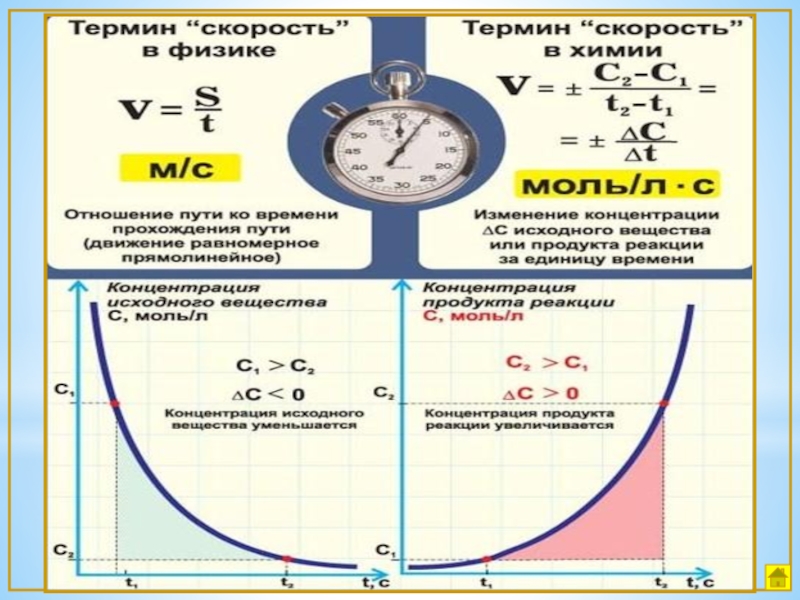
- 2. Химическая кинетика- изучает скорость
- 3. Медленные химические процессы: коррозия, фотосинтез, биосинтез белка.Белки
- 4. Практическое значение знания скорости химической реакции:позволяет замедлять
- 5. Цель занятия:Познакомиться с понятием «скорость
- 6. Слайд 6
- 7. Скорость зависит:Природа реагирующих веществКонцентрацияТемператураКатализатор, ингибиторПлощадь соприкосновенияРеакция происходит
- 8. Лабораторный опыт«Изучение условий, влияющих на протекание химических реакций»
- 9. Природа реагирующих веществРеакционная активность веществ определяется:характером химических
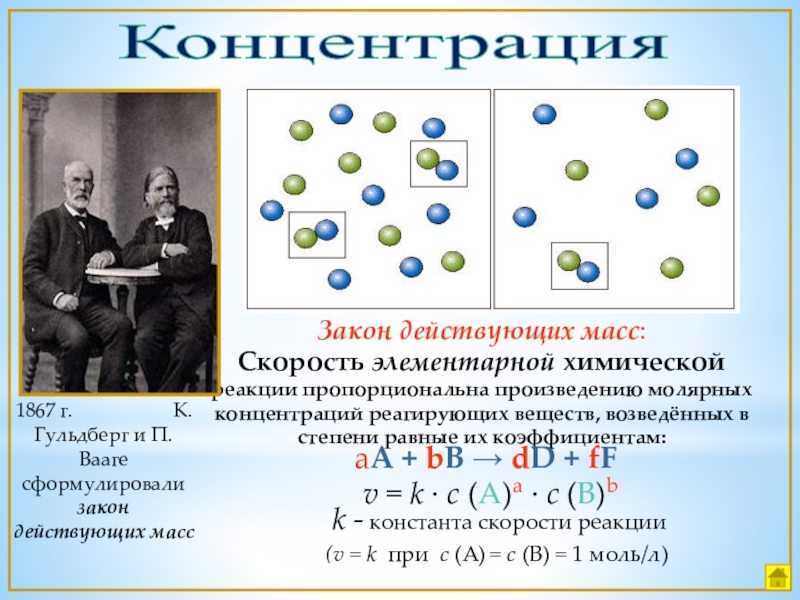
- 10. КонцентрацияЗакон действующих масс:Скорость элементарной химической реакции пропорциональна
- 11. Якоб Вант-Гофф (1852-1911)Температура повышает количество столкновений
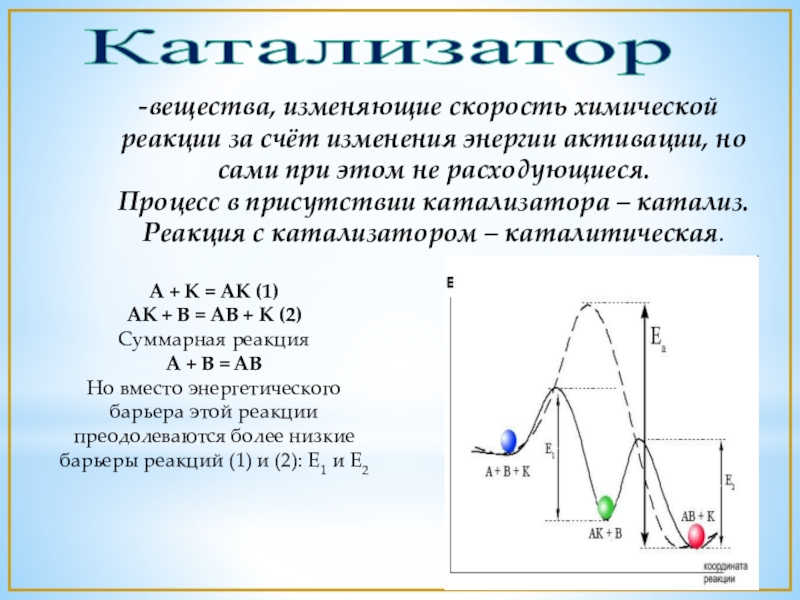
- 12. Катализаторвещества, изменяющие скорость химической реакции за счёт
- 13. Площадь соприкосновенияСкорость гетерогенной реакции прямо пропорциональна площади
- 14. Скорость химических реакций(для гомогенных систем)aA + bB
- 15. Тест
- 16. На скорость химической реакции между раствором серной
- 17. 2Для увеличения скорости химической реакции Mg (тв.)
- 18. 3 C наибольшей скоростью при обычных
- 19. 4.Для увеличения скорости реакции 2CO + O2
- 20. 1) Zn + HCl (5%p-p)2) Zn +
- 21. Продолжите предложения:1. Я сегодня узнал(а)
Слайд 2Химическая кинетика
- изучает скорость и механизмы химических
Быстрые химические процессы: взрывы, ионные реакции в растворах, передача нервного импульса
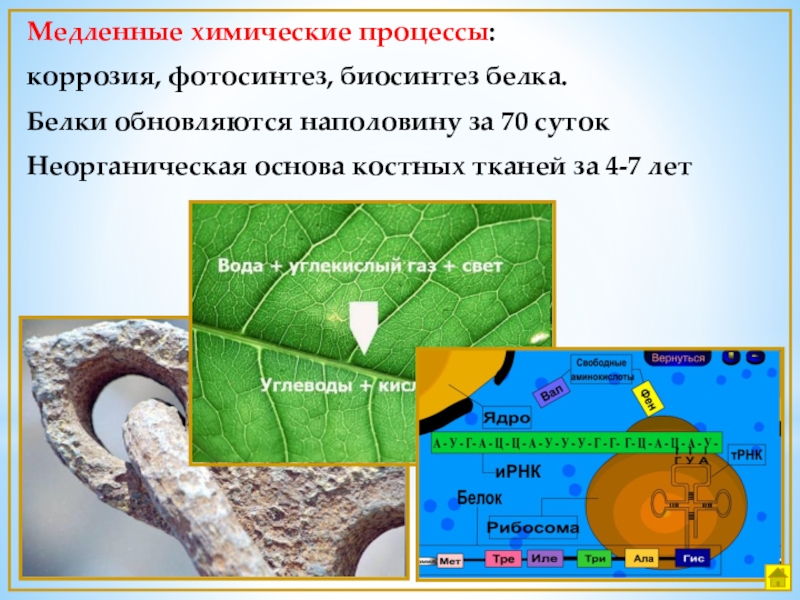
Слайд 3Медленные химические процессы:
коррозия, фотосинтез, биосинтез белка.
Белки обновляются наполовину за 70
Неорганическая основа костных тканей за 4-7 лет
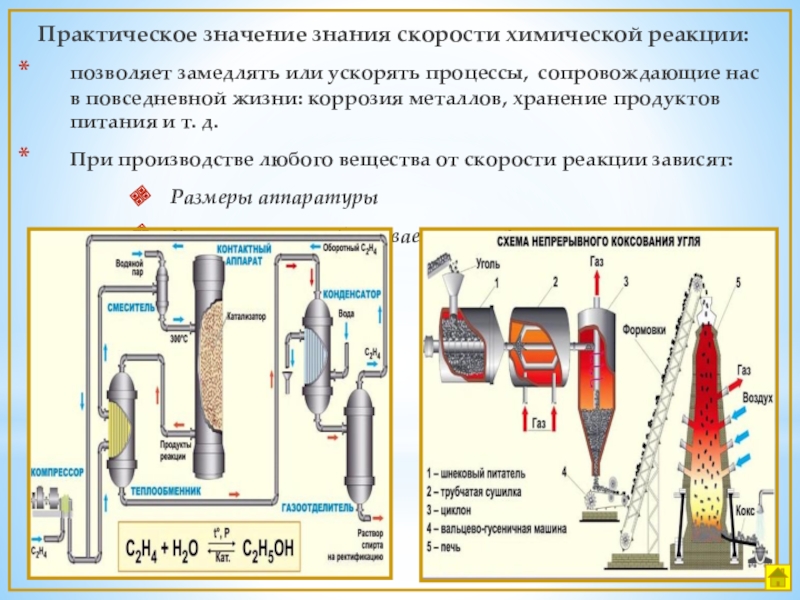
Слайд 4Практическое значение знания скорости химической реакции:
позволяет замедлять или ускорять процессы, сопровождающие
При производстве любого вещества от скорости реакции зависят:
Размеры аппаратуры
Количество вырабатываемого продукта
Слайд 5Цель занятия:
Познакомиться с понятием «скорость химической реакции»
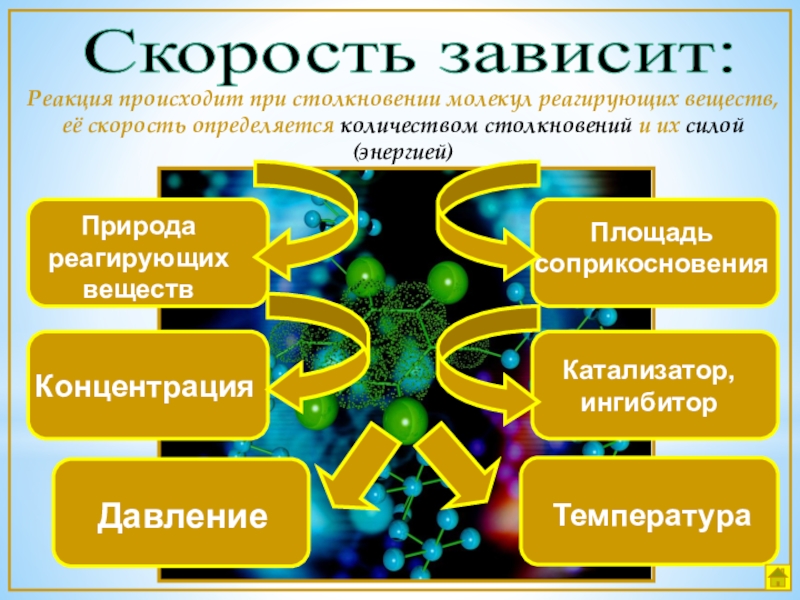
Слайд 7Скорость зависит:
Природа реагирующих веществ
Концентрация
Температура
Катализатор, ингибитор
Площадь соприкосновения
Реакция происходит при столкновении молекул реагирующих
Давление
Слайд 9Природа реагирующих веществ
Реакционная активность веществ определяется:
характером химических связей
скорость больше у
скорость меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества)
υ(Zn + 2 HCl = H2 + ZnCl2) > υ(Zn + CH3COOH = H2 + Zn(CH3COO)2
их строением
скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома)
скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
υ(2K + 2H2O = H2 + 2KOH) > υ(2Na + 2H2O = H2 + 2NaOH)
Слайд 10Концентрация
Закон действующих масс:
Скорость элементарной химической реакции пропорциональна произведению молярных концентраций реагирующих
1867 г. К.Гульдберг и П.Вааге сформулировали закон действующих масс
Слайд 11Якоб Вант-Гофф
(1852-1911)
Температура повышает количество столкновений молекул.
v = v0·∆τ/10
- температурный коэффициент Вант-Гоффа
Слайд 12Катализатор
вещества, изменяющие скорость химической реакции за счёт изменения энергии активации, но
A + K = AK (1)
AK + B = AB + K (2)
Суммарная реакция
A + B = AB
Но вместо энергетического барьера этой реакции преодолеваются более низкие барьеры реакций (1) и (2): E1 и E2
Слайд 13Площадь соприкосновения
Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов.
При
соприкосновения реагирующих веществ, при этом возрастает скорость реакции
Слайд 14Скорость химических реакций
(для гомогенных систем)
aA + bB = d D +
(для гетерогенных систем)
v = v0·∆τ/10
v = k · c (A)a · c (B)b
Слайд 16На скорость химической реакции между раствором серной кислоты и железом не
1) концентрация кислоты
2) измельчение железа
3) температура реакции
4) увеличение давления
1.
Слайд 172
Для увеличения скорости химической реакции
Mg (тв.) + 2H+ = Mg2+
необходимо
1) добавить несколько кусочков магния
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов магния
Слайд 183
C наибольшей скоростью при обычных условиях протекает реакция:
1) 2Ba
2) Ba2+ + CO32- = BaCO3↓
3) Ba + 2H+ = Ba2+ + H2
4) Ba + S = BaS
Слайд 194.
Для увеличения скорости реакции
2CO + O2 = 2CO2 + Q
Необходимо:
1)
2) уменьшить концентрацию О2
3) понизить давление
4) понизить температуру
Слайд 201) Zn + HCl (5%p-p)
2) Zn + HCl (10%p-p)
3) Zn +
4) NaOH (5% p-p) + HCl (5% p-p)
5. С наибольшей скоростью
при обычных условиях
протекает реакция:
Слайд 21Продолжите предложения:
1. Я сегодня узнал(а)
2. У меня сегодня получилось _______________________________________
3. Мне сегодня было сложно выполнить ________________________________________
Благодарю за работу на уроке!