- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Системно- деятельностный подход на уроках химии
Содержание
- 1. Презентация Системно- деятельностный подход на уроках химии
- 2. «Школа не должна научить на всю жизнь,
- 3. Системно - деятельностный подходОсновной результат – развитие
- 4. Деятельностный подход ломает многие привычные стереотипы подготовки
- 5. Какой должна быть структура урока?Как его подготовить?Как
- 6. Основные этапы урока.На уроке выделяют следующие этапы:1
- 7. Такая модель урока имеет ряд позитивных моментов:
- 8. Для того чтобы учащиеся из урока в
- 9. Типы заданий.Терминологические диктанты: вставить пропущенные в тексте
- 10. Характер задания - репродуктивный.Задание 1. Выпишите схемы,
- 11. Частично-поисковый характерЗадание 2. Выпишите схемы распределения электронов
- 12. Характер деятельности – преимущественно эвристический.Задание 3. Выпишите
- 13. деятельность включает элементы исследования.Задание 4. Три элемента
- 14. Кейс №1В 1825 году был получен металл,
- 15. КАРТА ДОМАШНЕГО ЗАДАНИЯХимические формулы веществ1ZnCl2, NaNO3, Ca(OH)2,
- 16. Деятельностный подход позволяет учителю изучать с учащимися
- 17. В методике данного подхода предполагается, что тему
- 18. Какие ассоциации вызывает у вас эта картинка?Почему лимон кислый?Попробуйте назвать тему нашего сегодняшнего урока.КИСЛОТЫ
- 19. Вставьте в текст пропущенные слова:1 Элемент находится
- 20. Можно поставить проблему с помощью эксперимента:Опыт №1.Железо+
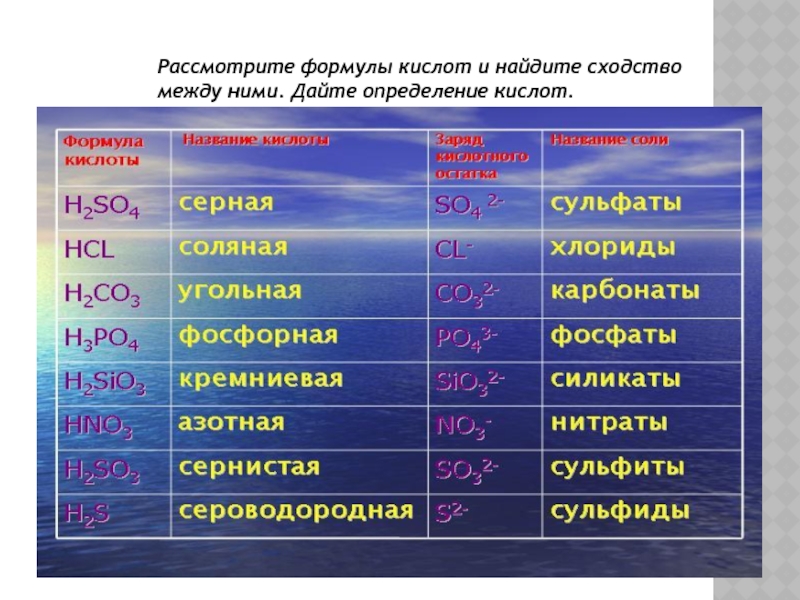
- 21. Рассмотрите формулы кислот и найдите сходство между ними. Дайте определение кислот.
- 22. HCl
- 23. Рассмотрите формулы кислот и ответьте
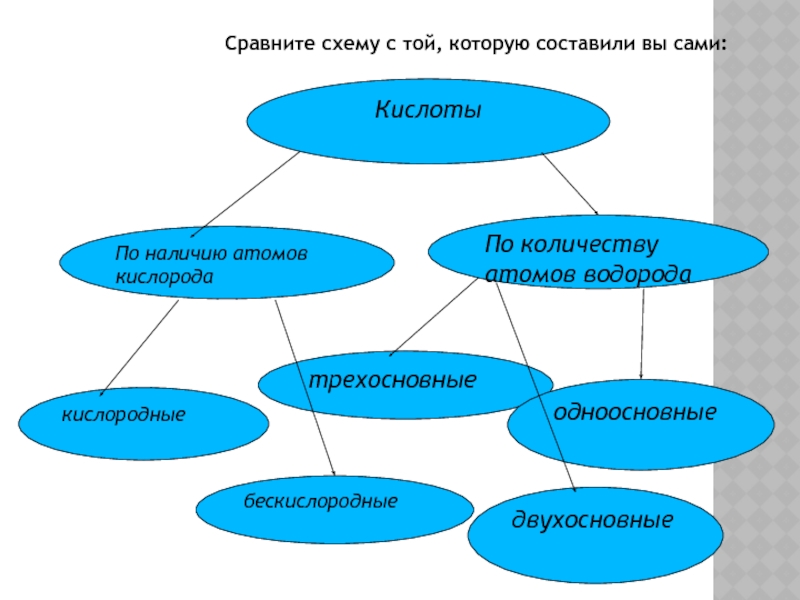
- 24. Сравните схему с той, которую составили вы сами:КислотыПо наличию атомов кислородаПо количеству атомов водородакислородныебескислородныетрехосновныедвухосновныеодноосновные
- 25. Как вы думаете, можно ли отличить кислоты
- 26. Проведем небольшое исследование. Какова его цель?-Проверить, как изменяют окраску индикаторы в растворах кислот.
- 27. Заполните таблицу:Сделайте вывод:Независимо от вида кислоты, индикаторы
- 28. Программа по химии предусматривает развития умения решать
- 29. Завершает урок рефлексия. Формы проведения рефлексии могут
- 30. Составление кластера:кислотыКлассификация кислотПо составукислородныебескислородныеПо количеству атомов водородаодноосновныедвухосновныетрехосновныеприменениеВ
- 31. Сегодня на уроке я:-Научился…………-Мне показалось важным…….-Я понял,
- 32. Синквейн- способ творческой рефлексии в виде «стихотворения»,
- 33. Изменения, вносимые в образовательный процесс оказывают огромное
- 34. Благодарю за внимание
Слайд 2«Школа не должна научить на всю жизнь, школа должна научить учиться
Восточная мудрость
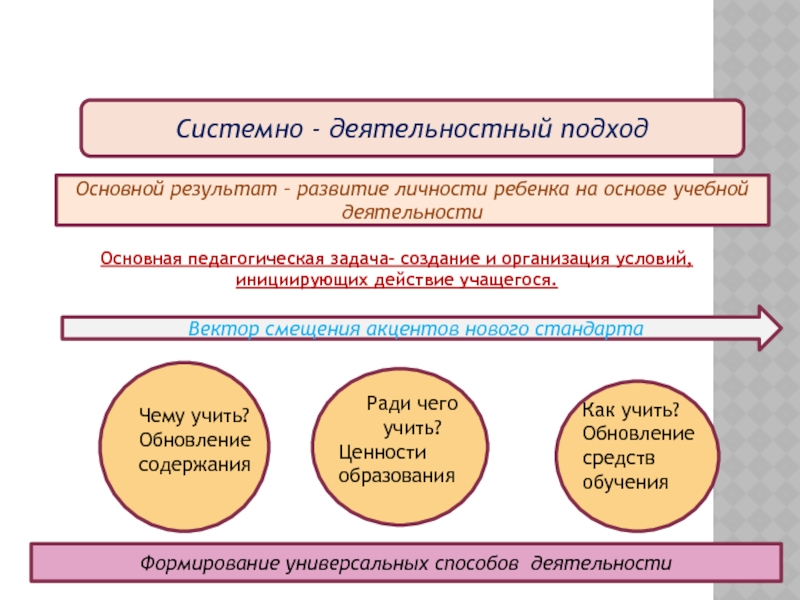
Слайд 3Системно - деятельностный подход
Основной результат – развитие личности ребенка на основе
Основная педагогическая задача- создание и организация условий,
инициирующих действие учащегося.
Вектор смещения акцентов нового стандарта
Чему учить?
Обновление содержания
Ради чего учить?
Ценности образования
Как учить?
Обновление средств обучения
Формирование универсальных способов деятельности
Слайд 4Деятельностный подход ломает многие привычные стереотипы подготовки и проведения уроков, меняет
Слайд 5Какой должна быть структура урока?
Как его подготовить?
Как добиться того, чтобы дети
Слайд 6Основные этапы урока.
На уроке выделяют следующие этапы:
1 Мотивация
собственно
актуализация знаний
Осмысление
постановка учебной задачи
открытие нового знания
составление алгоритма
первичное закрепление
3 Рефлексия
самостоятельная работа- самоконтроль
собственно рефлексия
Слайд 7Такая модель урока имеет ряд позитивных моментов:
использование различных способов деятельности
использование многих современных технологий, в том числе ИКТ.
составление алгоритма действий
Большая накопляемость оценок
Зрелищные формы проведения урока
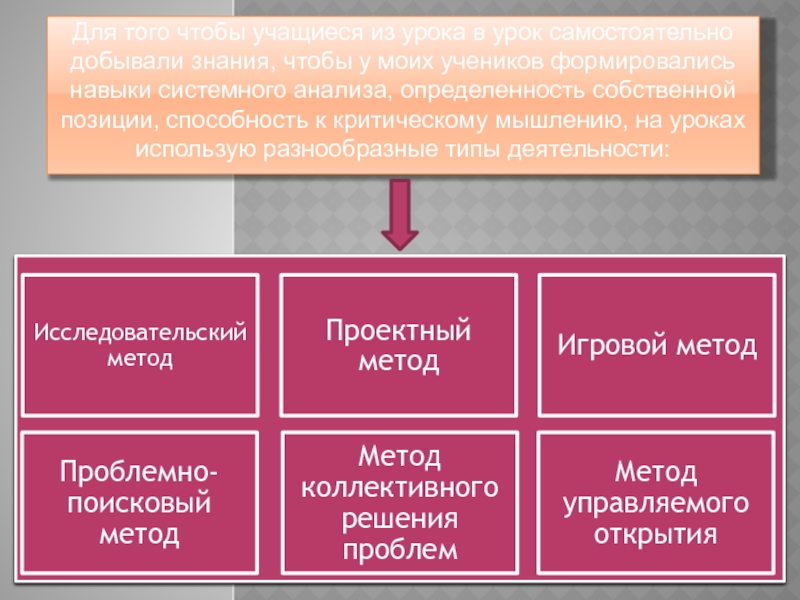
Слайд 8Для того чтобы учащиеся из урока в урок самостоятельно добывали знания,
Слайд 9Типы заданий.
Терминологические диктанты: вставить пропущенные в тексте термины, дать определения перечисленным
Задания на классификацию: составить классификацию объектов, признаков, процессов, свойств по значимому основанию, определить значимое основание или принцип предложенной классификации, дополнить классификацию примерами и т.д.
Задания на интерпретацию текста в графическое изображение: схему, таблицу или слайд, презентацию.
Задания на сравнения и сопоставление: сравнивая отдельные объекты или группы организмов, найти сходства и отличия, выделить признаки для сравнения или сопоставления.
Слайд 10Характер задания - репродуктивный.
Задание 1. Выпишите схемы, отражающие правильное распределение электронов
Слайд 11Частично-поисковый характер
Задание 2. Выпишите схемы распределения электронов в атомах элементов, оксиды
4) 2,4
Слайд 12Характер деятельности – преимущественно эвристический.
Задание 3. Выпишите схемы распределения электронов в
1) 2,8,2 2) 2,8,8,1 3) 2,7 4) 2,6
Слайд 13деятельность включает элементы исследования.
Задание 4. Три элемента принадлежат к одной группе
Слайд 14Кейс №1
В 1825 году был получен металл, который ценился дороже золота.
Слайд 15КАРТА ДОМАШНЕГО ЗАДАНИЯ
Химические формулы веществ
1
ZnCl2, NaNO3, Ca(OH)2, H2SO4, Al(OH)3, KOH, NaCl,
2
Al2(SO4)3, K2CO3, KOH, HCl, Ba(OH)2, Zn(OH)2, AlCl3, H2SiO3, HF
Слайд 16Деятельностный подход позволяет учителю изучать с учащимися основную часть нового материала
Технология деятельностного подхода оптимально сочетается с ИКТ, на уроке можно использовать компьютерные программы и учебные электронные пособия:
Уроки химии « Кирилла и Мефодия» (8-11 классы)
« Химия 8 – 11 классы» виртуальная лаборатория (2004 г)
видеодемонстрации опытов.
« 1с: Репетитор» – химия
собственные презентации.
Применение деятельностного подхода совместно с компьютерными технологиями способствует повышению интереса к изучению химии и помогает добиться лучших результатов.
Слайд 17В методике данного подхода предполагается, что тему урока учитель не сообщает,
Это основная задача этапа урока «Мотивация»
Какими же методами и приемами можно воспользоваться?
Например, можно
Показать картинку…..
Слайд 18Какие ассоциации вызывает у вас эта картинка?
Почему лимон кислый?
Попробуйте назвать тему
КИСЛОТЫ
Слайд 19Вставьте в текст пропущенные слова:
1 Элемент находится в 3 периоде, 7
2 Этот элемент хлор.
3 Порядковый номер хлора № 17.
4 В атоме хлора 17 протонов и 17 электронов.
5 На внешнем уровне у атома хлора 7 электронов
6 Из строения атома следует, что элемент хлор типичный неметалл.
7 Атом хлора образует простое вещество с формулой Cl 2
8 Вещество хлор по физическим свойствам – газ желто- зеленого цвета, ядовит.
9 По химическим свойствам хлор активно окисляет многие металлы и неметаллы, реагирует со сложными веществами
10 Хлор и его соединения применяют для дезинфекции помещений.
Из вставленных вами слов сформулируйте тему урока.
Тема урока: Хлор; строение атома, физические и химические свойства, применение.
Слайд 20Можно поставить проблему с помощью эксперимента:
Опыт №1.
Железо+ нитрат меди=
Действие:
Опыт №2
Цинк+ нитрат меди=
Действие: Наблюдение:
Что объединяет эти два опыта?
Тема урока: « Взаимодействие металлов с растворами солей»
Слайд 22HCl HClO4
HCl
HCl HClO4
HCl
HClO4
HF
H2SO4
H3PO4
H2CO3
HNO3
HBr
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
Слайд 23 Рассмотрите формулы кислот и ответьте на вопрос: как можно
Обратите внимание на то, сколько атомов водорода может быть в кислоте. составьте схему классификации кислот по этим двум признакам.
Слайд 24Сравните схему с той, которую составили вы сами:
Кислоты
По наличию атомов кислорода
По
кислородные
бескислородные
трехосновные
двухосновные
одноосновные
Слайд 25Как вы думаете, можно ли отличить кислоты от других веществ, например,
Какие индикаторы вы знаете ?
Как они изменяют окраску в растворах щелочей ?
Подумайте, будут ли изменять окраску индикаторы в растворах кислот ?
Слайд 26Проведем небольшое исследование.
Какова его цель?
-
Проверить, как изменяют окраску индикаторы в
Слайд 27Заполните таблицу:
Сделайте вывод:
Независимо от вида кислоты, индикаторы изменяют свой цвет одинаково,
Слайд 28Программа по химии предусматривает развития умения решать задачи,
Для наших учащихся это
Поэтому первое, чему мы учимся, это решать задачи по алгоритму.
Например, алгоритм нахождения массовой доли растворенного вещества:
Последовательность действий:
1. Прочитайте текст задачи.
2. Запишите кратко условие задачи и требование с помощью общепринятых обозначений.
3 Составьте формулу расчета массовой доли растворенного вещества. 4. Рассчитайте массу раствора по формуле: m(р-ра)=m(в-ва) + m(воды);
5. Вычислите массовую долю растворенного вещества по формуле.
6. Запишите ответ.
Слайд 29Завершает урок рефлексия. Формы проведения рефлексии могут быть различными, например:
Вырази свое
Задай вопрос , который остался невыясненным в ходе изучения нового материала.
Тест. Я знаю ( умею), я не знаю ( не умею).
Составление кластера.
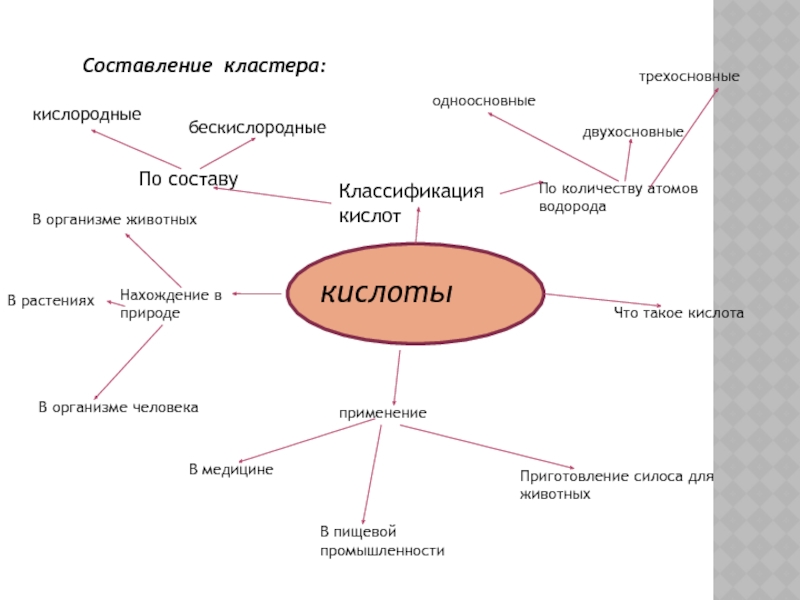
Слайд 30Составление кластера:
кислоты
Классификация
кислот
По составу
кислородные
бескислородные
По количеству атомов водорода
одноосновные
двухосновные
трехосновные
применение
В медицине
В пищевой промышленности
Приготовление силоса
Нахождение в природе
В организме животных
В организме человека
В растениях
Что такое кислота
Слайд 31Сегодня на уроке я:
-Научился…………
-Мне показалось важным…….
-Я понял, что………..
-Я почувствовал, что…….
Своей работой
-Доволен…..
-Не совсем доволен….
-Я не доволен потому, что…..
Слайд 32Синквейн- способ творческой рефлексии в виде «стихотворения», написанного по определенным правилам:
1
2 строка – два прилагательных;
3 строка – три глагола;
4 строка – крылатая фраза;
5 строка – одно существительное, которое выражает суть.
Например:
1 – водород;
2 – бесцветный, легкий.
3 – реагирует, восстанавливает, сгорает;
4 – в смеси с кислородом взрывоопасен;
5 – газ.
Далее следует взаимоопрос. Учащимся предлагается сформулировать по теме 3 вопроса. Затем они опрашивают друг друга.
Слайд 33Изменения, вносимые в образовательный процесс оказывают огромное влияние на ученика:
повышается
растет успеваемость;
учащиеся могут проявить себя в новой роли;
вырабатывается устойчивый навык к самостоятельной деятельности;
создается ситуация успеха;
урок работает на конкретного ученика, так как он работает в темпе, который оптимален для него.