Сера и ее соединения
(подготовка к ЕНТ)
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Сера и ее соединения (9-11 классы)
Содержание
- 1. Презентация Сера и ее соединения (9-11 классы)
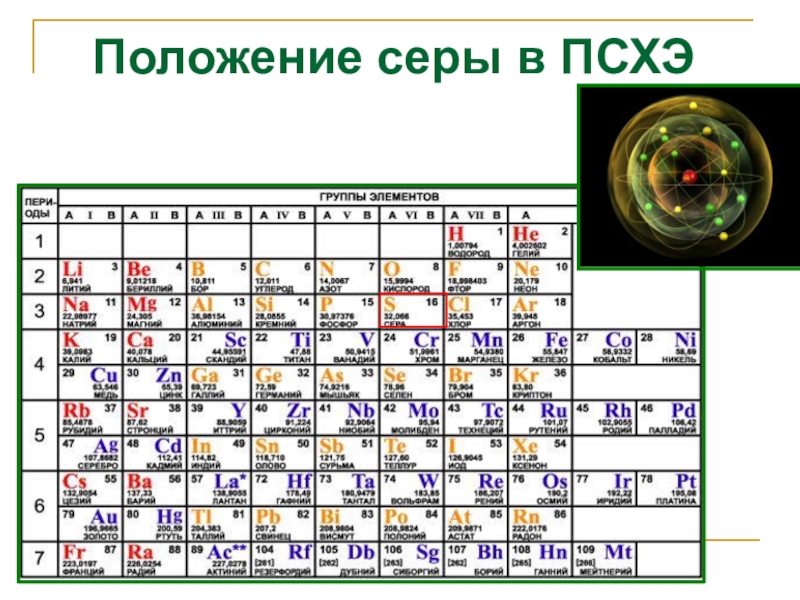
- 2. Положение серы в ПСХЭ
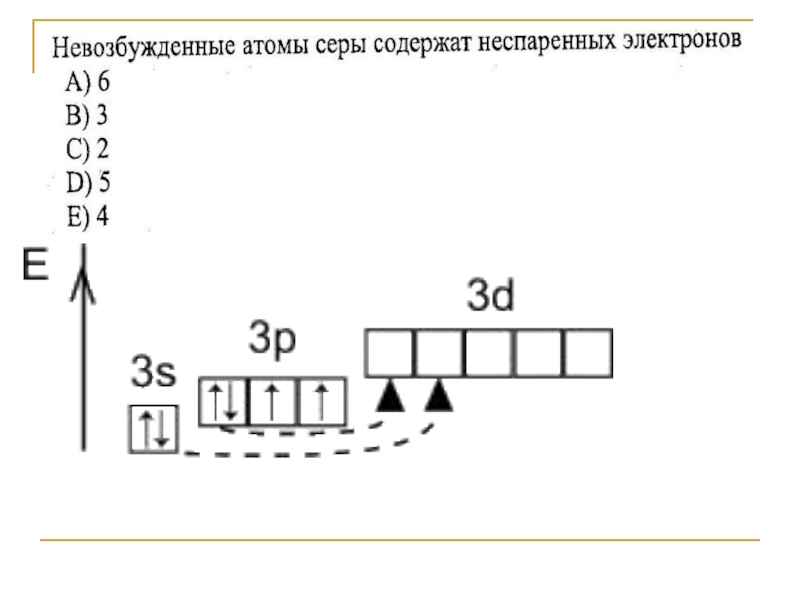
- 3. Строение атома серы
- 4. Окислительно-восстановительные свойства S-2 ⇄ S0 ⇄ S+4
- 5. *В свободном виде (самородная сера).*В виде соединений:
- 6. Самородная сера, серный колчедан FeS2, медный колчедан
- 7. Физические свойства серыАгрегатное состояние ТВЕРДОЕ
- 8. Сера ромбическаяСера пластическая
- 9. Аллотропия серы При нагревании ромбическая сера превращается
- 10. Реагирует с неметаллами (искл. азот N2 и
- 11. Реагирует с металлами (искл. золото Аu, платина
- 12. Реагирует со сложными веществами: S +
- 13. Получение серы1. Неполное окисление сероводорода: 2H2S
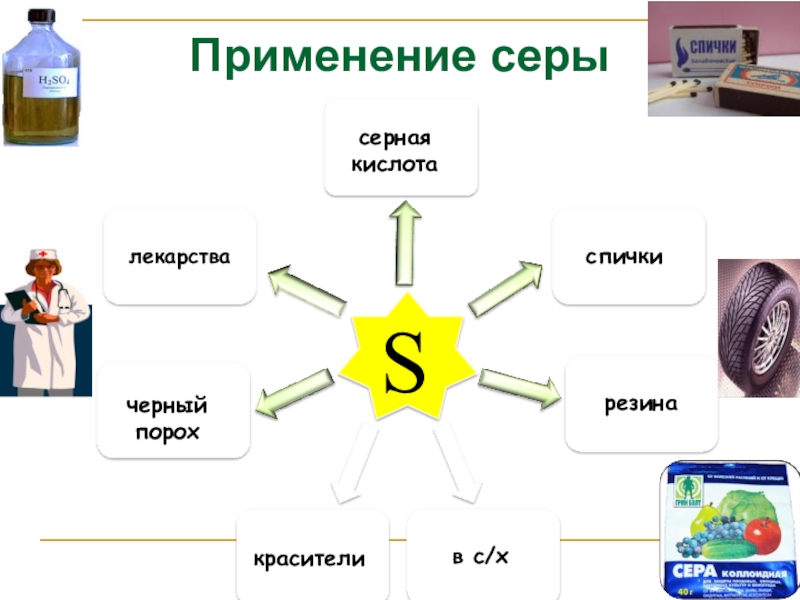
- 14. Применение серы
- 15. СероводородБесцветный газ с запахом тухлых яиц, тяжелее
- 16. Взаимодействие H2S с водойРаствор H2S в воде
- 17. .H2S + Ме, основные оксиды, основания: H2S + 2NaOH
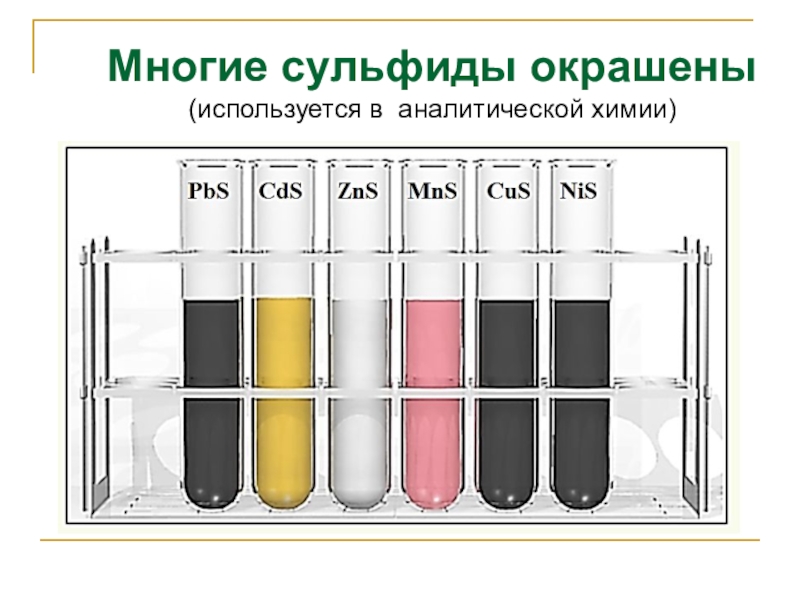
- 18. Многие сульфиды окрашены (используется в аналитической химии)
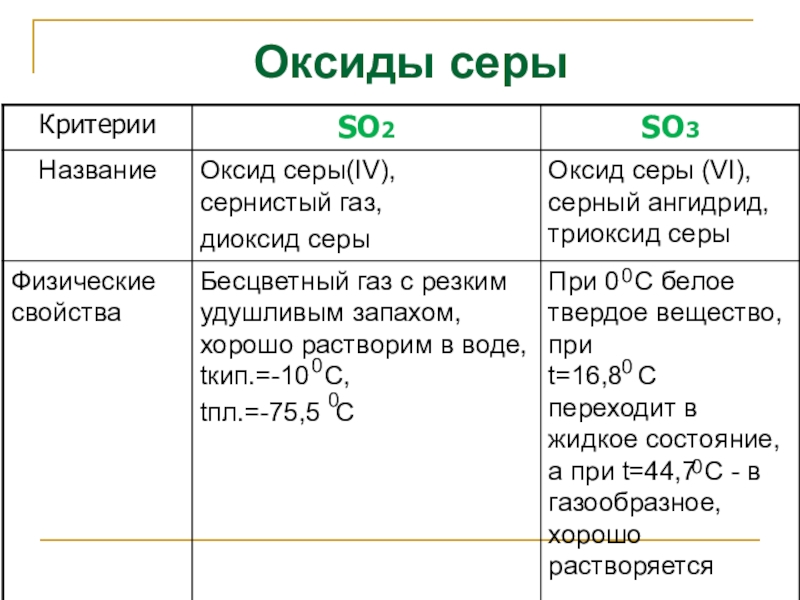
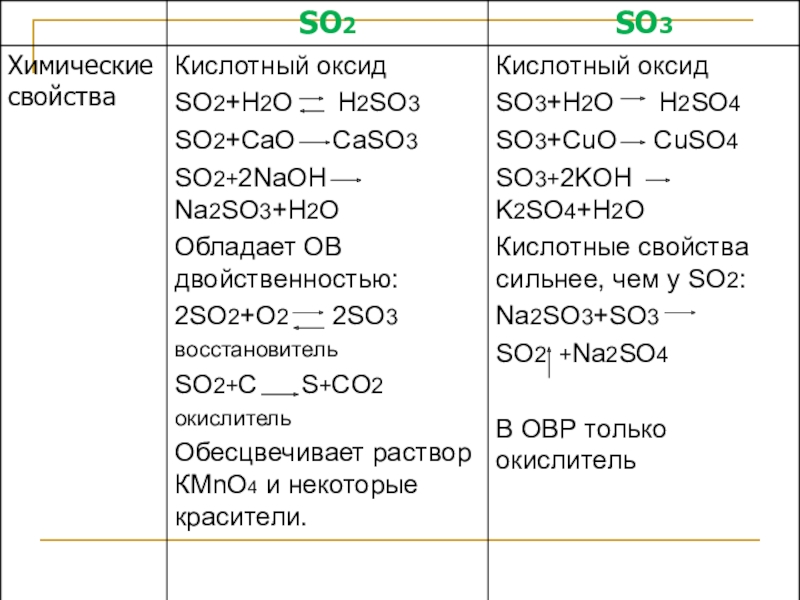
- 19. Оксиды серы0 0000
- 20. Слайд 20
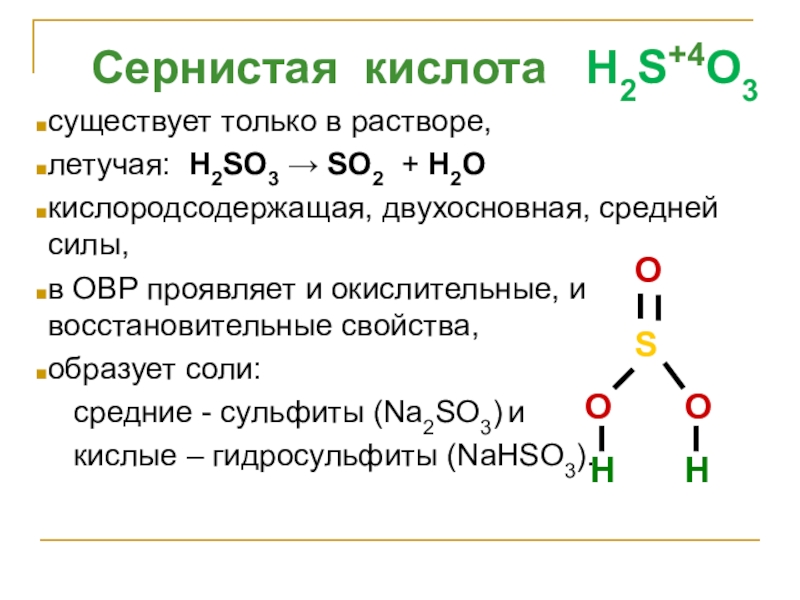
- 21. Сернистая кислота H2S+4O3существует только в
- 22. бесцветная, маслянистая, тяжелая жидкость, без запаха,обладает гигроскопическим
- 23. S, H2S, FeS2 → SO2 → SO3
- 24. 1. Диссоциация H2SO4 ⇄ H+ + НSO4-
- 25. 4. H2SO4 с основаниями H2SO4+2NaOH = Na2
- 26. Взаимодействие H2SO4 с металлами разб.H2SO4 + Cu
- 27. C12H22O11(сахароза)+H2SO4 →12С(уголь) +H2SO4 *11H2OОрганические вещества обугливаются !!!C
- 28. Применение серной кислоты- в производстве минеральных удобрений;-
- 29. Слайд 29
- 30. Сумма всех электронов (SO3)= 16+8*3= 40 Сумма всех электронов (Н2SO4)= 1*2+16+8*4= 50
- 31. Слайд 31
- 32. S+ Ме S+ НеМе S в воде не растворяется, не смачивается
- 33. S-2 → только восстановители S0 → окислители,
- 34.
- 35. H2SO4 ⇄ H+ + НSO4-
- 36. Са(ОН)2 ⇄ СаОН+ + ОН- 2Са(ОН)2
- 37. Серная кислота реагирует с металлами (до Н), основными и амфотерными оксидами, основаниями. Ответ: А.
- 38. 2H2SO4 +
- 39.
- 40. Обжиг пирита 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
- 41. гипс CaSO4∙2H2O
- 42. Н2S → SО2 → SО3 → Н2SО4 → SО2
- 43.
- 44.
- 45. Желаю качественной подготовки и успешной сдачи ЕНТ!
Слайд 1
Куприянова И.В.,
учитель химии
школы КГУ «НИСЦ РО «Восток»
Слайд 4Окислительно-восстановительные свойства
S-2 ⇄ S0 ⇄ S+4 ⇄ S+6
S-2 → только
S0 → окислители, восстановители
S+4 → окислители, восстановители
S+6 → только окислители
Слайд 5*В свободном виде (самородная сера).
*В виде соединений: органических и неорганических (сульфиды
*В составе каменного угля, нефти и газа.
Сера в природе
Слайд 6
Самородная сера,
серный колчедан FeS2, медный колчедан CuFeS2,
свинцовый блеск PbS
Ангидрит CaSO4,
гипс CaSO4∙2H2O и
гипс пластинчатый
Слайд 7Физические свойства серы
Агрегатное состояние
ТВЕРДОЕ КРИСТАЛЛИЧЕСКОЕ
Цвет ЖЕЛТЫЙ
Запах БЕЗ
Растворимость в воде
НЕ РАСТВОРЯЕТСЯ
Растворимость в сероуглероде
ХОРОШО РАСТВОРЯЕТСЯ
Теплопроводность НЕТ
Электропроводность НЕТ
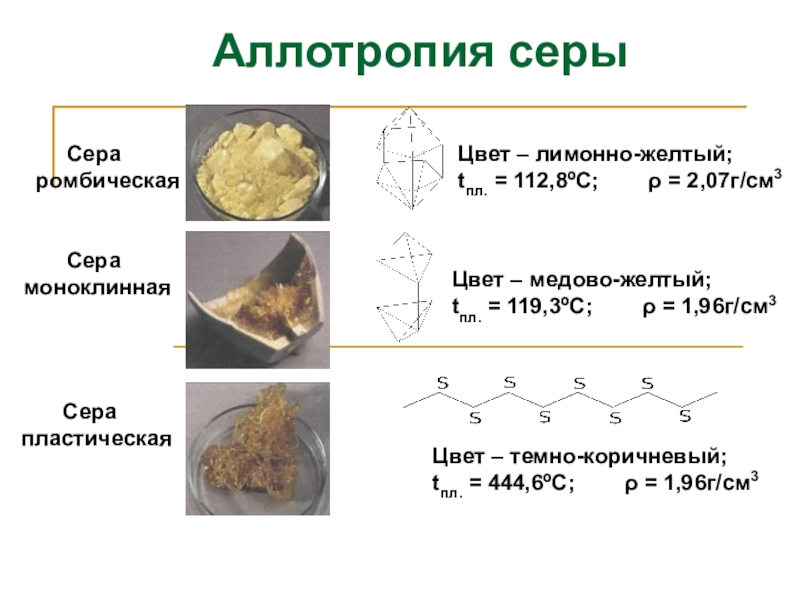
Слайд 8 Сера
ромбическая
Сера
пластическая
Цвет – лимонно-желтый;
tпл. = 112,8ºС; ρ = 2,07г/см3
Цвет – медово-желтый;
tпл. = 119,3ºС; ρ = 1,96г/см3
Цвет – темно-коричневый;
tпл. = 444,6ºС; ρ = 1,96г/см3
Аллотропия серы
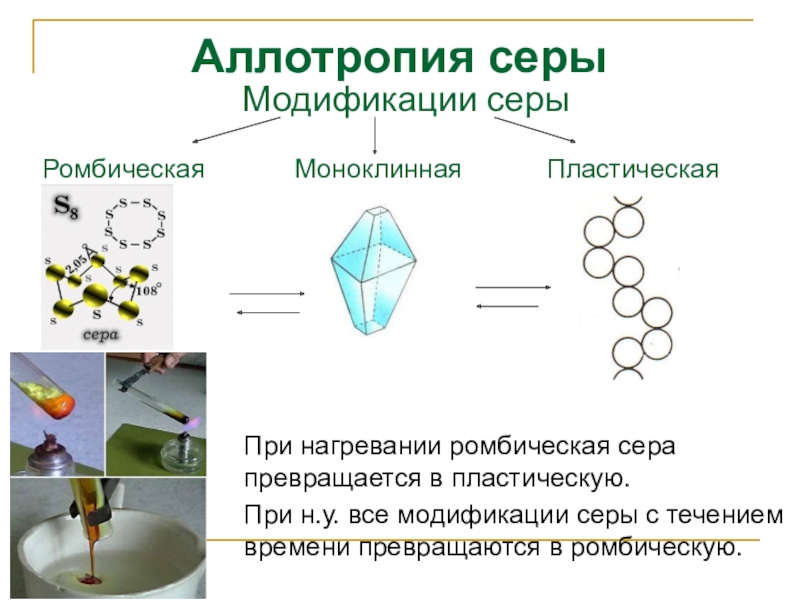
Слайд 9Аллотропия серы
При нагревании ромбическая сера превращается в пластическую.
При н.у.
Модификации серы
Ромбическая
Моноклинная
Пластическая
Слайд 10Реагирует с неметаллами
(искл. азот N2 и иод I2):
S
оксид серы (IV)
H2 + S = H2S
сероводород
Химические свойства серы
Слайд 11Реагирует с металлами
(искл. золото Аu, платина Рt):
2Na +
Fe + S = FeS
2Al + 3S = Al2S3
Нg + S = HgS
(демеркуризация)
Химические свойства серы
Слайд 12Реагирует со сложными веществами:
S + 2H2SO4(конц.) = 3SO2 +
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
3S + 2KClO3 = 2KCl + 3SO2;
Химические свойства серы
Слайд 13Получение серы
1. Неполное окисление сероводорода:
2H2S + O2 = 2S↓
2. 2H2S + SO2 = 3S↓ + 2H2O
3. SO2 + 2С = 2СО + S↓
Слайд 15Сероводород
Бесцветный газ с запахом тухлых яиц,
тяжелее воздуха, яд
Получение
1) H2 + S →
2) FeS + 2HCl → H2S↑ + FeCl2
Горение
Полное сгорание (при избытке O2)
2H2S-2 + 3O2 → 2S+4O2 + 2H2O
Неполное сгорание (недостаток O2)
2H2S-2 + O2 → 2S0 + 2H2O
Слайд 16 Взаимодействие H2S с водой
Раствор H2S в воде – слабая двухосновная кислота
Диссоциация происходит в две ступени:
I ст. H2S⇄ H+ + HS- (гидросульфид -ион)
II ст. HS- ⇄ H+ + S2- (сульфид-ион)
Средние соли (сульфиды):
Na2S – сульфид натрия
CaS – сульфид кальция
Кислые соли (гидросульфиды):
NaHS – гидросульфид натрия
Ca(HS)2 – гидросульфид кальция
Слайд 17.
H2S + Ме, основные оксиды, основания:
H2S + 2NaOH изб. → Na2S + 2H2O
H2S изб. + NaOH → NaHS + H2O
гидросульфид
натрия
Кислотные свойства сероводородной кислоты
Качественная реакция на сульфид-ион
Н2S + Pb(NO3)2 → PbS↓ + 2HNO3
Pb2+ + S2- → PbS↓ черный
Слайд 21 Сернистая кислота H2S+4O3
существует только в растворе,
летучая: H2SO3 →
кислородсодержащая, двухосновная, средней силы,
в ОВР проявляет и окислительные, и восстановительные свойства,
образует соли:
средние - сульфиты (Na2SO3) и
кислые – гидросульфиты (NaНSO3).
S
O
O
O
H
H
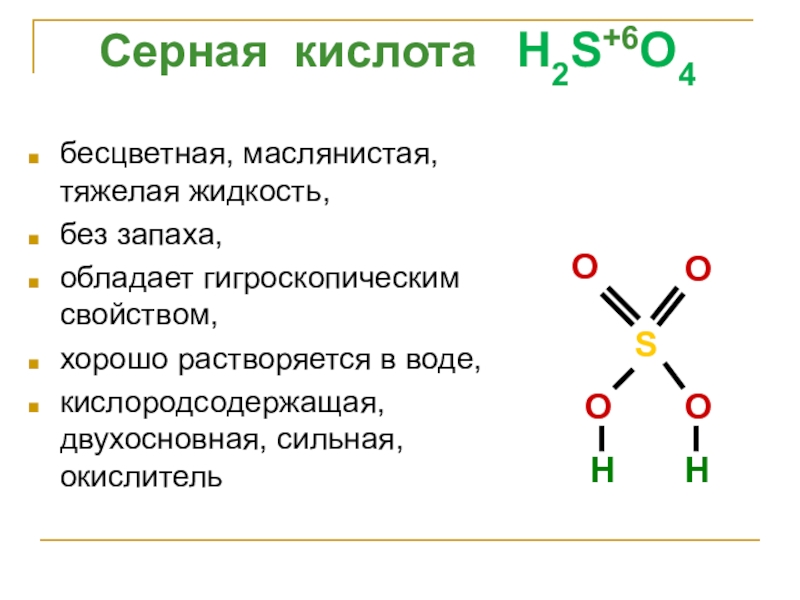
Слайд 22бесцветная, маслянистая, тяжелая жидкость,
без запаха,
обладает гигроскопическим свойством,
хорошо растворяется в воде,
кислородсодержащая,
Серная кислота H2S+6O4
S
O
O
O
O
H
H
Слайд 23S, H2S, FeS2 → SO2 → SO3 → H2SO4
1-я стадия. Печь
Получение оксида серы (II) : 4FeS2 + 11O2 2Fe2O3 + 8SO2 + Q
2-я стадия. Получение серного ангидрида (450°С - 500°С; кат. V2O5):
2SO2 + O2 ⇄ 2SO3
3-я стадия. Поглотительная башня:
Получение олеума
nSO3 + H2SO4(конц) (H2SO4 ·nSO3)(олеум)
Получение серной кислоты
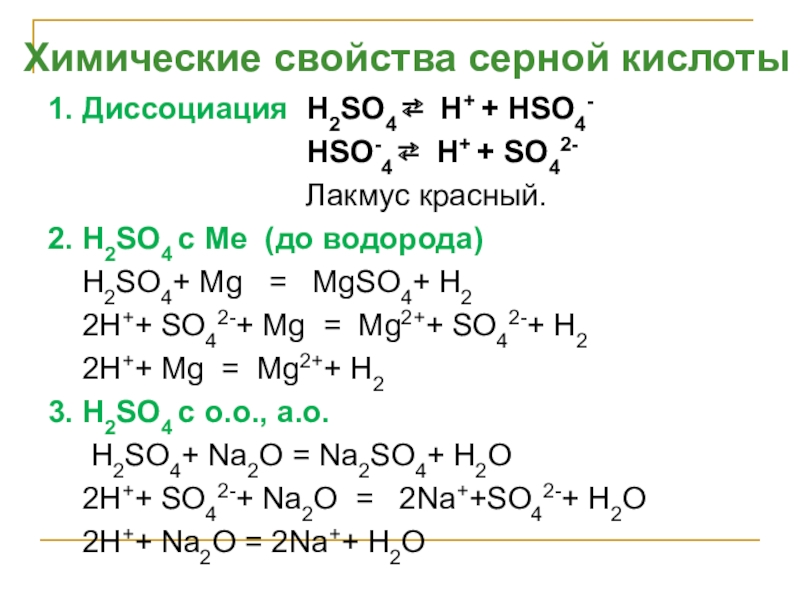
Слайд 241. Диссоциация H2SO4 ⇄ H+ + НSO4-
Лакмус красный.
2. H2SO4 с Ме (до водорода)
H2SO4+ Mg = MgSO4+ H2
2H++ SO42-+ Mg = Mg2++ SO42-+ H2
2H++ Mg = Mg2++ H2
3. H2SO4 с о.о., а.о.
H2SO4+ Na2O = Na2SO4+ H2O
2H++ SO42-+ Na2O = 2Na++SO42-+ H2O
2H++ Na2O = 2Na++ H2O
Химические свойства серной кислоты
Слайд 254. H2SO4 с основаниями
H2SO4+2NaOH = Na2 SO4+ 2H2O
2H+ +
2H+ + 2OH- = 2H2O
5. H2SO4 с солями
H2SO4 + CaCO3 = CaSO4+ H2O + CO2
2H++ SO42- + CaCO3 = CaSO4 + H2O + CO2
Качественная реакция на сульфат-ион
H2SO4 + BaCl2 = BaSO4 + 2HCl
2H++ SO42-+ Ba 2+ +2Cl- = BaSO4 + 2H+ + 2Cl-
SO42-+ Ba 2+ = BaSO4 белый молочный осадок
Химические свойства серной кислоты
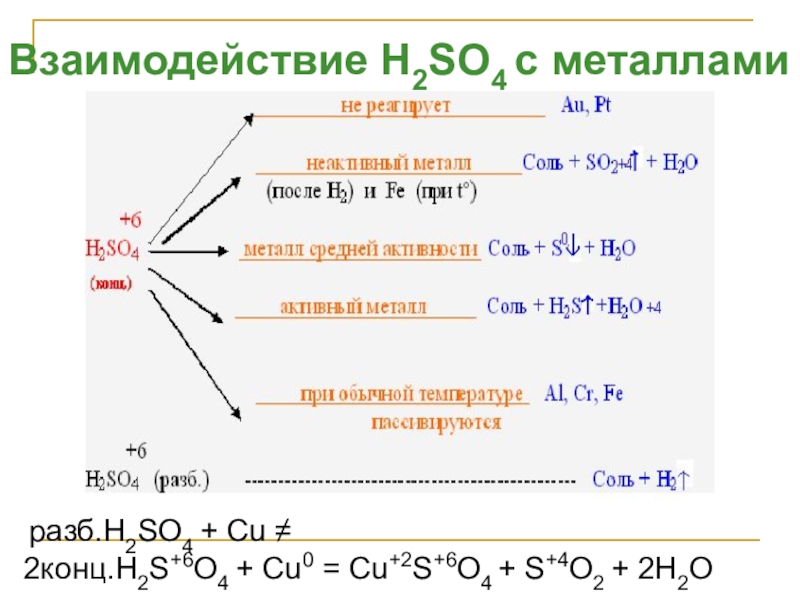
Слайд 26Взаимодействие H2SO4 с металлами
разб.H2SO4 + Cu ≠
2конц.H2S+6O4 + Cu0
Слайд 27C12H22O11(сахароза)+H2SO4 →12С(уголь) +H2SO4 *11H2O
Органические вещества обугливаются !!!
C + 2H2SO4 = CO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Свойства конц. H2SO4
Слайд 28Применение серной кислоты
- в производстве минеральных удобрений;
- как электролит в свинцовых
- в металлургии при прокате стали;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в текстильной, кожевенной отраслях промышленности;
- в металлообрабатывающей промышленности;
- используется как осушитель воздуха;
- в нефтяной промышленности;
- в пищевой промышленности;
- в промышленном органическом синтезе в реакциях.