: Бородина О.В.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Решение тренировочных упражнений по теме Электролиз 11 класс
Содержание
- 1. Презентация Решение тренировочных упражнений по теме Электролиз 11 класс
- 2. Цель: - подготовить обучающихся к решению заданий
- 3. ПовторимЭлектролиз-Катод -Анод -
- 4. Проверь себяЭлектролиз – это окислительно – восстановительные
- 5. Повторим
- 6. Процессы, протекающие на электродах при электролизе расплавов
- 7. разминкаП р и м е р 1.
- 8. ответВ соответствии с правилами разрядки катионов для
- 9. П р и м е р 2.
- 10. Вначале следует отбросить заведомо неверные варианты ответов
- 11. Установите соответствие между формулой соли и схемой
- 12. Вначале следует исключить вариант 3, т.к. это
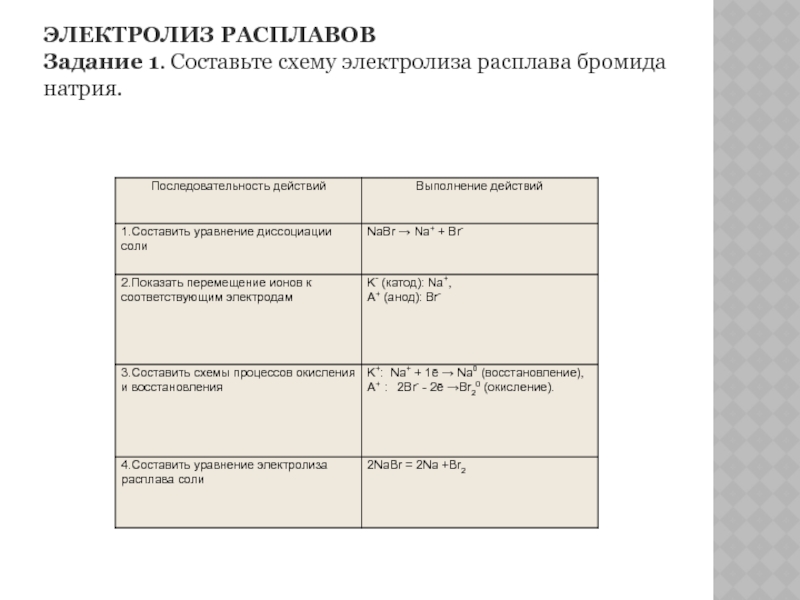
- 13. ЭЛЕКТРОЛИЗ РАСПЛАВОВ Задание 1. Составьте схему электролиза расплава бромида натрия.
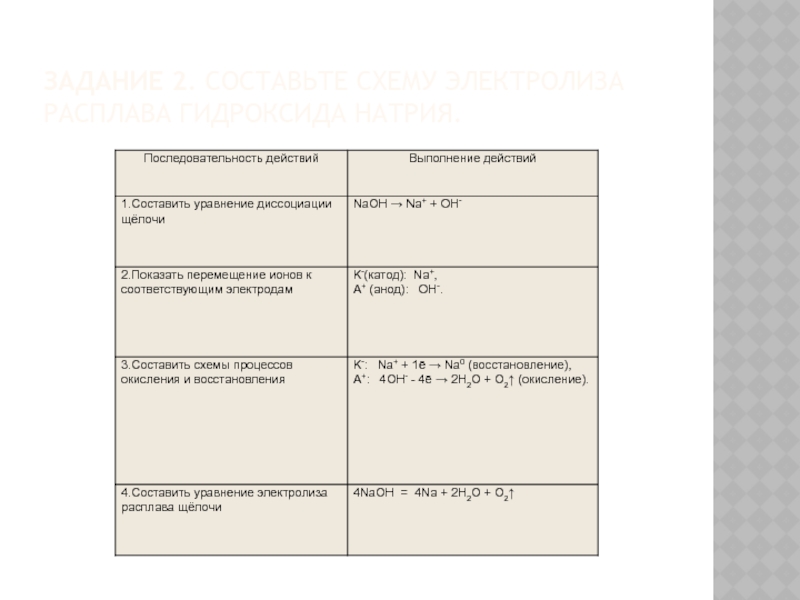
- 14. Задание 2. Составьте схему электролиза расплава гидроксида натрия.
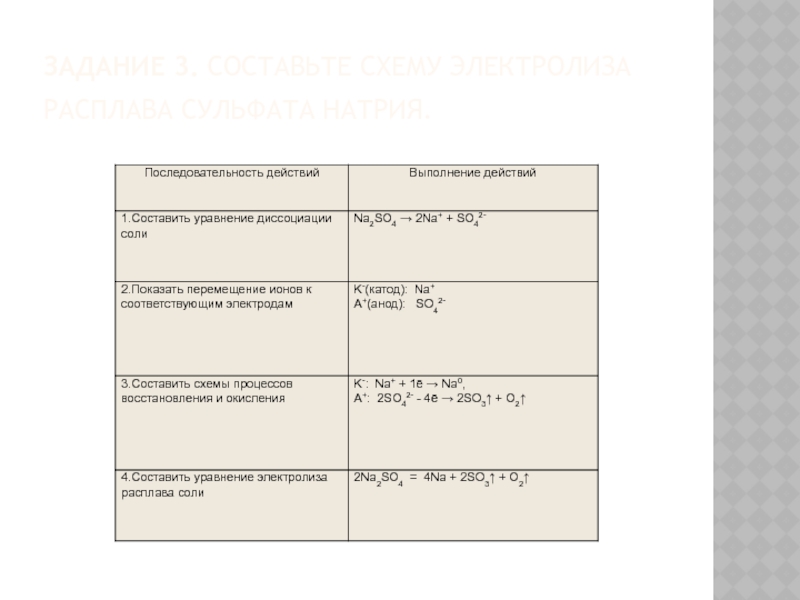
- 15. Задание 3. Составьте схему электролиза расплава сульфата натрия.
- 16. ЭЛЕКТРОЛИЗ РАСТВОРОВЗадание 1. Составить схему электролиза водного раствора хлорида натрия с использованием инертных электродов
- 17. Задание 2. Составить схему электролиза водного раствора сульфата меди (II) с использованием инертных электродов.
- 18. Задание 3. Составить схему электролиза водного раствора водного раствора гидроксида натрия с использованием инертных электродов.
- 19. Запомнить. При электролизе кислородсодержащих кислот (H2SO4 и др.) , оснований (NaOH, Ca(OH)2 и др.),
- 20. Задание 4. Составить схему электролиза водного раствора нитрата
- 21. Процессы, протекающие на электродах при электролизе растворов
- 22. Задача 11) При электролизе 240 г 14,9%-го
- 23. решениеЗапишем уравнение реакции: 2KCl + 2H2O =
- 24. Задача 2Электролиз 200 г 14%-го раствора хлорида
- 25. решениеЗапишем уравнения реакций: 2NaCl + 2H2O =
- 26. Домашнее заданиеСоставить схему электролиза водного раствора хлорида
- 27. Проверка к следующему урокуЗапишем уравнение электролиза: 2CuSO4
- 28. Спасибо за урок !
Цель: - подготовить обучающихся к решению заданий по теме «Электролиз» на ЕГЭЗадачи.Обучающие:-повторить тему «Электролиз»-повторить терминологию темы-повторить различия в электролизе расплавов и растворов электролитов-изучить правила протекания электролиза на аноде и катоде в растворах и расплавах электролитовРазвивающие:- показать
Слайд 2Цель:
- подготовить обучающихся к решению заданий по теме «Электролиз» на ЕГЭ
Задачи.
Обучающие:
-повторить
тему «Электролиз»
-повторить терминологию темы
-повторить различия в электролизе расплавов и растворов электролитов
-изучить правила протекания электролиза на аноде и катоде в растворах и расплавах электролитов
Развивающие:
- показать в сравнении электролиз расплавов и растворов электролитов
- подвести к пониманию практического значения электролиза
Воспитывающие:
- воспитание уважительного отношения к процессу познания, формирование устойчивых учебных навыков
-повторить терминологию темы
-повторить различия в электролизе расплавов и растворов электролитов
-изучить правила протекания электролиза на аноде и катоде в растворах и расплавах электролитов
Развивающие:
- показать в сравнении электролиз расплавов и растворов электролитов
- подвести к пониманию практического значения электролиза
Воспитывающие:
- воспитание уважительного отношения к процессу познания, формирование устойчивых учебных навыков
Слайд 4Проверь себя
Электролиз – это окислительно – восстановительные реакции, протекающие на электродах,
если через расплав или раствор электролита пропускают постоянный электрический ток.
Катод – восстановитель, отдаёт электроны катионам.
Анод – окислитель, принимает электроны от анионов.
Катод – восстановитель, отдаёт электроны катионам.
Анод – окислитель, принимает электроны от анионов.
Слайд 6Процессы, протекающие на электродах при электролизе расплавов
Не зависят от материала
электродов и природы ионов).
1. На аноде разряжаются анионы (Am-; OH-), превращаясь в нейтральные атомы или молекулы:
Am- - mē → A°;
4OH- - 4ē → O2↑ + 2H2O (процессы окисления).
2. На катоде разряжаются катионы (Men+, H+), превращаясь в нейтральные атомы или молекулы Men+ + nē → Me° ;
2H+ + 2ē → H20↑ (процессы восстановления).
1. На аноде разряжаются анионы (Am-; OH-), превращаясь в нейтральные атомы или молекулы:
Am- - mē → A°;
4OH- - 4ē → O2↑ + 2H2O (процессы окисления).
2. На катоде разряжаются катионы (Men+, H+), превращаясь в нейтральные атомы или молекулы Men+ + nē → Me° ;
2H+ + 2ē → H20↑ (процессы восстановления).
Слайд 7разминка
П р и м е р 1. Установите соответствие между формулой
вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора.
Формула вещества Продукт электролиза
А) CuSO4; 1) Водород;
Б) K2SO4; 2) серебро;
В) AgNO3; 3) медь;
Г) CuBr2. 4) гидроксид калия;
5) кислород;
6) оксид серы(IV).
Формула вещества Продукт электролиза
А) CuSO4; 1) Водород;
Б) K2SO4; 2) серебро;
В) AgNO3; 3) медь;
Г) CuBr2. 4) гидроксид калия;
5) кислород;
6) оксид серы(IV).
Слайд 8ответ
В соответствии с правилами разрядки катионов для указанных солей определяем соответствие:
А–3, Б–1, В–2, Г–3.
Ответ – 3123.
Ответ – 3123.
Слайд 9П р и м е р 2.
Установите соответствие между формулой
вещества и продуктом, образующимся на аноде в результате электролиза его водного раствора.
Формула вещества Продукт электролиза
А) CuSO4; 1) Фтор;
Б) KCl; 2) бром;
В) AgF; 3) хлор;
Г) CuBr2. 4) хлороводород;
5) кислород;
6) оксид серы(IV)
Формула вещества Продукт электролиза
А) CuSO4; 1) Фтор;
Б) KCl; 2) бром;
В) AgF; 3) хлор;
Г) CuBr2. 4) хлороводород;
5) кислород;
6) оксид серы(IV)
Слайд 10Вначале следует отбросить заведомо неверные варианты ответов из правого столбика. При
электролизе водных растворов на аноде не могут разряжаться фторид-ионы и выделяться хлороводород (варианты 1 и 4). В соответствии с правилами разрядки анионов для указанных солей определяем соответствие: А–5, Б–3, В–5, Г–2.
Ответ – 5352.
Ответ – 5352.
Слайд 11Установите соответствие между формулой соли и схемой процесса, протекающего на катоде
в результате электролиза ее водного раствора.
Формула соли Процесс, протекающий на катоде
А)Cu(NO3)2; 1) 2Н2О + 2е → Н2 +2ОН;
Б) MgBr2; 2) Cu2+ + 2е → Cu0;
В) NaCl; 3) 2Br– – 2е → Br20;
Г) HgCl2. 4) Mg2+ + 2е → Mg0;
5) Hg2+ + 2е → Hg0;
6) Na+ + е → Na0.
Формула соли Процесс, протекающий на катоде
А)Cu(NO3)2; 1) 2Н2О + 2е → Н2 +2ОН;
Б) MgBr2; 2) Cu2+ + 2е → Cu0;
В) NaCl; 3) 2Br– – 2е → Br20;
Г) HgCl2. 4) Mg2+ + 2е → Mg0;
5) Hg2+ + 2е → Hg0;
6) Na+ + е → Na0.
Слайд 12Вначале следует исключить вариант 3, т.к. это анодный процесс окисления. На
основании правил разрядки катионов устанавливаются соответствия: А–2, Б–1, В–1, Г–5. Ответ – 2115.
Слайд 16ЭЛЕКТРОЛИЗ РАСТВОРОВ
Задание 1. Составить схему электролиза водного раствора хлорида натрия с использованием
инертных электродов
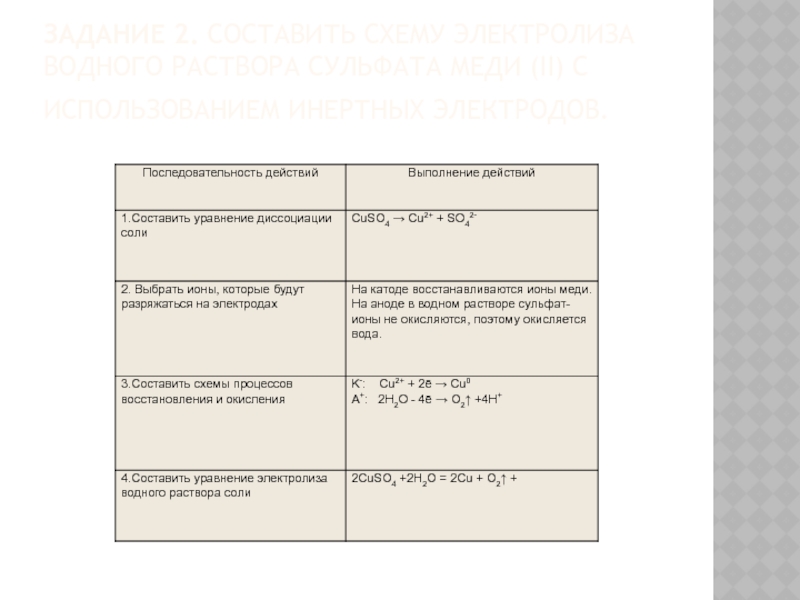
Слайд 17Задание 2. Составить схему электролиза водного раствора сульфата меди (II) с использованием
инертных электродов.
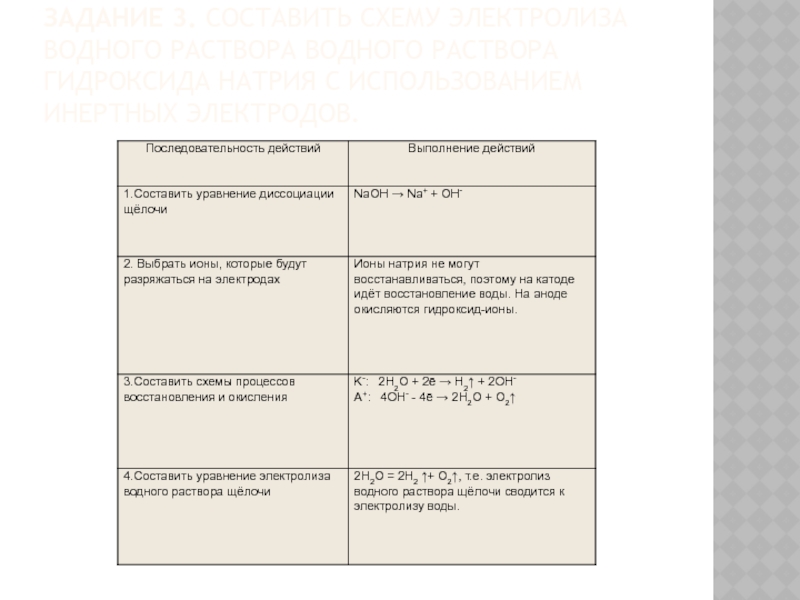
Слайд 18Задание 3. Составить схему электролиза водного раствора водного раствора гидроксида натрия с
использованием инертных электродов.
Слайд 19Запомнить.
При электролизе кислородсодержащих кислот (H2SO4 и др.) , оснований (NaOH, Ca(OH)2 и др.), солей активных металлов и
кислородсодержащих кислот (K2SO4 и др.) на электродах протекает электролиз воды: 2H2O = 2H2 ↑+ O2↑
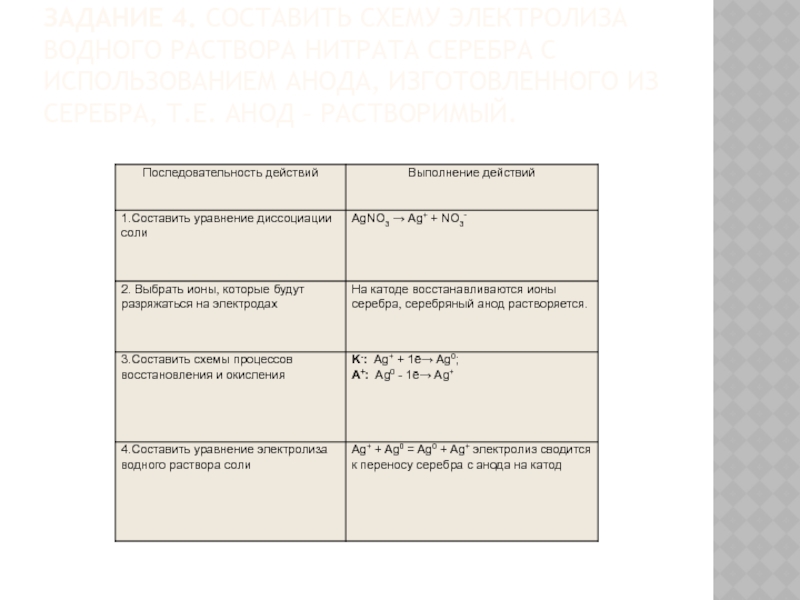
Слайд 20Задание 4. Составить схему электролиза водного раствора нитрата серебра с использованием анода,
изготовленного из серебра, т.е. анод – растворимый.
Слайд 22Задача 1
1) При электролизе 240 г 14,9%-го раствора хлорида калия на
аноде выделилось 4,48 л (н. у.) газа. Определите массовые доли веществ в образовавшемся растворе.
Слайд 23решение
Запишем уравнение реакции:
2KCl + 2H2O = 2KOH + H2 +
Cl2
m(KCl) = 240 ⋅ 0,149 = 35,76 г
n(KCl) = 35,76 : 74,5 = 0,48 моль
n(Cl2) = 4,48 : 22,4 = 0,2 моль
Если бы хлорид калия полностью подвергся электролизу, то количество выделившегося хлора составило бы 0,48 : 2 = 0,24 моль.
По условию n(Cl2) = 0,2 моль, то есть прореагировал не весь хлорид калия. Расчет по уравнению ведем по хлору. n(KOH) = 2n(Cl2) = 0,4 моль
m(KOH) = 0,4 ⋅ 56 = 22,4 г
n(KClразл.) = 2n(Cl2) = 0,4 моль
n(KClост.) = 0,48 – 0,4 = 0,08 моль
m(KClост.) = 0,08 ⋅ 74,5 = 5,96 г
mр-ра = mр-ра(KCl) – m(Cl2) – m(H2) = 240 – 0,2 ⋅ 71 – 0,2 ⋅ 2 = 225,4 г
ω(KOH) = 22,4 : 225,4 ⋅ 100% = 9,94% ω(KCl) = 5,96 : 225,4 ⋅ 100% = 2,64% Ответ: 9,94%; 2,64%
m(KCl) = 240 ⋅ 0,149 = 35,76 г
n(KCl) = 35,76 : 74,5 = 0,48 моль
n(Cl2) = 4,48 : 22,4 = 0,2 моль
Если бы хлорид калия полностью подвергся электролизу, то количество выделившегося хлора составило бы 0,48 : 2 = 0,24 моль.
По условию n(Cl2) = 0,2 моль, то есть прореагировал не весь хлорид калия. Расчет по уравнению ведем по хлору. n(KOH) = 2n(Cl2) = 0,4 моль
m(KOH) = 0,4 ⋅ 56 = 22,4 г
n(KClразл.) = 2n(Cl2) = 0,4 моль
n(KClост.) = 0,48 – 0,4 = 0,08 моль
m(KClост.) = 0,08 ⋅ 74,5 = 5,96 г
mр-ра = mр-ра(KCl) – m(Cl2) – m(H2) = 240 – 0,2 ⋅ 71 – 0,2 ⋅ 2 = 225,4 г
ω(KOH) = 22,4 : 225,4 ⋅ 100% = 9,94% ω(KCl) = 5,96 : 225,4 ⋅ 100% = 2,64% Ответ: 9,94%; 2,64%
Слайд 24Задача 2
Электролиз 200 г 14%-го раствора хлорида натрия продолжали до тех
пор, пока на катоде не выделилось 5,6 л (н. у.) газа. К раствору, полученному после электролиза, прилили избыток раствора нитрата серебра. Вычислите массовые доли веществ в образовавшемся при этом осадке.
Слайд 25решение
Запишем уравнения реакций: 2NaCl + 2H2O = 2NaOH + H2 +
Cl2
2NaOH + 2AgNO3 = Ag2O↓ + 2NaNO3 + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
m(NaCl) = 200 ⋅ 0,14 = 28 г
n(NaCl) = 28 : 40 = 0,7 моль
n(H2) = 5,6 : 22,4 = 0,25 моль
Если бы хлорид натрия полностью подвергся электролизу, то количество выделившегося водорода составило бы 0,7 : 2 = 0,35 моль.
По условию n(H2) = 0,25 моль, то есть прореагировал не весь хлорид натрия. Расчет по первому уравнению ведем по водороду.
n(NaOH) = 2n(H2) = 0,5 моль
n(NaClразл.) = 2n(H2) = 0,5 моль
n(NaClост.) = 0,7 – 0,5 = 0,2 моль
Вычислим массовые доли веществ в осадке. n(Ag2O) = 0,5n(NaOH) = 0,25 моль
m(Ag2O) = 0,25 ⋅ 232 = 58 г
n(AgCl) = n(NaClост.) = 0,2 моль
m(AgCl) = 0,2 ⋅ 143,5 = 28,7 г
ω(Ag2O) = 58 : (58 + 28,7) ⋅ 100% = 66,9%
ω(AgCl) = 28,7 : (58 + 28,7) ⋅ 100% = 33,1%
Ответ: 66,9%; 33,1%
2NaOH + 2AgNO3 = Ag2O↓ + 2NaNO3 + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
m(NaCl) = 200 ⋅ 0,14 = 28 г
n(NaCl) = 28 : 40 = 0,7 моль
n(H2) = 5,6 : 22,4 = 0,25 моль
Если бы хлорид натрия полностью подвергся электролизу, то количество выделившегося водорода составило бы 0,7 : 2 = 0,35 моль.
По условию n(H2) = 0,25 моль, то есть прореагировал не весь хлорид натрия. Расчет по первому уравнению ведем по водороду.
n(NaOH) = 2n(H2) = 0,5 моль
n(NaClразл.) = 2n(H2) = 0,5 моль
n(NaClост.) = 0,7 – 0,5 = 0,2 моль
Вычислим массовые доли веществ в осадке. n(Ag2O) = 0,5n(NaOH) = 0,25 моль
m(Ag2O) = 0,25 ⋅ 232 = 58 г
n(AgCl) = n(NaClост.) = 0,2 моль
m(AgCl) = 0,2 ⋅ 143,5 = 28,7 г
ω(Ag2O) = 58 : (58 + 28,7) ⋅ 100% = 66,9%
ω(AgCl) = 28,7 : (58 + 28,7) ⋅ 100% = 33,1%
Ответ: 66,9%; 33,1%
Слайд 26Домашнее задание
Составить схему электролиза водного раствора хлорида меди(II) на угольных электродах
Составить
схему электролиза водного раствора
сульфата натрия на платиновых электродах
Задача
Раствор сульфата меди массой 96 г с содержанием соли 10% подвергли полному электролизу. Через образовавшийся после этого раствор пропустили 1344 мл (н.у.) аммиака. Вычислите массовую долю соли в полученном растворе
сульфата натрия на платиновых электродах
Задача
Раствор сульфата меди массой 96 г с содержанием соли 10% подвергли полному электролизу. Через образовавшийся после этого раствор пропустили 1344 мл (н.у.) аммиака. Вычислите массовую долю соли в полученном растворе
Слайд 27Проверка к следующему уроку
Запишем уравнение электролиза:
2CuSO4 + 2H2O = 2Cu
+ O2 + 2H2SO4
m(CuSO4) = 96 ⋅ 0,1 = 9,6 г
n(CuSO4) = 9,6 : 160 = 0,06 моль
n(H2SO4) = n(CuSO4) = 0,06 моль
n(NH3) = 1,344 : 22,4 = 0,06 моль
n(H2SO4) : n(NH3) = 0,06 : 0,06 = 1 : 1 → реакция между ними идет с образованием кислой соли NH3 + H2SO4 = NH4HSO4
n(NH4HSO4) = 0,06 моль
m(NH4HSO4) = 0,06 ⋅ 115 = 6,9 г
mр-ра = mр-ра(CuSO4) – m(Cu) – m(O2) + m(NH3) = 96 – 0,06 ⋅ 64 – 0,03 ⋅ 32 + 0,06 ⋅ 17 = 92,22 г ω(NH4HSO4) = 6,9 : 92,22 ⋅ 100%7,48%
Ответ: 7,48%
m(CuSO4) = 96 ⋅ 0,1 = 9,6 г
n(CuSO4) = 9,6 : 160 = 0,06 моль
n(H2SO4) = n(CuSO4) = 0,06 моль
n(NH3) = 1,344 : 22,4 = 0,06 моль
n(H2SO4) : n(NH3) = 0,06 : 0,06 = 1 : 1 → реакция между ними идет с образованием кислой соли NH3 + H2SO4 = NH4HSO4
n(NH4HSO4) = 0,06 моль
m(NH4HSO4) = 0,06 ⋅ 115 = 6,9 г
mр-ра = mр-ра(CuSO4) – m(Cu) – m(O2) + m(NH3) = 96 – 0,06 ⋅ 64 – 0,03 ⋅ 32 + 0,06 ⋅ 17 = 92,22 г ω(NH4HSO4) = 6,9 : 92,22 ⋅ 100%7,48%
Ответ: 7,48%