- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Подгруппа кислорода 8 класс
Содержание
- 1. Презентация Подгруппа кислорода 8 класс
- 2. ПланТаблицаПодгруппа кислородаКислородПолучение кислородаСераПрименение серы
- 3. Слайд 3
- 4. Подгруппа кислорода. В подгруппу кислорода входят кислород,
- 5. Водородные соединения элементов подгруппы кислорода отвечают формуле
- 6. Причина объединенияУ атомов халькогенов одинаковое строение внешнего
- 7. КислородКислород-второй по электроотрицательности элемент после фтора, поэтому он проявляет сильные окислительные свойства.
- 8. У атома кислорода на 2р-подуровне два неспаренных
- 9. Получение кислорода
- 10. При переходе в возбужденное состояние (что имеет
- 11. СераАтом серы, имея незавершенный внешний энергетический уровень,
- 12. Применение серыСера широко применяется в промышленности и
- 13. Естественный источник серной кислоты
ПланТаблицаПодгруппа кислородаКислородПолучение кислородаСераПрименение серы
Слайд 4Подгруппа кислорода.
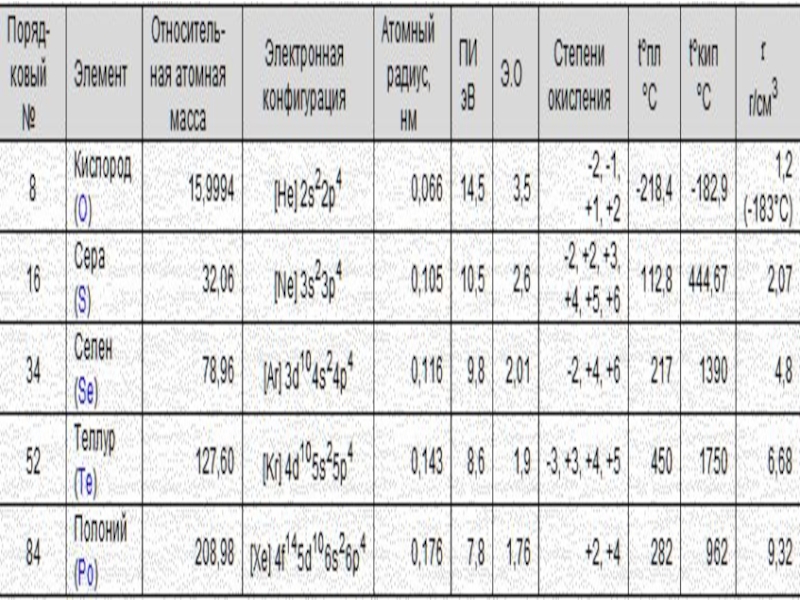
В подгруппу кислорода входят кислород, сера, селен, теллур, полоний.
Полоний - радиоактивный металл.
Это p-элементы периодической системы Д.И.Менделеева. Эти элементы носят название халькогены, то есть "образующие руды".
На внешнем электронном уровне атомы подгруппы кислороды имеют шесть атомов.
Слайд 5Водородные соединения элементов подгруппы кислорода отвечают формуле RH2, где R -
элемент (H2O, H2S, H2Se, H2Te). Устойчивость халькогеноводородных соединений уменьшается от O к Po . Им соответствуют кислоты H2RO3 и H2RO4. H2SO4 - сильная кислота, H2SeO3, H2TeO3 - слабые кислоты.
В подгруппе с увеличением порядкового номера увеличивается радиус атомов, уменьшается электроотрицательность, ослабляются неметаллические и усиливаются металлические свойства элементов.
Слайд 6Причина объединения
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4.
Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы.
Слайд 7Кислород
Кислород-второй по электроотрицательности
элемент после фтора, поэтому он проявляет сильные окислительные свойства. С большинством металлов он реагирует уже при комнатной температуре, образуя основные оксиды. С неметаллами
(за исключением гелия, неона, аргона) кислород реагирует, как правило, при нагревании. Так,с фосфором он реагирует при температуре ~ 60 °С, образуя Р2О5, с серой - при температуре около 250 °С:
Слайд 8У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не
могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н2О и ОF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии.
Слайд 10При переходе в возбужденное состояние (что имеет место при подводе энергии,
например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +2, +4 и +6.
Слайд 11Сера
Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона
и проявлять степень окисления -2. Такую степень окисления сера проявляет в соединениях с металлами и водородом (например, Na2S и Н2S). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6.
Слайд 12Применение серы
Сера широко применяется в промышленности и сельском хозяйстве. Около половины
ее добычи расходуется для получения серной кислоты. Используют серу для вулканизации каучука: каучук приобретает повышенную прочность и упругость. В виде серного цвета (тонкого порошка) сера применяется для борьбы с болезнями виноградника и хлопчатника. Она употребляется для получения пороха, спичек, светящихся составов. В медицине приготовляют серные мази для лечения кожных заболеваний.