- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по темеАзотная кислота
Содержание
- 1. Презентация по темеАзотная кислота
- 2. НЕМНОГО ИСТОРИИМонах-алхимик Бонавентура в 1270 году в
- 3. 2 FeSO4 · 7Н2О + 4 КNO3
- 4. АЗОТНАЯ КИСЛОТА
- 5. Слайд 5
- 6. HNO3 – азотная кислотаФизические свойства1. Молярная масса
- 7. ПолучениеЛабораторный способ: Действие конц. серной кислоты
- 8. Получение.Промышленный способ осуществляется
- 9. Слайд 9
- 10. 1) Изменяет цвет индикаторов (диссоциация)
- 11. Специфические свойства – взаимодействие с металламиЗАПОМНИ!При взаимодействии
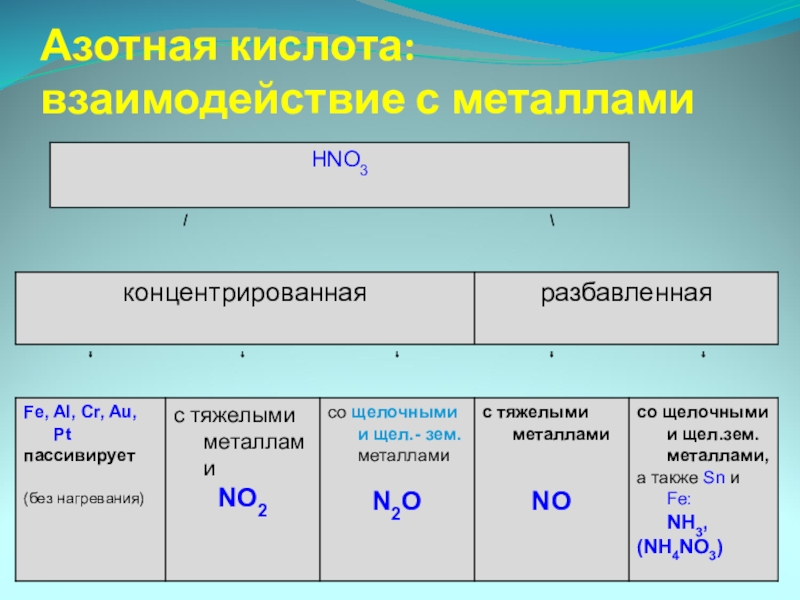
- 12. Азотная кислота: взаимодействие с металлами
- 13. Разбавленная
- 14. Концентрированная
- 15. Слайд 15
- 16. Действие на органические веществаБелки при взаимодействии с
- 17. Смесь концентрированных азотной и соляной
- 18. Качественная реакция на ион NO3- Вещество +
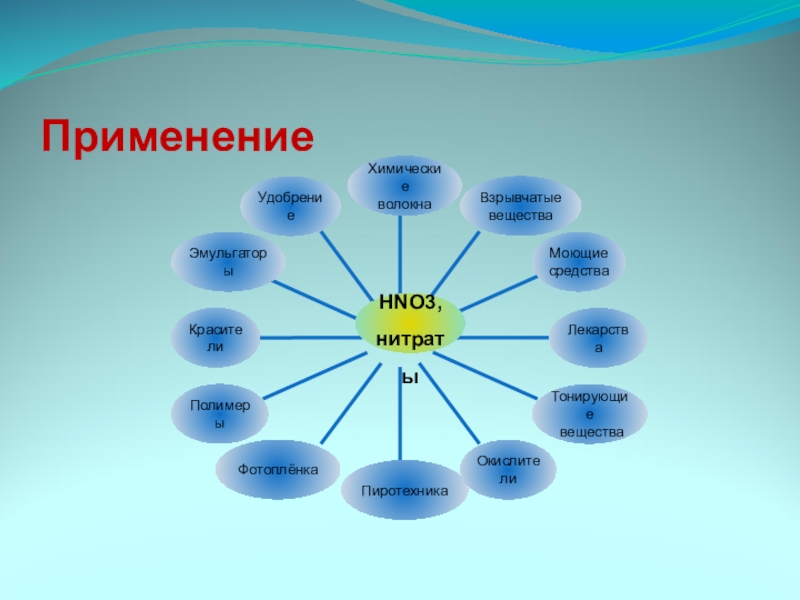
- 19. Применение
- 20. Игра «КРЕСТИКИ- НОЛИКИРаствор азотной кислоты реагирует с каждым из веществ.
- 21. Соли азотной кислоты называются нитратами (селитрами)NaNO3 – нитрат натрияCu(NO3)2 – нитрат меди(II)
- 22. Все нитраты термически неустойчивы. При нагревании они
- 23. РАЗЛОЖЕНИЕ НИТРАТОВ при нагревании:
Слайд 1- Это вещество было описано арабским химиком в VIII веке Джабиром
- Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
- Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола).
- Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1.
- Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
Слайд 2НЕМНОГО ИСТОРИИ
Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста»
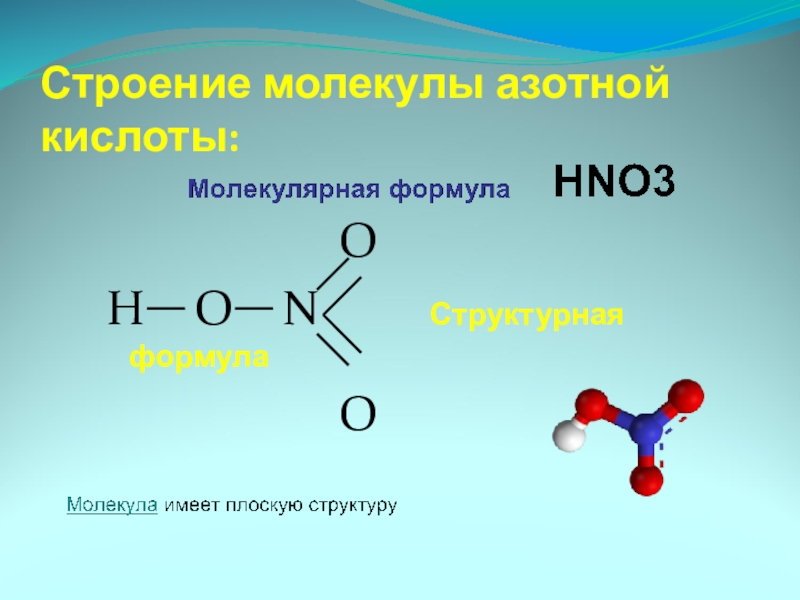
Слайд 6HNO3 – азотная кислота
Физические свойства
1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость
3. Хорошо растворима в воде (сильная одноосновная
кислота)
4. Молекула имеет
плоскую структуру
5.Валентность (N)=IV
6. Степень окисления (N)=+5
Слайд 7Получение
Лабораторный способ:
Действие конц. серной кислоты на кристаллические нитраты.
KNO3
Слайд 8Получение.
Промышленный способ осуществляется
1) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 = 4NO + 6H2O
2) Окисление кислородом воздуха NO до NO2
2NO + O2 = 2NO2
3) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O = 4HNO3
Слайд 101) Изменяет цвет индикаторов (диссоциация)
2) Взаимодействие с основными и амфотерными оксидами
CuO+2HNO3⭢
3) Взаимодействие с основаниями и аммиаком
KOH+HNO3⭢
NH3+HNO3⭢
4) Взаимодействие с солями
Na2CO3+2HNO3⭢
Общие с другими кислотами
Слайд 11Специфические свойства – взаимодействие с металлами
ЗАПОМНИ!
При взаимодействии азотной кислоты любой концентрации
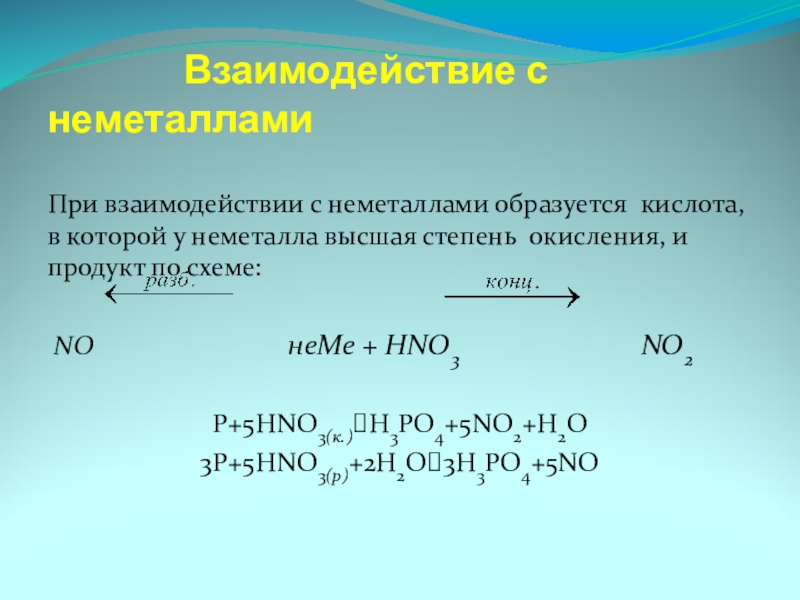
Слайд 15 Взаимодействие с неметаллами
При
NO неMe + HNO3 NO2
P+5HNO3(к.)⭢H3PO4+5NO2+H2O
3P+5HNO3(р)+2H2O⭢3H3PO4+5NO
Слайд 16Действие на органические вещества
Белки при взаимодействии с конц.азотной кислотой разрушаются и
Под действием азотной кислоты воспламеняются бумага, масло, древесина, уголь.
Слайд 17 Смесь концентрированных азотной и соляной кислот (соотношение по объему
Слайд 18Качественная реакция на ион NO3-
Вещество + медные стружки + H2SO4(к.)+ t0
4HNO3 + Cu = Cu(NO3)2 + 2 NO2 + 2H2O
бурый газ
Слайд 21Соли азотной кислоты
называются нитратами (селитрами)
NaNO3 – нитрат натрия
Cu(NO3)2 – нитрат
Слайд 22Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода.
Особое положение занимает нитрат аммония,
разлагающийся без твердого остатка:
NH4NO3 (кр.) → N2O + 2H2O.
Слайд 23РАЗЛОЖЕНИЕ НИТРАТОВ
при нагревании:
1) Нитраты щелочных металлов разлагаются
2NaNO3 = 2NaNO2 + O2
2) Нитраты менее активных металлов (от щелочноземельных до меди) разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
3) Нитраты малоактивных металлов разлагаются до металлов:
2AgNO3 = 2Ag + 2NO2 + O2
4) Нитрат аммония разлагаются до N2O
NH4NO3 = N2O + 2H2O