творческой из наук.
Г.Санников
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Железо и его соединения
Содержание
- 1. Презентация по теме Железо и его соединения
- 2. Загадка Очень древний я металл, Счёт
- 3. Слайд 3
- 4. Тема урока: «Железо.Физические и химические свойства»Девиз
- 5. «Чтобы переваривать знания, надо поглощать их с
- 6. Почему наш век называют железным?
- 7. Происхождение названия«Железо» произошло от санскритских слов «джальжа»
- 8. Охарактеризуйте положение железа в периодической
- 9. Положение в Периодической системе
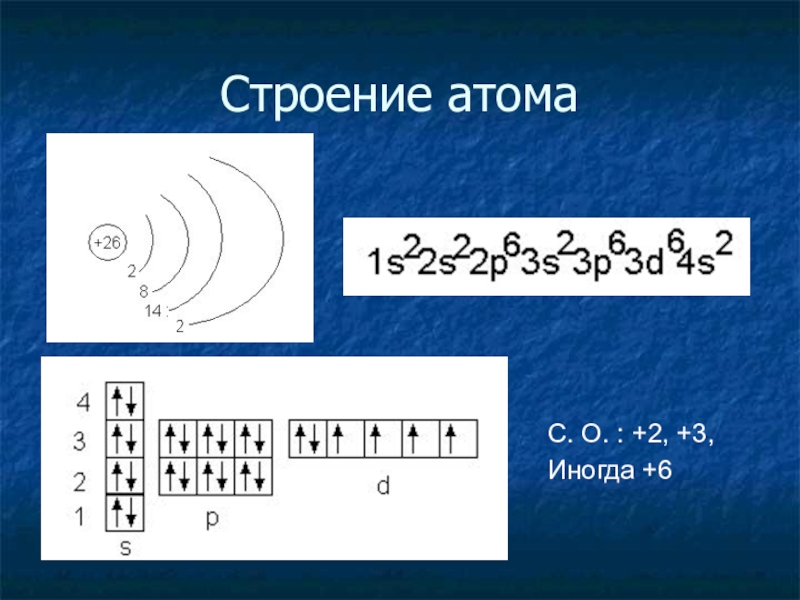
- 10. Строение атомаС. О. : +2, +3,Иногда +6
- 11. Состав атомаПротонов = 26Электронов = 26Нейтронов =56 – 26 =30
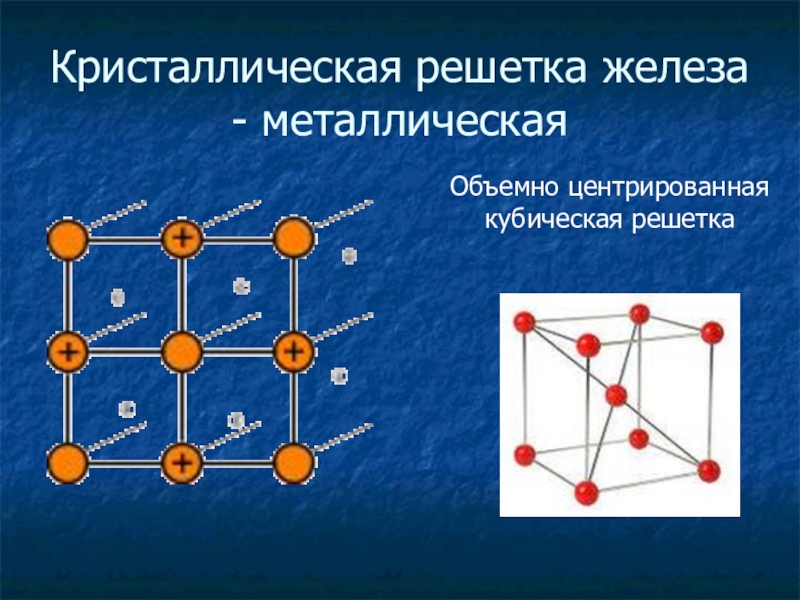
- 12. Кристаллическая решетка железа - металлическаяОбъемно центрированная кубическая решетка
- 13. Самостоятельная работаОпределите степени окисления железа в соединениях:1 ученик: FеСl3, FеSО4, Fе(ОН)2, 2 ученик: Fе(ОН)3, Fе2(SО4)3, FеВr2
- 14. Проверь себя!1 ученик: FеСl3 (+3), FеSО4 (+2),
- 15. Простое вещество - железо
- 16. Пользуясь учебником Габриеляна О.С. Химия 9
- 17. Физические свойства железаТвердоеСеро-серебристоеБлестящееХорошо проводит тепло и электрический
- 18. Нахождение в природеВ каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа.
- 19. Нахождение в природе
- 20. Химические свойстваВспомните общие свойства металлов и предположите,
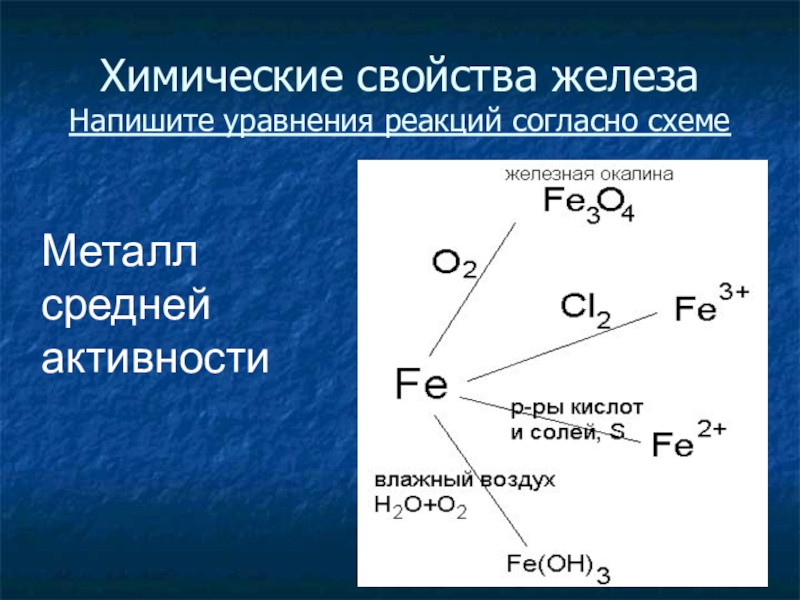
- 21. Химические свойства железа Напишите уравнения реакций согласно схемеМеталлсреднейактивности
- 22. Химические свойства железа3Fe + 2O2 = Fe3O42Fe
- 23. Биологическая роль железаКакова биологическая роль железа и его соединений?В каких продуктах больше всего железа?
- 24. Биологическая роль железа и его соединений
- 25. Основные источники железаМорская капуста - 16 мгПечень
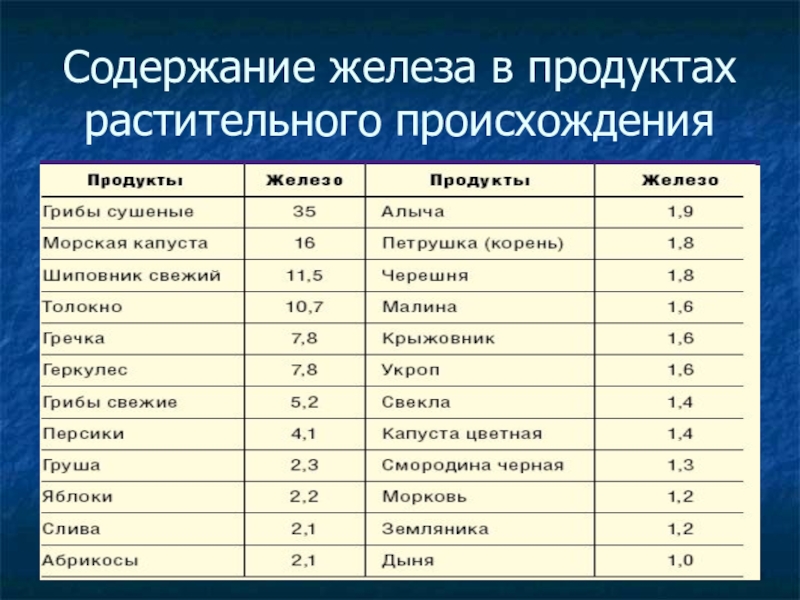
- 26. Содержание железа в продуктах растительного происхождения
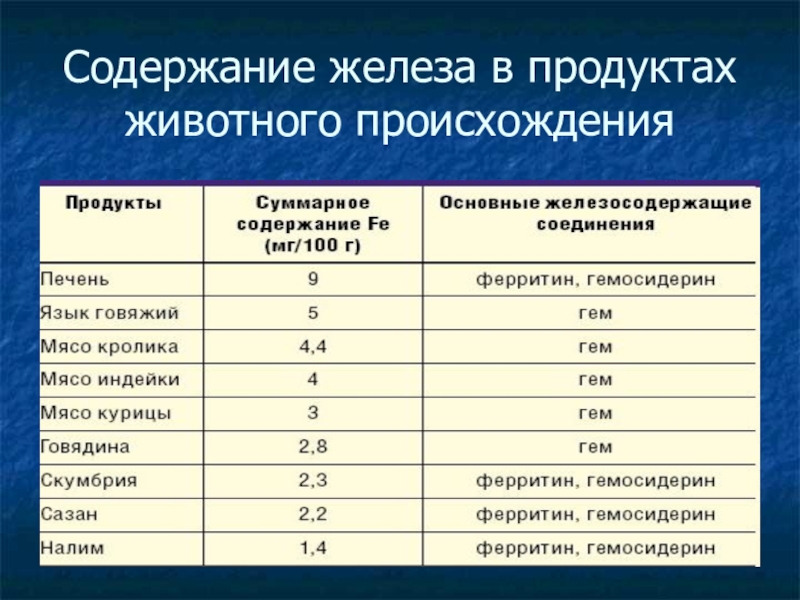
- 27. Содержание железа в продуктах животного происхождения
- 28. Порядок ли у вас с железом?Часто ли
- 29. Промышленное значение железа Каково промышленное значение железа и где оно используется?
- 30. Железо в нашей жизни
- 31. Проверь себя!Выберите правильные ответы1. Железо – это
- 32. Составьте уравнения реакций, с помощью которых
- 33. Составьте электронный баланс: FeCl3 + H2S ? FeCl2 + S + HCl
- 34. Meталл я редкий в чистом виде, Пластичный
- 35. Рефлексия Задание: Написать вывод урока по образцу,
- 36. Домашнее заданиеИзучить 14, упражнение на стр. 68
- 37. Спасибо за урок!
Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до нашей эры. А за блеск, мерцавший холодом, Люди там платили золотом! Я давно в названии века, В
Слайд 1Эпиграф урока:
Элементы и атомы,
В менделеевский взятые круг,
Сделали химию самой богатой
И самой
Слайд 2Загадка
Очень древний я металл,
Счёт столетьям потерял.
Был нескромным я не
в меру,
Тысячи лет до нашей эры.
А за блеск, мерцавший холодом,
Люди там платили золотом!
Я давно в названии века, В организме человека. Называют мной характер, Из меня почти весь трактор. Очень в яблоке полезно, И зовут меня …
Я давно в названии века, В организме человека. Называют мной характер, Из меня почти весь трактор. Очень в яблоке полезно, И зовут меня …
Слайд 3
Одна легенда гласит: “Водяной царь сидит на троне, вокруг него танцуют русалки.
Вдруг забрасываются сети, русалки уплывают, а царя рыбаки вытаскивают на берег.
Взмолился царь, чтоб отпустили его обратно в озеро, а он за это предложил выкуп:
либо золота на один год, либо серебра на десять лет, либо железа на вечные времена.
Вдруг забрасываются сети, русалки уплывают, а царя рыбаки вытаскивают на берег.
Взмолился царь, чтоб отпустили его обратно в озеро, а он за это предложил выкуп:
либо золота на один год, либо серебра на десять лет, либо железа на вечные времена.
Как вы думаете, что выбрали местные жители?
Слайд 4
Тема урока:
«Железо.
Физические и химические свойства»
Девиз урока:
«Железо
не только основа всего мира, самый главный металл окружающей нас природы, оно — основа культуры и промышленности, оно орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества»
(А.Е.Ферсман).
(А.Е.Ферсман).
Слайд 5«Чтобы переваривать знания, надо поглощать их с аппетитом»
Анатоль Франс
Наши задачи:
Продолжить
учиться давать характеристику химическому элементу, как представителю металлов побочных подгрупп, на примере железа.
Изучить физические и химические свойства железа. Научиться записывать уравнения, характеризующие химические свойства железа.
Выяснить значение железа и его соединений в жизни человека.
Развивать умения составлять электронный баланс и уравнения, соответствующие цепочке превращений.
Изучить физические и химические свойства железа. Научиться записывать уравнения, характеризующие химические свойства железа.
Выяснить значение железа и его соединений в жизни человека.
Развивать умения составлять электронный баланс и уравнения, соответствующие цепочке превращений.
Слайд 7Происхождение названия
«Железо»
произошло от санскритских слов
«джальжа» -
металл, руда или
«жель»
блистать, пылать
«Ferrum»
от латинского
«fers»
- быть твердым,
что в свою очередь происходит от санскритского
«меч»
«Ferrum»
от латинского
«fers»
- быть твердым,
что в свою очередь происходит от санскритского
«меч»
Слайд 8 Охарактеризуйте положение железа в периодической таблице химических элементов Д.
И. Менделеева:
Назовите координаты железа в ПСХЭ.
Изобразите строение атома железа.
Определите число протонов, нейтронов и электронов в атоме железа
Назовите координаты железа в ПСХЭ.
Изобразите строение атома железа.
Определите число протонов, нейтронов и электронов в атоме железа
Слайд 13Самостоятельная работа
Определите степени окисления железа в соединениях:
1 ученик: FеСl3, FеSО4, Fе(ОН)2,
2 ученик: Fе(ОН)3, Fе2(SО4)3, FеВr2
Слайд 14Проверь себя!
1 ученик: FеСl3 (+3), FеSО4 (+2), Fе(ОН)2, (+2)
2 ученик:
Fе(ОН)3 (+3), Fе2(SО4)3 (+3), FеВr2 (+2)
Слайд 16 Пользуясь учебником Габриеляна О.С. Химия 9 класса и выданными образцами
железа изучите, и опишите физические свойства железа по плану:
Агрегатное состояние;
Цвет;
Запах;
Растворимость в воде;
Температура плавления;
Температура кипения;
Электрическая проводимость.
Слайд 17Физические свойства железа
Твердое
Серо-серебристое
Блестящее
Хорошо проводит тепло и электрический ток
Достаточно ковкое и пластичное
Обладает
магнитными свойствами
Плотность – 7,87 г/см3
Температура плавления – 1539˚С
Температура кипения - 2740˚С
Плотность – 7,87 г/см3
Температура плавления – 1539˚С
Температура кипения - 2740˚С
Слайд 18Нахождение в природе
В каком состоянии железо встречается в природе?
Назовите важнейшие
природные соединения железа.
Слайд 19Нахождение в природе
В земной коре железа – 5,1 %,
(это 2 место среди металлов
после алюминия
и 4 место среди элементов)
Магнитный железняк (магнетит) - Fе3О4 - до 72% (Южный Урал – Магнитогорск, Курская магнитная аномалия)
Красный железняк (гематит) - Fе2О3 – до 65% (Украина - Кривой Рог)
Бурый железняк (лимонит) - 2Fе2О3∙3Н2О – до 60% (Крым - Керчь)
Железный колчедан (пирит) - FеS2 – до 47 % (Урал)
Сидерит - FеСО3 (Братск) – до 10 %
Гидрокарбонат железа(ΙΙ) – Fе(НСО3) (Железноводск)
В свободном виде встречается только в метеоритах
Слайд 20Химические свойства
Вспомните общие свойства металлов и предположите, с какими веществами будет
взаимодействовать железо?
Восстановителем или окислителем является железо в этих реакциях?
Восстановителем или окислителем является железо в этих реакциях?
Слайд 22Химические свойства железа
3Fe + 2O2 = Fe3O4
2Fe + 3Cl2 = 2FeCl3
Fe
+ 2HCl = FeCl2 + H2
Fe + S = FeS
Fe + CuSO4 = FeSO4 + Cu
Разобрать уравнение с окислительно-восстановительной точки зрения
Fe + O2 + H2O = Fe(OH)3
Fe + S = FeS
Fe + CuSO4 = FeSO4 + Cu
Разобрать уравнение с окислительно-восстановительной точки зрения
Fe + O2 + H2O = Fe(OH)3
Слайд 23Биологическая роль железа
Какова биологическая роль железа и его соединений?
В каких продуктах
больше всего железа?
Слайд 24Биологическая роль железа и его соединений
Железо –
биогенный элемент. Входит в состав гемоглобина, миоглобина, ферментов и других сложных железо-белковых комплексов, которые находятся в печени и селезенке.
В организме взрослого человека имеется 4-5 г.железа, из них 65 % - в крови.
В организме взрослого человека имеется 4-5 г.железа, из них 65 % - в крови.
Слайд 25Основные источники железа
Морская капуста - 16 мг
Печень говяжья – 8,4 мг
Фасоль
– 6,4 мг
Петрушка – 6,0 мг
Овсянка – 4,5 мг
Изюм – 2,7 мг
Земляника – 2,7 мг
Яблоки, груши – 2, 6 мг
Макароны – 2,2 мг
Телятина – 1,5 мг
Свекла – 1,1 мг
Смородина – 1,0 мг
Курица – 0, 7 мг
Рыба – 0,5 мг
Петрушка – 6,0 мг
Овсянка – 4,5 мг
Изюм – 2,7 мг
Земляника – 2,7 мг
Яблоки, груши – 2, 6 мг
Макароны – 2,2 мг
Телятина – 1,5 мг
Свекла – 1,1 мг
Смородина – 1,0 мг
Курица – 0, 7 мг
Рыба – 0,5 мг
Слайд 28Порядок ли у вас с железом?
Часто ли вы чувствуете усталость и
подавленность?
Произошли ли у вас в последнее время изменения кожи, волос и ногтей?
Теряли вы в последнее время много крови?
Занимаетесь ли вы профессиональным спортом?
Вы редко или совсем не едите мясо?
Выпиваете ли вы более трех чашек чая или кофе в день?
Вы едите мало овощей?
Произошли ли у вас в последнее время изменения кожи, волос и ногтей?
Теряли вы в последнее время много крови?
Занимаетесь ли вы профессиональным спортом?
Вы редко или совсем не едите мясо?
Выпиваете ли вы более трех чашек чая или кофе в день?
Вы едите мало овощей?
Слайд 31Проверь себя!
Выберите правильные ответы
1. Железо – это активный щелочной металл.
2. Железо
легко куется.
3. Железо взаимодействует с разбавленными кислотами.
4. Железо не подвергается коррозии.
5. Температура плавления железа – 1539 градусов.
6. Железо взаимодействует с концентрированными кислотами H2SO4 и HNO3 при нагревании.
7. Атомы железа проявляют окислительные свойства.
8. Железо не обладает способностью намагничиваться.
9. Чистое железо не подвергается коррозии.
3. Железо взаимодействует с разбавленными кислотами.
4. Железо не подвергается коррозии.
5. Температура плавления железа – 1539 градусов.
6. Железо взаимодействует с концентрированными кислотами H2SO4 и HNO3 при нагревании.
7. Атомы железа проявляют окислительные свойства.
8. Железо не обладает способностью намагничиваться.
9. Чистое железо не подвергается коррозии.
Слайд 32Составьте уравнения реакций,
с помощью которых можно осуществить следующие превращения:
Fe ?
FeCl2 ? Fe(OH)2 ? FeO
Fe ? FeCl3 ? Fe(OH)3 ? Fe2O3
Fe ? FeCl3 ? Fe(OH)3 ? Fe2O3
Слайд 34Meталл я редкий в чистом виде, Пластичный и блестящий я, Богата рудами моими
магнитогорская земля.
Я при реакциях активный,
Но вытесняет из солей
Меня активный алюминий,
Да и из окиси моей.
В прекрасных сплавах с углеродом
Я приобрел большой почет,
Служу я фабрикам, заводам,
Мне благодарен весь народ.
Среди металлов самый славный
Важнейший, древний элемент,
В тяжелой индустрии главный,
Знаком с ним школьник и студент.
Родился в огненной стихии,
Расплав его течет рекой.
Важнее нет в металлургии,
Он нужен всей стране родной
Слайд 35Рефлексия
Задание: Написать вывод урока по образцу, закончив предложения:
Сегодня я понял
(а), что…
Главным на уроке для меня было…
Больше всего мне запомнилось…
Главным на уроке для меня было…
Больше всего мне запомнилось…
Слайд 36Домашнее задание
Изучить 14, упражнение на стр. 68 № 4.
Сделать подборку текстовых
материалов о соединениях железа из Интернет - источников.