- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Железо и его соединения. 9класс
Содержание
- 1. Презентация по теме: Железо и его соединения. 9класс
- 2. Физические свойства железаСеребристо-белого цветаПлотность7,8 г/см³Пластичен легко куётся и прокатывается в тонкие листы или проволокуНамагничиваетсяТемпература плавления выше1535⁰С
- 3. Химические свойства железаВзаимодействие с неметаллами
- 4. Химические свойства железа2) Взаимодействие с водой. Металлы
- 5. 4)Взаимодействие с кислотами. Fe +
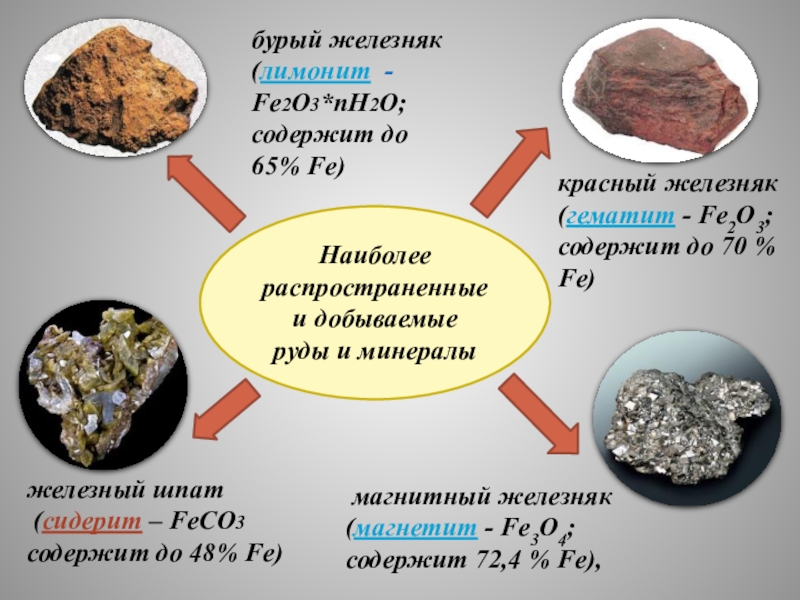
- 6. Наиболее распространенныеи добываемые руды и минералы
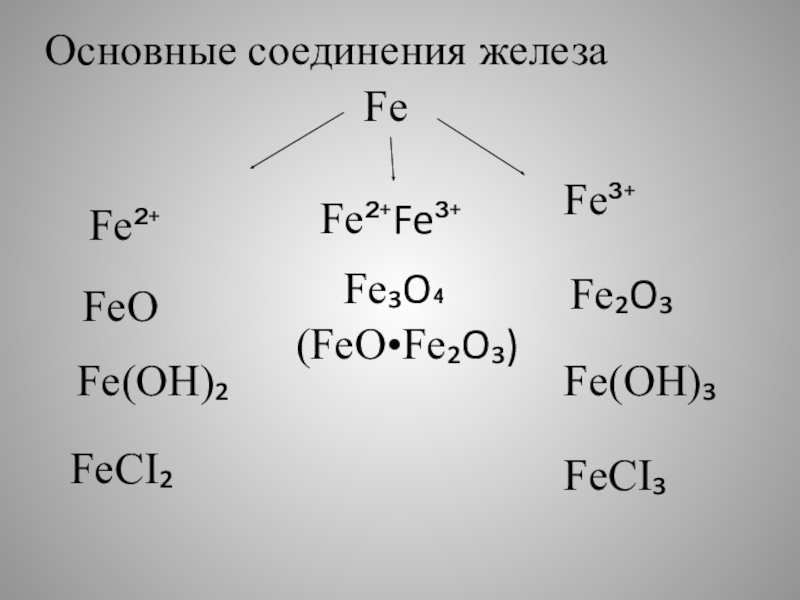
- 7. FeFe²⁺Fe³⁺FeOFe(OH)₂FeCI₂Fe₂O₃Fe(OH)₃FeCI₃Основные соединения железаFe²⁺Fe³⁺Fe₃O₄(FeO•Fe₂O₃)
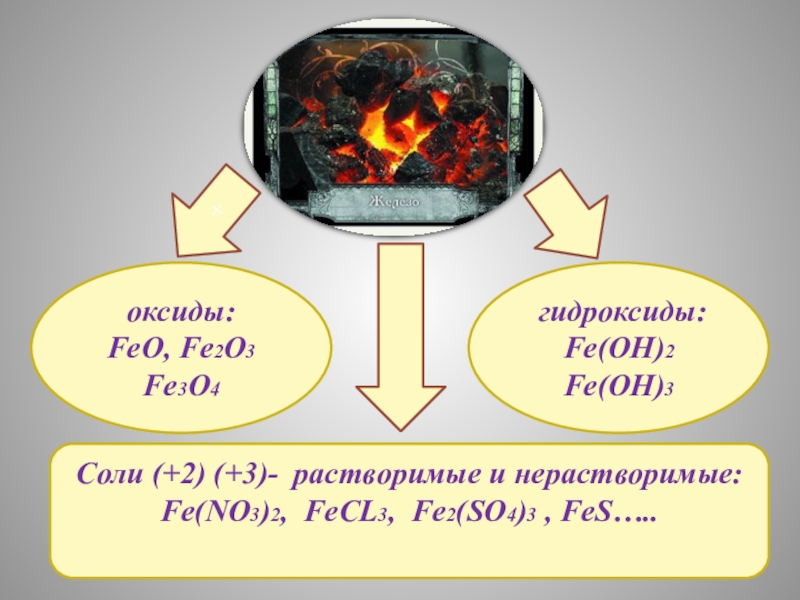
- 8. Соли (+2) (+3)- растворимые и нерастворимые:Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS…..оксиды:FeO, Fe2O3Fe3O4 гидроксиды:Fe(OH)2Fe(OH)3 +
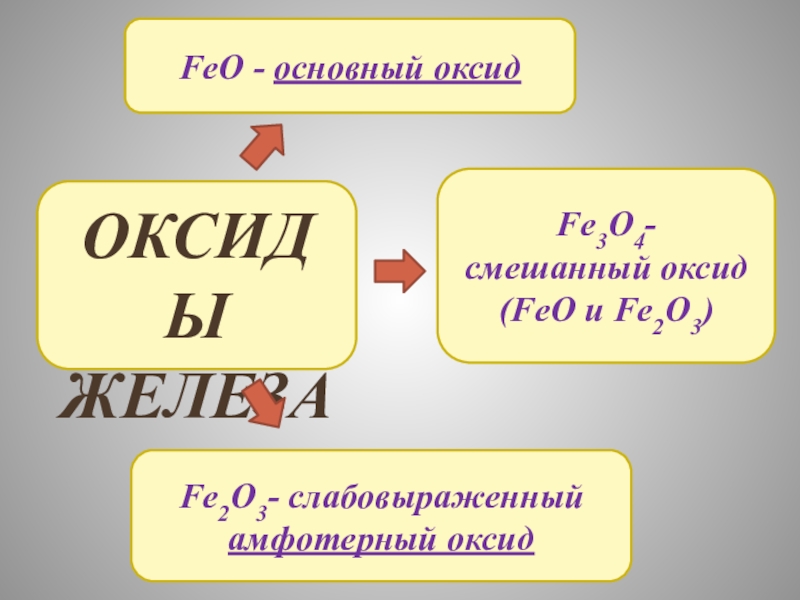
- 9. ОКСИДЫ ЖЕЛЕЗАFeO - основный оксидFe2O3- слабовыраженный амфотерный оксидFe3O4-смешанный оксид (FeO и Fe2O3)
- 10. Химические свойства FeO с кислотами:FeO + 2HCL=FeCL2
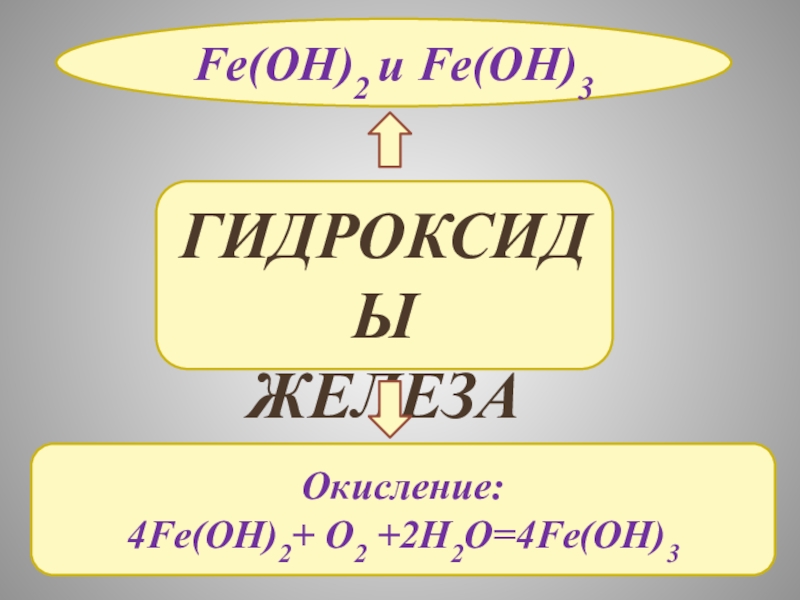
- 11. ГИДРОКСИДЫ ЖЕЛЕЗАFe(OH)2 и Fe(OH)3 Окисление:4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
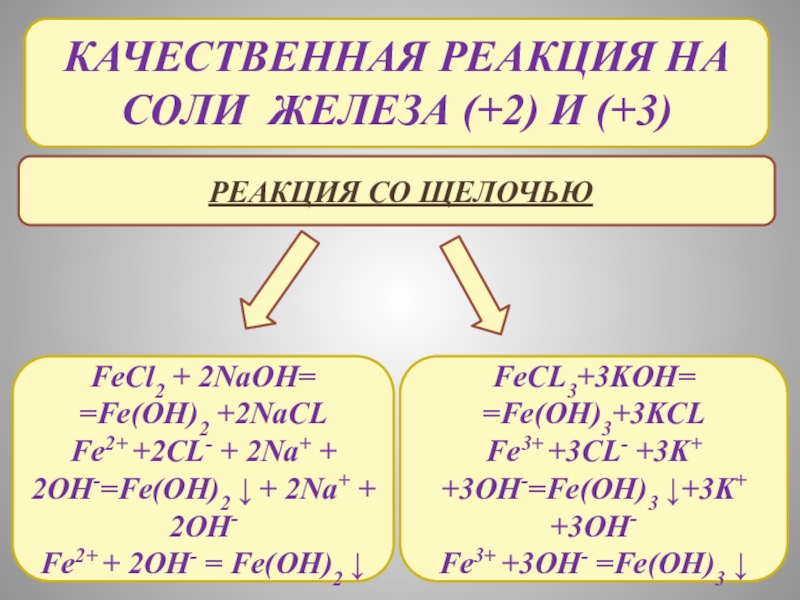
- 12. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА Соли железа (+2) и
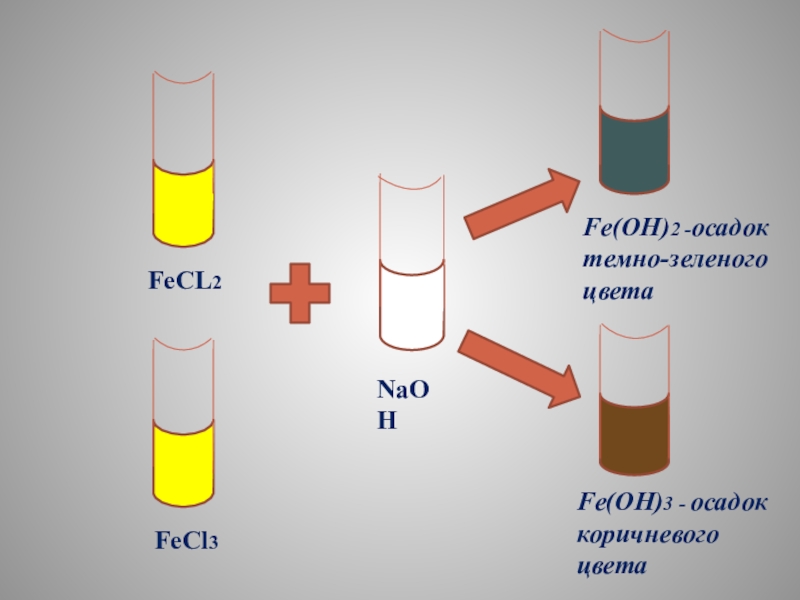
- 13. FeCL2FeCl3NaOHFe(OH)2 -осадок темно-зеленого цветаFe(OH)3 - осадок коричневого цвета
- 14. Качественные реакции на ионы Fe²⁺ и Fe³⁺Fe³⁺
- 15. Fe(OH)2 и Fe(OH)3 Fe(OH)3 реагирует с
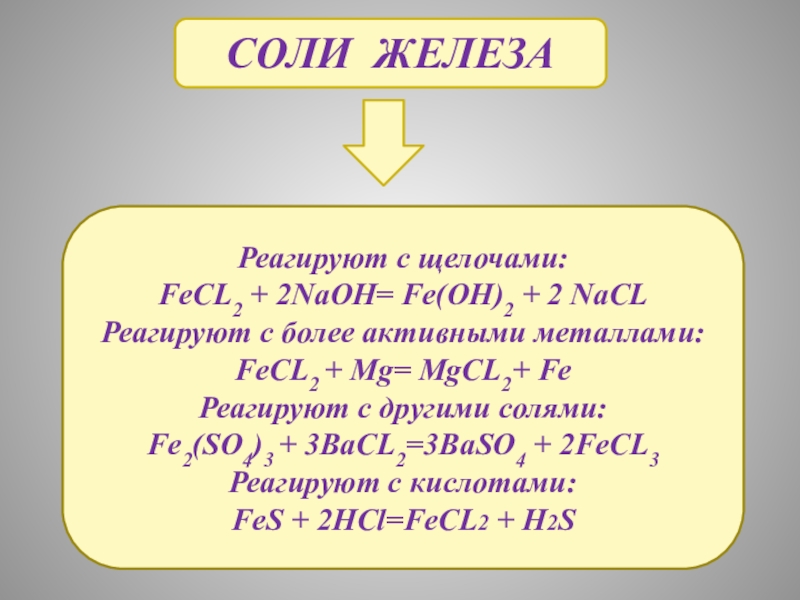
- 16. Соли железаРеагируют с щелочами:FeCL2 + 2NaOH= Fe(OH)2
- 17. Железо в организмеЖелезо в виде ионов присутствует
- 18. Основная роль железа в организме – участие
- 19. гречкаговядинапеченьбелая капустахлеб грубого помола и черный хлеббобы и курагаорехимясо куряблокиПродукты, богатые Железом
- 20. Слайд 20
- 21. Слайд 21
- 22. Токсичность железаИзбыточная доза железа – 200мг и
- 23. Спасибо за работу!
Слайд 2Физические свойства железа
Серебристо-белого цвета
Плотность7,8 г/см³
Пластичен легко куётся и прокатывается
в тонкие
Намагничивается
Температура плавления выше1535⁰С
Слайд 3Химические свойства железа
Взаимодействие с неметаллами
б) Менее энергично взаимодействует с серой: Fе + S = FеS
Слайд 4Химические свойства железа
2) Взаимодействие с водой. Металлы средней активности при нагревании
3 Fe + 4Н₂О = Fe₃О₄ + 4Н₂↑
3) Взаимодействие с кислородом:
3 Fe + 2О₂ = Fe₃О₄
(FeО∙Fe₂О)
Слайд 5
4)Взаимодействие с кислотами.
Fe + H₂SO₄ = FeSO₄ +
5) Взаимодействие с солями.
Более активный металл вытесняет менее активный из раствора его соли:
CuSO₄ + Fe = Cu +FeSO₄
Химические свойства железа
Слайд 6
Наиболее
распространенные
и добываемые
руды и минералы
магнитный железняк
(магнетит - Fe3O4;
содержит 72,4 % Fe),
бурый железняк (лимонит -
Fe2О3*пН2О;
содержит до 65% Fe)
красный железняк (гематит - Fe2O3; содержит до 70 % Fe)
железный шпат
(сидерит – FeCO3
содержит до 48% Fe)
Слайд 8Соли (+2) (+3)- растворимые и нерастворимые:
Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS…..
оксиды:
FeO, Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
+
Слайд 9ОКСИДЫ
ЖЕЛЕЗА
FeO - основный оксид
Fe2O3- слабовыраженный амфотерный оксид
Fe3O4-
смешанный оксид
Слайд 10Химические свойства FeO
с кислотами:
FeO + 2HCL=FeCL2 + H2O
2) с более
3FeO + 2Al = 3Fe + Al2O3
Химические свойства Fe2O3
1) с кислотами:
Fe2O3 + 3H2SO4=Fe2(SO4)3 + 3H2O
2) с более активными металлами
Fe₂O₃ + 3Mg=3MgO +2Fe
Слайд 12КАЧЕСТВЕННАЯ РЕАКЦИЯ НА Соли железа (+2) и (+3)
Реакция со щелочью
FeCl2
=Fe(OH)2 +2NaCL
Fe2+ +2CL- + 2Na+ + 2OH-=Fe(OH)2 ↓ + 2Na+ + 2OH-
Fe2+ + 2OH- = Fe(OH)2 ↓
FeCL3+3KOH=
=Fe(OH)3+3KCL
Fe3+ +3CL- +3K+ +3OH-=Fe(OH)3 ↓+3K+ +3OH-
Fe3+ +3OH- =Fe(OH)3 ↓
Слайд 14Качественные реакции на ионы Fe²⁺ и Fe³⁺
Fe³⁺ реактив
Fe³⁺ реактив – желтая кровяная соль – K₄[Fe(CN)₆]
Fe²⁺ реактив – красная кровяная соль - K₃[Fe(CN)₆]
Слайд 15Fe(OH)2 и Fe(OH)3
Fe(OH)3 реагирует с конц. щелочами
Fe(OH)3 +
1)Реагируют с кислотами:
Fe(OH)2 + 2HNO3= Fe(NO3)2 + 2H2O
Fe(OH)3 + 3HCL=FeCl3+3H2O
2)Разлагаются при нагревании:
2Fe(OH)3 = Fe2O3+3H2O
Fe(OH)2=FeO + H2O
Слайд 16Соли железа
Реагируют с щелочами:
FeCL2 + 2NaOH= Fe(OH)2 + 2 NaCL
Реагируют с
FeCL2 + Mg= MgCL2+ Fe
Реагируют с другими солями:
Fe2(SO4)3 + 3BaCL2=3BaSO4 + 2FeCL3
Реагируют с кислотами:
FeS + 2HCl=FeCL2 + H2S
Слайд 17Железо в организме
Железо в виде ионов присутствует в организмах всех растений
Основная биологическая функция железа – участие в транспорте кислорода ко всем органам и окислительных процессах.
В организме человека с массой тела прниблизительно70 кг содержится 4,2 г железа, а в 1 л крови – 450 мг.
При недостатке железа в организме развивается железистая анемия.
Перенос железа в организме осуществляет важнейший белок –гемоглобин, в котором находится больше половины всего железа организма.
Слайд 18Основная роль железа в организме – участие в «рождении» красных (эритроцитов)
Эритроциты содержат гемоглобин - переносчик кислорода, а лимфоциты ответственны за иммунитет.
Почти 60%, поступающего в организм железа расходуется на синтез гемоглобина.
Некоторое количество (примерно 20%) - откладывается в мышцах, костном мозге, печени и селезенке.
Еще 20% его используется для синтеза различных ферментов.
Слайд 19гречка
говядина
печень
белая капуста
хлеб грубого помола
и черный хлеб
бобы и курага
орехи
мясо кур
яблоки
Продукты, богатые
Слайд 22Токсичность железа
Избыточная доза железа – 200мг и выше может вызвать отравление
Железо
Соединения Fe²⁺ токсичнее соединений Fe³⁺
Ионы тяжелых металлов содержащиеся в водоемах, растениях, не только причиняют вред здоровью, но и разрушают его генофонд