Р - элементы
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Углерод и его соединения 9 класс
Содержание
- 1. Презентация по теме Углерод и его соединения 9 класс
- 2. Изменение свойств в группе С Si Ge Sn PbМеталлические свойства увеличиваются
- 3. УГЛЕРОД И ЕГО СОЕДИНЕНИЯ
- 4. 1.Положение В ПС.2.Заряд ядра и состав атома3.Электронная
- 5. План характеристики1.Положение В ПС
- 6. Слайд 6
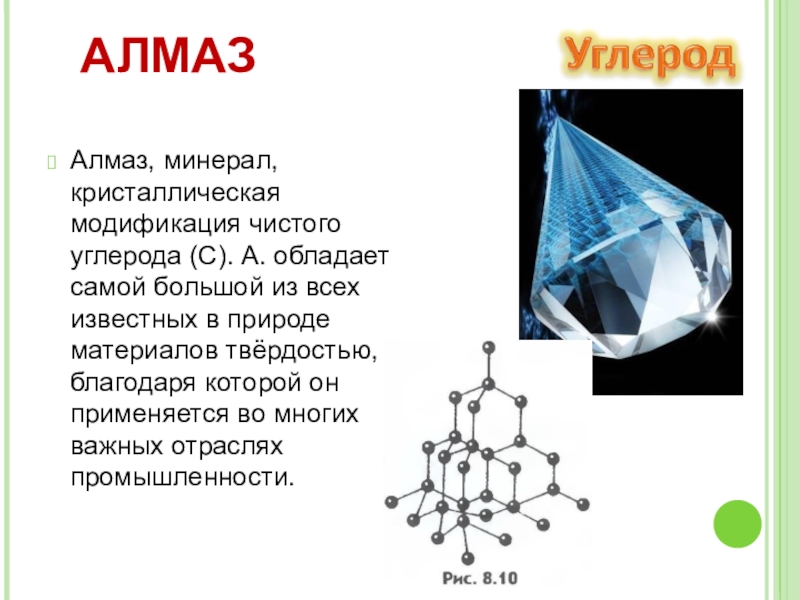
- 7. АЛМАЗАлмаз, минерал, кристаллическая модификация чистого углерода (С).
- 8. «ШАХ»Происхождение - Южная Африка.Размер –
- 9. МАЛАЯ ИМПЕРАТОРСКАЯ КОРОНАКорона создана из бриллиантовых кружев
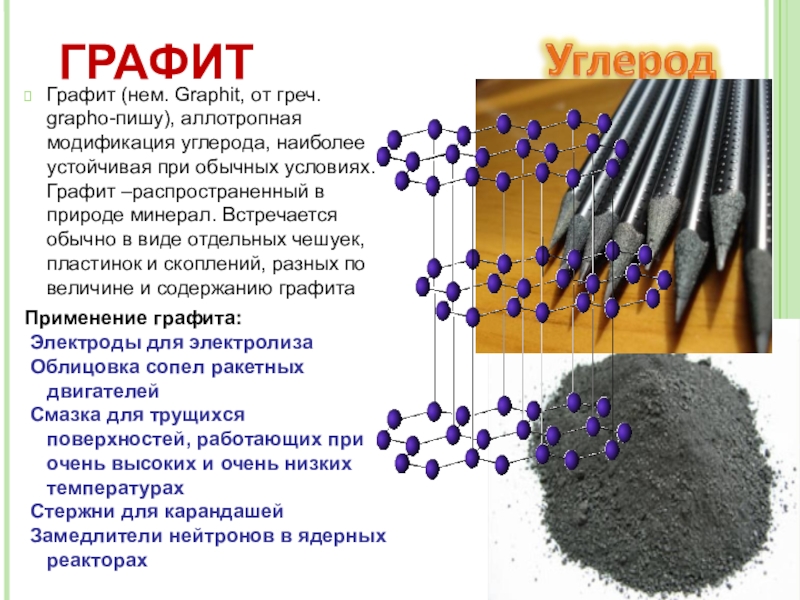
- 10. Графит (нем. Graphit, от греч. grapho-пишу), аллотропная
- 11. Фуллере́ны— молекулярные соединения, принадлежащие классу аллотропных форм
- 12. Г Р А Ф И ТСходное с
- 13. Н.Д.Зелинский
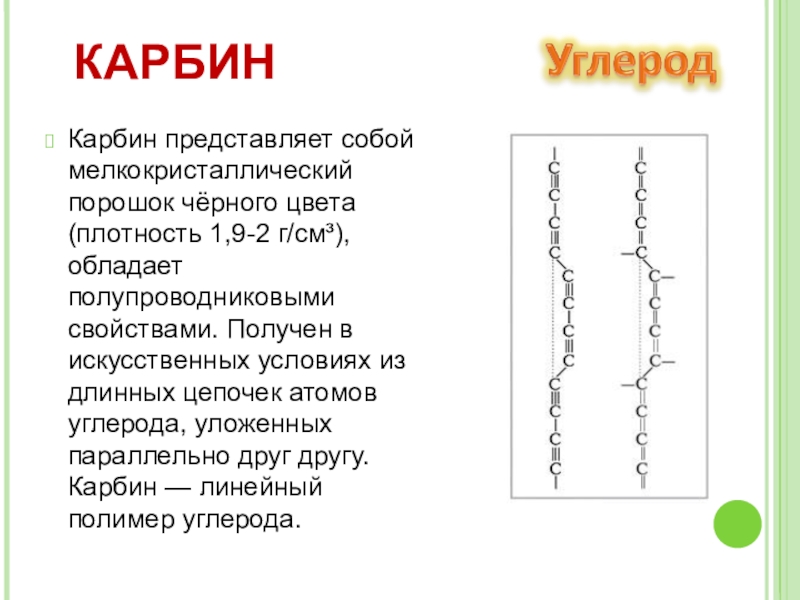
- 14. Карбин представляет собой мелкокристаллический порошок чёрного цвета
- 15. Кристаллы толщиной в один атом или одну
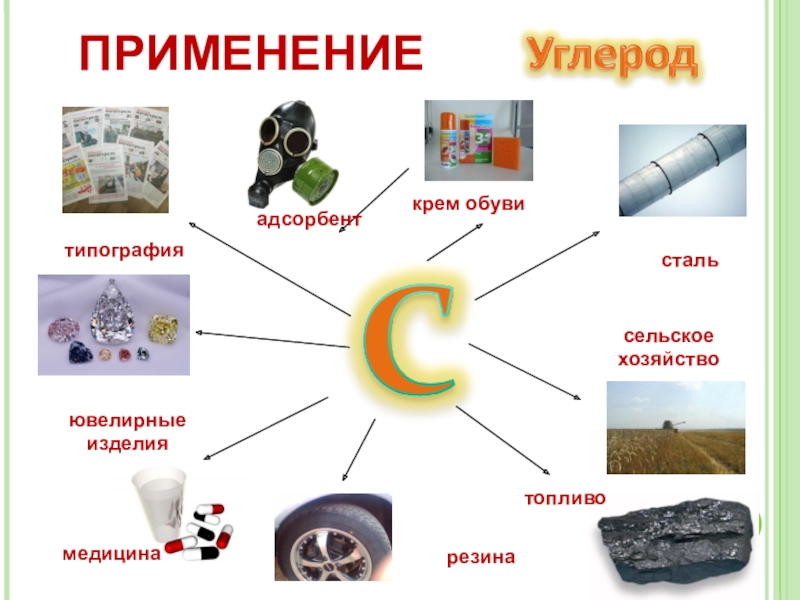
- 16. стальсельское хозяйствотопливомедицинатипографияювелирные изделияадсорбентрезинакрем обувиПРИМЕНЕНИЕ
- 17. 1. Взаимодействует с кислородомC + O2 =CO2.2C
- 18. 2CO + O2 = 2CO2 + Q.CO
- 19. CO2 + H2O = H2CO3Na2O + CO2
- 20. Значение углерода В процессе фотосинтеза происходит превращение солнечной энергии в химическую. Преобразование неорганических веществ в органические
- 21. ЛИТЕРАТУРА:Энциклопедия для детей. Том 4. Москва «аванта+»
Слайд 1 +6С )2)4
+14Si )2)8)4
+32Ge )2)8)18)4
+50Sn )2)8)18)18)4
+82Pb )2)8)18)32)18)4
Общая электронная формула внешнего слоя
S2
Слайд 4
1.Положение В ПС.
2.Заряд ядра и состав атома
3.Электронная формула
4.Возможные степени окисления
5.Простое вещество
6.Тип
7.Тип кристаллической решетки простого вещества
8.Формула высшего оксида и его характер
9.Формула гидроксида и его характер
10.Распространение в природе
План характеристики
Слайд 5
План характеристики
1.Положение В ПС
2.Заряд ядра и состав атома - +6 ; е=6; р=6; n=6
3.Электронная формула
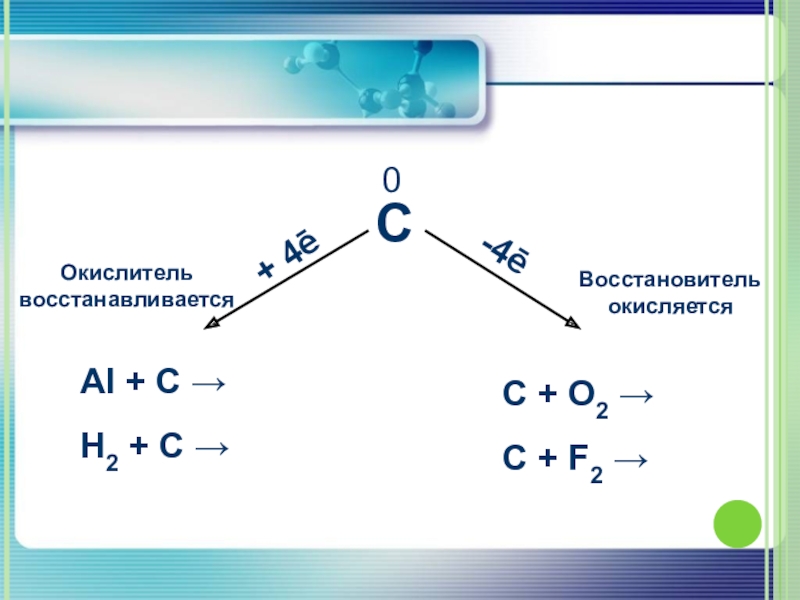
4.Возможные степени окисления - +2, -2, +4, -4
5.Простое вещество - С сажа; C фуллерен; С алмаз; С графит; С карбин
6.Тип химической связи в прост. веществе – ковал. непол.
7.Тип кристаллической решетки простого вещества - атомная
8.Формула высшего оксида и его характер - СО2 кислотный
9.Формула гидроксида и его характер - Н2СО3 кислота
10.Распространение в природе - СаСО3 * MgCO3 мел, мрамор, известняк, доломит, арагонит.
Слайд 7АЛМАЗ
Алмаз, минерал, кристаллическая модификация чистого углерода (С). А. обладает самой большой
Слайд 8 «ШАХ»
Происхождение - Южная Африка.Размер – 3025 каратов Вес 605
Самый крупный из найденных
АЛМАЗ
История его появления в Петербурге связана с трагическим событием произошедшим 30 января 1829 года в Тегеране: толпа фанатиков убила в этот день российского посла , дипломата и писателя А. С. Грибоедова. Чтобы замять неизбежный скандал , в Северную Пальмиру отправилась специальная депутация , и ее глава, принц Хозров - Мирза, вместе с извинениями шаха передал императору Николаю I одно из ценнейших сокровищ своего отца.
Слайд 9МАЛАЯ ИМПЕРАТОРСКАЯ КОРОНА
Корона создана из бриллиантовых кружев в серебряной оправе; при
Работа этого изделия была выполнена братьями Я. и Ж. Дювалям, сыновьями ювелира Людовика Дюваля.
АЛМАЗ
Слайд 10Графит (нем. Graphit, от греч. grapho-пишу), аллотропная модификация углерода, наиболее устойчивая
Применение графита:
Электроды для электролиза
Облицовка сопел ракетных двигателей
Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах
Стержни для карандашей
Замедлители нейтронов в ядерных реакторах
ГРАФИТ
Слайд 11Фуллере́ны— молекулярные соединения, принадлежащие классу аллотропных форм углерода и представляющие собой
ФУЛЛЕРЕН
Слайд 12Г Р А Ф И Т
Сходное с графитом строение имеют:
Сажа
Древесный уголь
Кокс
типографская
восстановитель при выплавке чугуна из руд
твердое топливо, адсорбент для очистки газов и жидкостей
Слайд 14Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает
КАРБИН
Слайд 15Кристаллы толщиной в один атом или одну молекулу - графен, созданный
Графен - материал будущего
Слайд 16сталь
сельское хозяйство
топливо
медицина
типография
ювелирные изделия
адсорбент
резина
крем обуви
ПРИМЕНЕНИЕ
Слайд 171. Взаимодействует с кислородом
C + O2 =CO2.
2C + O2 = 2CO.
2.Взаимодействует
C + 2F2 =CF4.
C + 2H2 = CH4.
3. Взаимодействует с металлами
2C + Ca = CaC2,
4 Al + 3C = Al4C3
4. Взаимодействует с оксидами
3C + CaO =CaC2 + 2CO.
C + FeO = Fe + CO,
5. Взаимодействует с водой
C + H2O = CO + H2,
6. Взаимодействует с кислотами
C + 2 H2SO4 (t )= CO2 + 2 SO2 + H2O,
C + 4HNO3 (t )= 3CO2 + 4NO2 + 2H2O.
2C+BaSO4=BaS+2CO2
Химические свойства
Слайд 182CO + O2 = 2CO2 + Q.
CO + Cl2 = COCl2.
CO + 2H2 = CH3OH.
Угарный газ - СО
СО – угарный газ. Оксид углерода (+2) – бесцветный газ, без запаха, плохо растворимый в воде. Ядовит!
Физические свойства
Химические свойства
Получение
2C + O2 = 2CO.
CO2 + C =2CO.
Слайд 19CO2 + H2O = H2CO3
Na2O + CO2 = Na2CO3,
Ca(OH)2 + CO2
Углекислый газ – СО2
СО2 - оксид углерода (+4) , углекислый газ– бесцветный газ, слегка кисловатый на вкус, в 1,5 раза тяжелее воздуха. Растворим в воде.
Физические свойства
Химические свойства
Получение
CaCO3 = CaO + CO2 .
CaCO3 + 2HCl = CaCI2 + CO2 + H2O.
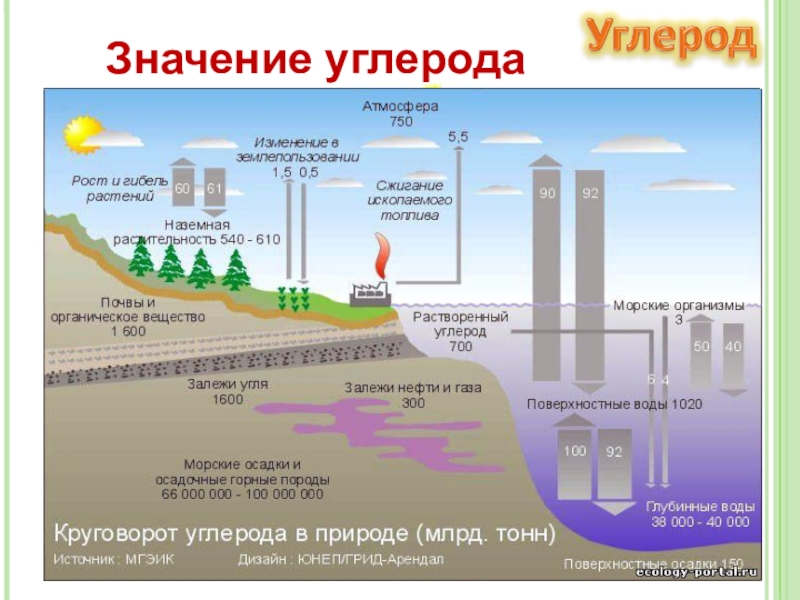
Слайд 20Значение углерода
В процессе фотосинтеза происходит превращение солнечной энергии в химическую.
Слайд 21ЛИТЕРАТУРА:
Энциклопедия для детей. Том 4. Москва «аванта+» 1995 г.
Куликов Б. Азбука
Я познаю мир. Детская энциклопедия. Драгоценные камни и минералы. Москва. «астрель» 2003 г.
Ножко Е.С.Сугатов А.П. Карбонаты.//Я иду на урок химии: 8-11 классы:Книга для учителя. – М.: Первое сентября, 2002, стр. 96-97.