- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме теория строения органических соединений
Содержание
- 1. Презентация по теме теория строения органических соединений
- 2. Введение Подобно тому как в
- 3. Органическая химияНазвание "органическая химия" возникло на ранней
- 4. Изомерия Изомерия- явление, заключающееся в существовании химических
- 5. ИЗОМЕРИЯПространственная (Изомеры, имеющие одинаковые заместители у каждого
- 6. ВалентностьЭтимологию термина валентность возможно отследить начиная с
- 7. Уже три года спустя, в сентябре 1861
- 8. Теория химического строенияТеория химического строения - учение
- 9. Термин «химическое строение» впервые ввёл А. М.
- 10. Химические формулы органической химииМолекулярная формула Отражает качественный
- 11. ВыводСовременная теория строения органических соединений основывается не
- 12. СПАСИБО ЗА ВНИМАНИЕ
Слайд 1Выполнили:
ученицы 10 «А»
Павленко Алёна,
Галкина Екатерина,
Белоусова Анна,
Малахова Анастасия.
Теория строения органических соединений
Слайд 2Введение
Подобно тому как в неорганической химии основополагающей теоретической
Как и любая другая научная теория, теория строения органических соединений явилась результатом обобщения богатейшего фактологического материала, который накопила органическая химия, оформившись как наука в начале XIX в. Открывались все новые и новые соединения углерода, количество которых лавинообразно возрастало. Объяснять это многообразие ученые еще не могли.
Слайд 3Органическая химия
Название "органическая химия" возникло на ранней стадии развития науки, когда
К настоящему времени число известных органических соединений превышает 10 млн. и увеличивается каждый год на 250-300 тыс. Многообразие органических соединений определяется уникальной способностью атомов углерода соединяться друг с другом простыми и кратными связями, образовывать соединения с практически неограниченным числом атомов, связанных в цепи, циклы, бициклы, трициклы, полициклы, каркасы и др., образовывать прочные связи почти со всеми элементами периодической системы, а также явлением изомерии - существованием разных по свойствам веществ, обладающих одним и тем же составом и молекулярной массой.
Органическая химия - наука, изучающая соединения углерода с другими элементами (органические соединения), а также законы их превращений.
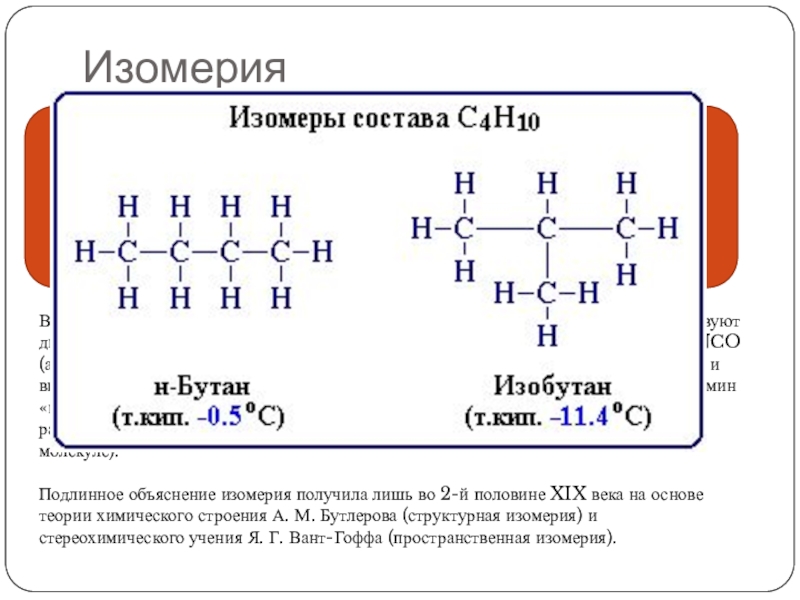
Слайд 4Изомерия
Изомерия- явление, заключающееся в существовании химических соединений — изомеров, —
В итоге дискуссии Ю. Либиха и Ф. Вёлера в 1823 году было установлено, что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO (англ.)русск.) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 году ввёл термин «изомерия» и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (то есть, в современных терминах, молекуле).
Подлинное объяснение изомерия получила лишь во 2-й половине XIX века на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
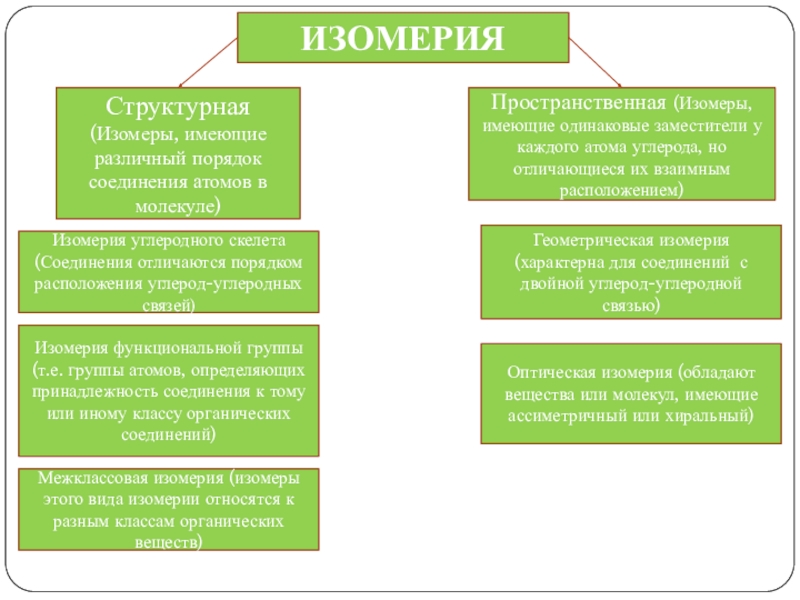
Слайд 5ИЗОМЕРИЯ
Пространственная (Изомеры, имеющие одинаковые заместители у каждого атома углерода, но отличающиеся
Структурная (Изомеры, имеющие различный порядок соединения атомов в молекуле)
Изомерия углеродного скелета (Соединения отличаются порядком расположения углерод-углеродных связей)
Изомерия функциональной группы (т.е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений)
Межклассовая изомерия (изомеры этого вида изомерии относятся к разным классам органических веществ)
Геометрическая изомерия (характерна для соединений с двойной углерод-углеродной связью)
Оптическая изомерия (обладают вещества или молекул, имеющие ассиметричный или хиральный)
Слайд 6Валентность
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Вале́нтность— способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
Слайд 7Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Слайд 8Теория химического строения
Теория химического строения - учение о строении молекулы, описывающее
Сам Бутлеров определял понятие химического строения так: "Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу".
Слайд 9Термин «химическое строение» впервые ввёл А. М. Бутлеров 19 сентября 1861
Атомы в молекулах соединены друг с другом в молекулы согласно их валентности, порядок распределения связей в молекуле называется химическим строением.
Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Атомы в молекулах оказывают влияние друг на друга и это влияние приводит к химическим изменениям поведения атома.
Определить состав и строение химического элемента можно по продуктам химических превращений.
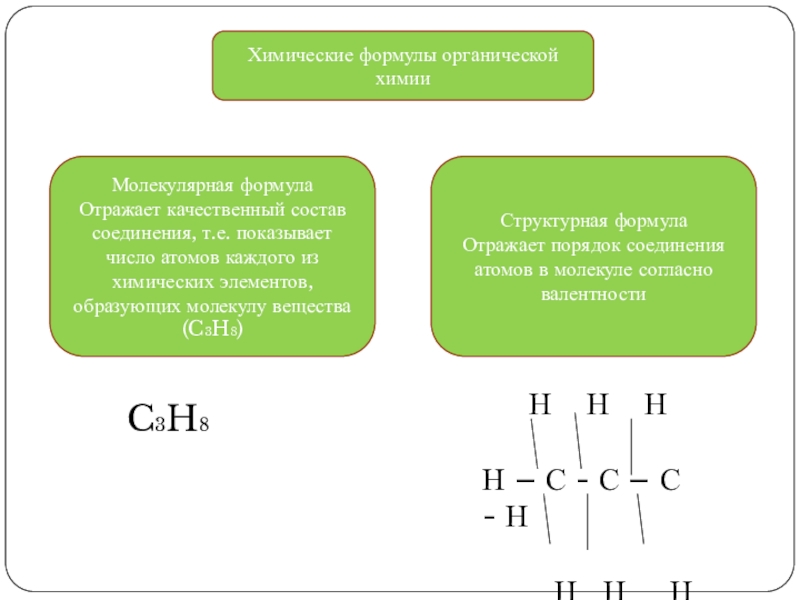
Слайд 10Химические формулы органической химии
Молекулярная формула
Отражает качественный состав соединения, т.е. показывает число
Структурная формула
Отражает порядок соединения атомов в молекуле согласно валентности
C3H8
Н Н Н
Н – С - С – С - Н
Н Н Н