- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
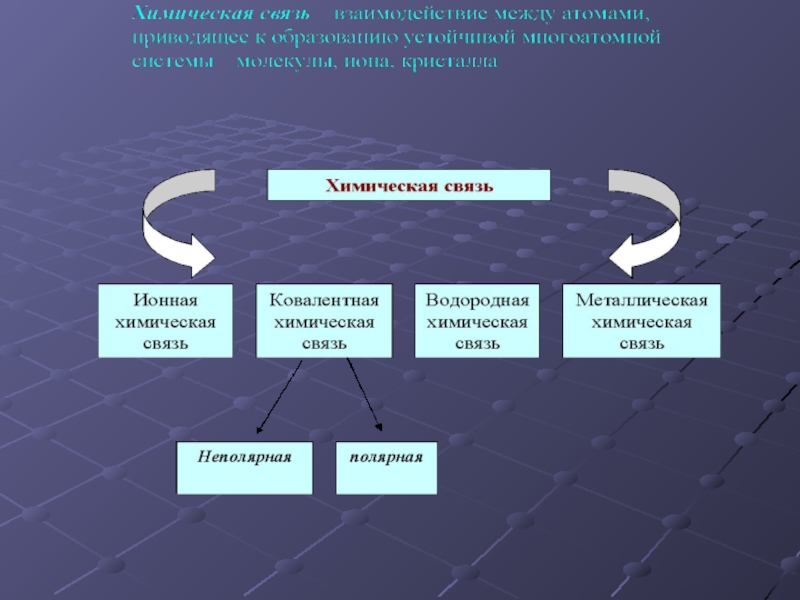
Презентация, доклад по химии Виды химической связи
Содержание
- 1. Презентация по химии Виды химической связи
- 2. Слайд 2
- 3. Слайд 3
- 4. Ковалентная связь – это связь между атомами,
- 5. Число общих электронных пар равно числу связей
- 6. Ионная связь – это электростатическое притяжение между
- 7. Металлическая химическая связь осуществляется свободными электронами, общими
- 8. Водородная химическая связь – это электростатическое притяжение
- 9. Слайд 9
- 10. Слайд 10
- 11. Резких границ между разными видами химических связей нет, все виды химической связи имеют единую электрическую природу.
Слайд 1ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
Автор: Балакеримова З.Э.
учитель химии
МБОУ Многопрофильная Гимназия № 38
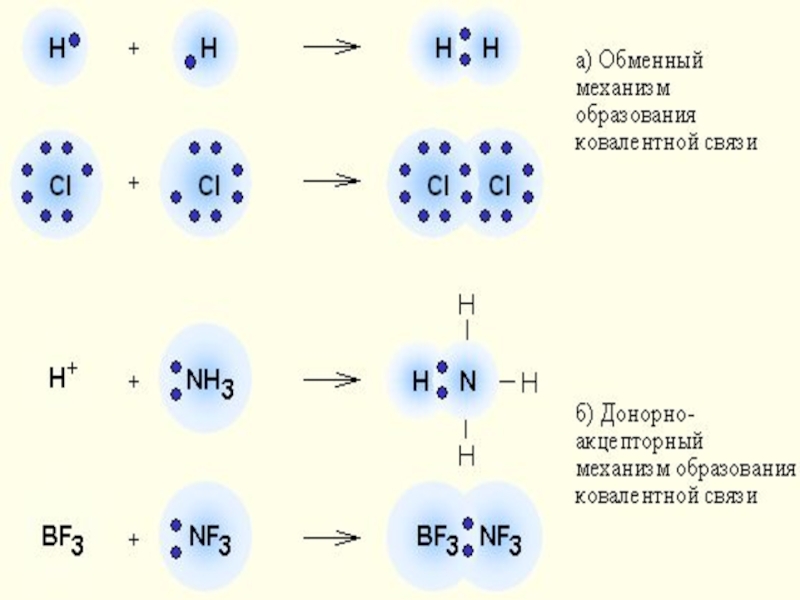
Слайд 4Ковалентная связь – это связь между атомами, возникающая за счет образования
По обменному механизму: каждый атом предоставляет в общую электронную пару один неспаренный электрон:
Н Н
По донорно-акцепторному механизму: один атом предоставляет электронную пару (донар), а другой – пустую орбиталь (акцептор)
+ + +
Н + : NН Н NН или Н NН
3 3 3
Слайд 5Число общих электронных пар равно числу связей между двумя атомами, или
Простая (одинарная связь) образуется за счет перекрывания электронных облаков на линии, соединяющей центры атомов (ϭ-связь)
Н2 ϭ (s – s)
Сl2 ϭ (р – р)
НCl ϭ (s – р)
Двойная связь содержит ϭ и π – связи. π – связи образуются за счет бокового перекрывания р и d облаков:
Тройная связь содержит ϭ и две π – связи.
Полуторная связь (электронные облака «размазаны» между тремя и четырьмя атомами)
Н О N О
О
Слайд 6Ионная связь – это электростатическое притяжение между ионами;
Возникает между атомами, имеющими
Образуется между атомами наиболее активных металлов и неметаллов;
При образовании ионной связи атом металла отдает свои электроны атому неметалла, при этом каждый из атомов получает завершенный энергетический уровень. +
ПРИМЕР: Li _ 1 е Li катион
2 1 2
_
F + 1 е F анион
2 7 2 8
+3
+3
+3
+9
+9
Слайд 7Металлическая химическая связь осуществляется свободными электронами, общими для всего кристалла.
Металлы образуют
Слайд 8Водородная химическая связь – это электростатическое притяжение между положительно поляризованными атомами
Межмолекулярная водородная связь (значительно влияет на агрегатное состояние, плотность, температуры кипения и плавления, теплоту парообразования и т.д.)
δ- δ+
О Н О
Н С δ+ δ- С Н
О Н О
Внутримолекулярные водородные связи играют большую роль в формировании вторичной структуры белков, поддержании двойной спирали ДНК, сложной формы т-РНК
Слайд 11Резких границ между разными видами химических связей нет, все виды химической