- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Соединения галогенов
Содержание
- 1. Презентация по теме Соединения галогенов
- 2. Соединения галогенов Галогеноводороды – это едкие газы
- 3. Галогеноводороды
- 4. КислотыФтороводородная кислота –плавиковая кислотаХлороводородная кислота –соляная кислота.Бромоводородная кислота -HFИодоводороднаякислотаHClHBrHIСИЛАКИСЛОТУВЕЛИЧИВАЕТСЯ???УВЕЛИЧИВАЕТСЯRионаУМЕНЬШАЕТСЯПРОЧНОСТЬСВЯЗИ
- 5. Получение хлороводорода (HCI)синтез из водорода и хлораПромышленный
- 6. Соляная кислота - HCl Бесцветная жидкость,
- 7. Галогеноводородные кислоты
- 8. Галогеноводородные кислотыОбразуются при растворении галогеноводородов в воде.
- 9. Качественные реакцииHCl + AgNO3 → HNO3 +
- 10. Природные соединения галогенов Флюорит- составная частьапатитов и
- 11. ОксокислотыХлорная – НСlO4
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Соединения фтораn(-CF2-CF2-) Тефлон
- 21. ЛекарстваМоющие средствакрасителиполимерыХимические реактивыЯдохимикатыОтравляющие в-вафотографияЗначение соединений галогеновСоединения галогеновЧеловек
- 22. Соли галогеноводородных кислотМИИРОФТДЫДИИЛОРЫДЫДБРОХ1.2.4.3.ы1.Соли иодоводороднойкислоты По горизонтали:По вертикали:2.Соли
- 23. Домашнее заданиеСоставить уравнения реакций, подтверждающие химические свойства соляной кислоты.
- 24. Ваше настроение ??? Спасибо за внимание!1234
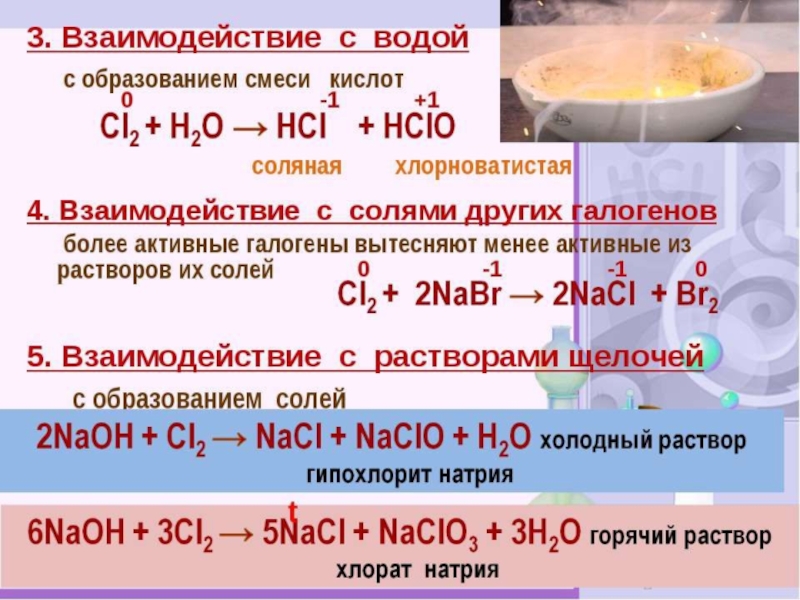
Слайд 2Соединения галогенов
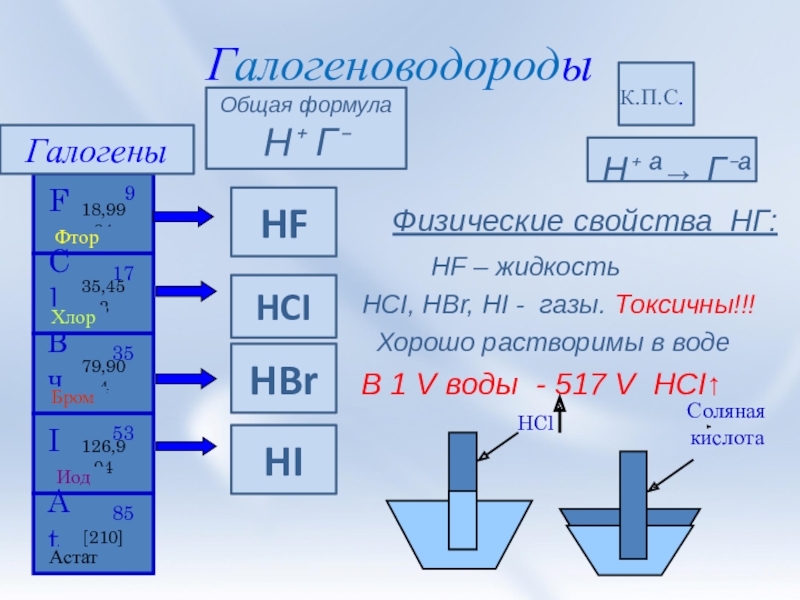
Галогеноводороды – это едкие газы с резким запахом, хорошо
HF HCl HBr HI
фтороводород
хлороводород
бромоводород
йодоводород
Слайд 3Галогеноводороды
Физические свойства НГ:
HF – жидкость
HCI, HBr, HI - газы. Токсичны!!!
Хорошо растворимы в воде
В 1 V воды - 517 V HCI↑
Галогены
Общая формула
Н⁺ Г⁻
HF
HCI
HBr
HI
К.П.С.
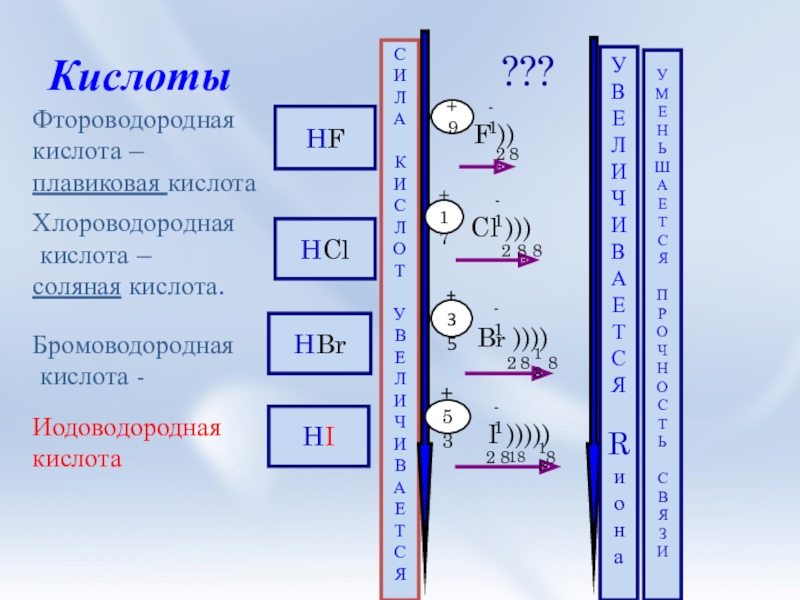
Слайд 4Кислоты
Фтороводородная
кислота –
плавиковая кислота
Хлороводородная
кислота –
соляная кислота.
Бромоводородная
кислота -
HF
Иодоводородная
кислота
HCl
HBr
HI
С
И
Л
А
К
И
С
Л
О
Т
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
???
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
R
и
о
н
а
У
М
Е
Н
Ь
Ш
А
Е
Т
С
Я
П
Р
О
Ч
Н
О
С
Т
Ь
С
В
Я
З
И
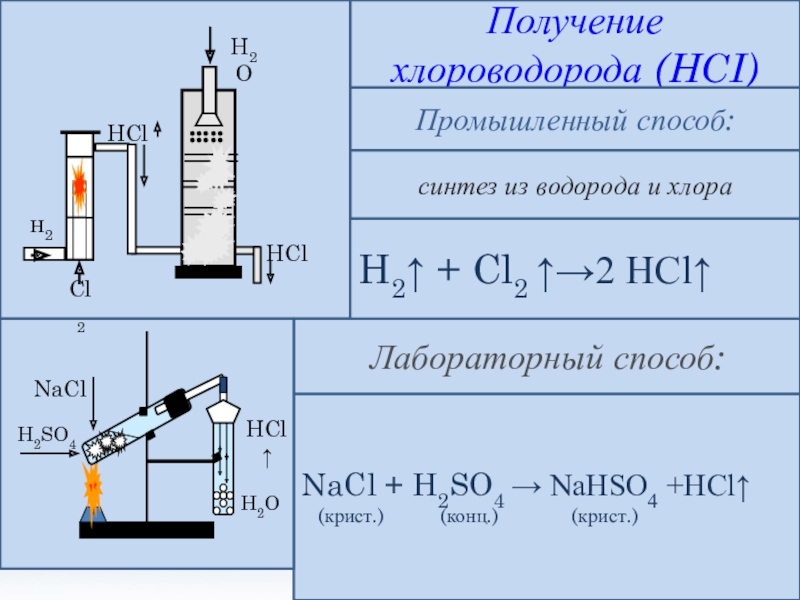
Слайд 5Получение хлороводорода (HCI)
синтез из водорода и хлора
Промышленный способ:
NaCl + H2SO4 →
(крист.) (конц.) (крист.)
Лабораторный способ:
H2↑ + Cl2 ↑→2 HCl↑
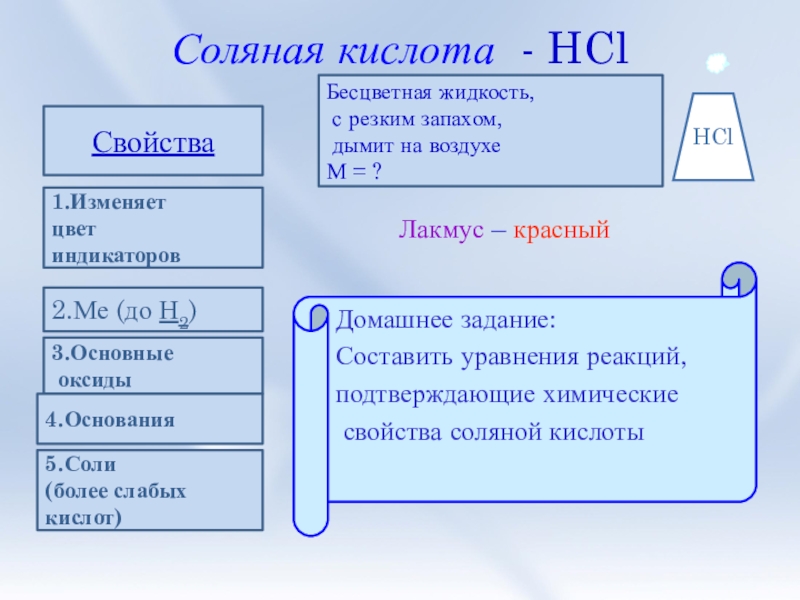
Слайд 6Соляная кислота - HCl
Бесцветная жидкость,
с резким запахом,
дымит
М = ?
HCl
Лакмус – красный
Свойства
1.Изменяет
цвет
индикаторов
2.Ме (до Н2)
3.Основные
оксиды
5.Соли
(более слабых
кислот)
4.Основания
Домашнее задание:
Составить уравнения реакций,
подтверждающие химические
свойства соляной кислоты
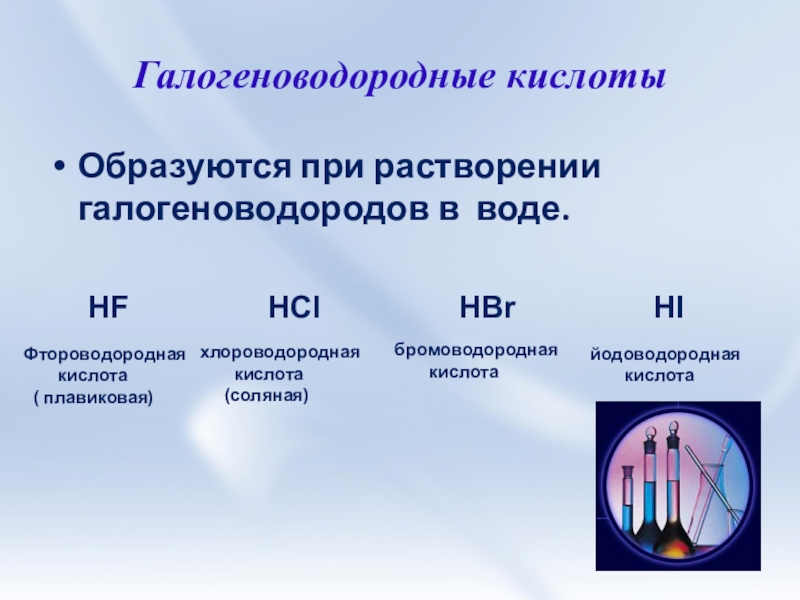
Слайд 8Галогеноводородные кислоты
Образуются при растворении галогеноводородов в воде.
HF
Фтороводородная
кислота
( плавиковая)
хлороводородная
кислота
(соляная)
бромоводородная
кислота
йодоводородная
кислота
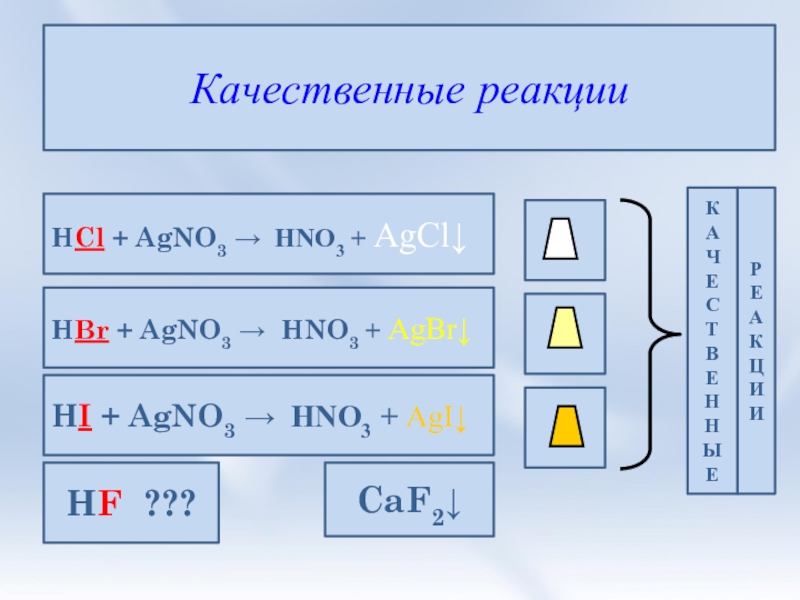
Слайд 9Качественные реакции
HCl + AgNO3 → HNO3 + AgCl↓
HBr + AgNO3 →
HI + AgNO3 → HNO3 + AgI↓
HF ???
CaF2↓
К
А
Ч
Е
С
Т
В
Е
Н
Н
Ы
Е
Р
Е
А
К
Ц
И
И
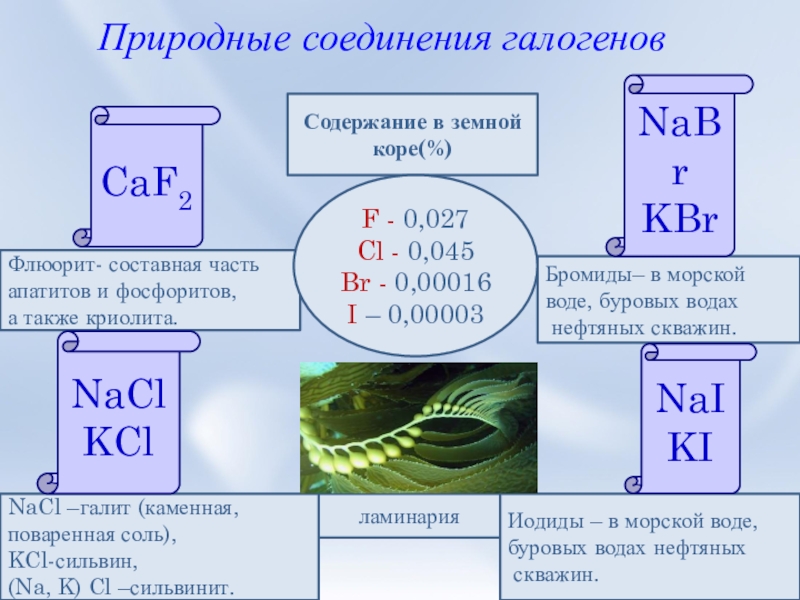
Слайд 10Природные соединения галогенов
Флюорит- составная часть
апатитов и фосфоритов,
а также криолита.
Содержание в земной
коре(%)
F
Cl - 0,045
Br - 0,00016
I – 0,00003
ламинария
Бромиды– в морской
воде, буровых водах
нефтяных скважин.
Иодиды – в морской воде,
буровых водах нефтяных
скважин.
NaCl –галит (каменная,
поваренная соль),
KCl-сильвин,
(Na, K) Cl –сильвинит.
NaBr
KBr
NaI
KI
CaF2
NaCl
KCl
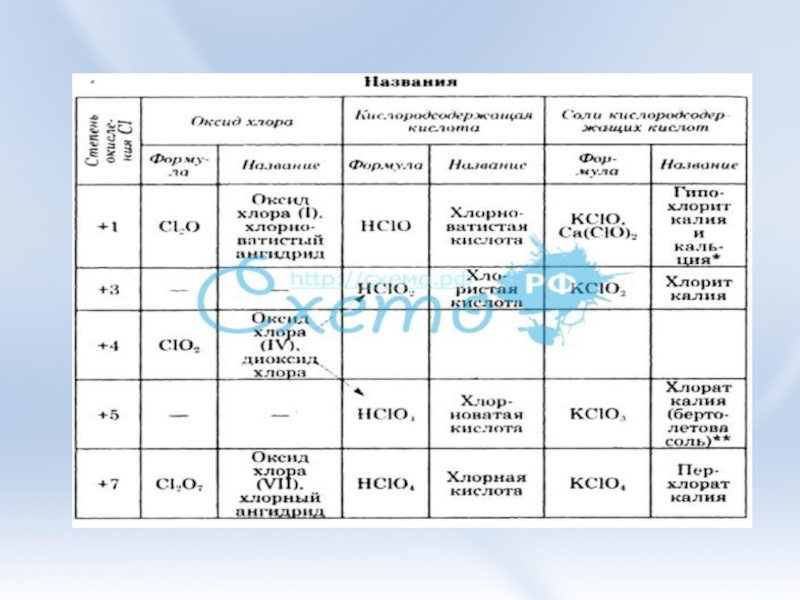
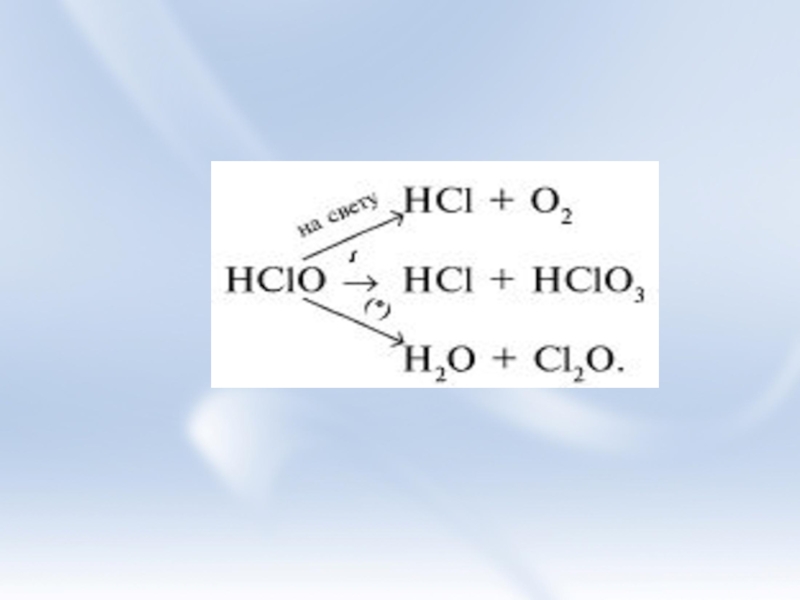
Слайд 11Оксокислоты
Хлорная – НСlO4
Хлорноватая – НСlO3 Сl2O5
Хлористая – НСlO2 Сl2O3
Хлорноватистая- НСlO Сl2O
Слайд 20 Соединения фтора
n(-CF2-CF2-)
Тефлон устойчив к действию всех
Плавиковая кислота:
HF
Разъедает стекло
Зарин и зоман-
боевые отравляющие вещества
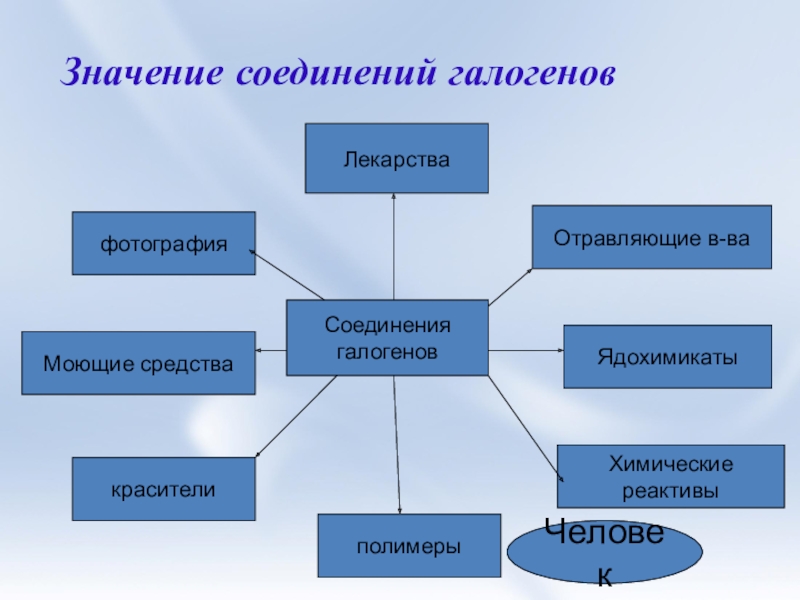
Слайд 21Лекарства
Моющие средства
красители
полимеры
Химические реактивы
Ядохимикаты
Отравляющие в-ва
фотография
Значение соединений галогенов
Соединения
галогенов
Человек
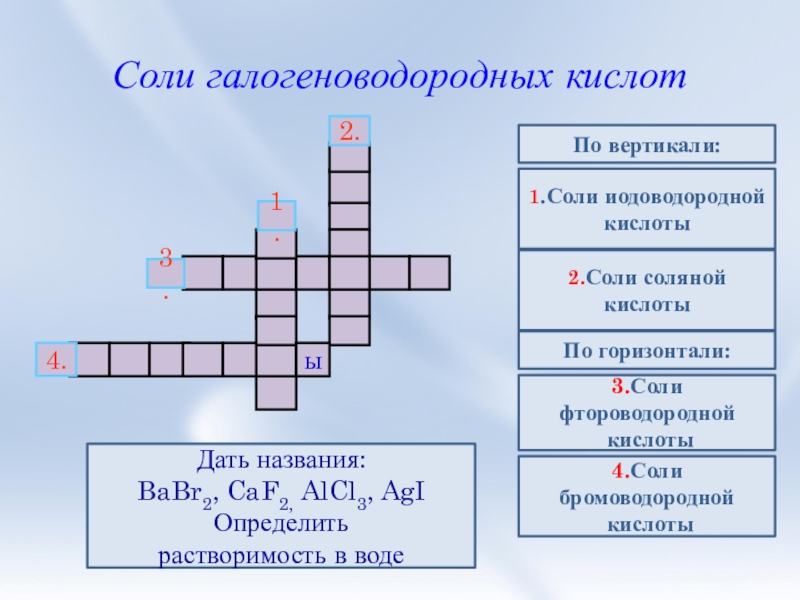
Слайд 22Соли галогеноводородных кислот
М
И
И
Р
О
Ф
Т
Д
Ы
Д
И
И
Л
О
Р
Ы
Д
Ы
Д
Б
Р
О
Х
1.
2.
4.
3.
ы
1.Соли иодоводородной
кислоты
По горизонтали:
По вертикали:
2.Соли соляной кислоты
3.Соли фтороводородной
кислоты
4.Соли
кислоты
Дать названия:
BaBr2, CaF2, AlCl3, AgI
Определить
растворимость в воде