- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Реакции обмена.
Содержание
- 1. Презентация по теме Реакции обмена.
- 2. Виды классификаций химических реакций:- по числу и
- 3. Задание 1. Проклассифицируйте реакцию по
- 4. Задание 2. Расставьте коэффициенты и укажите тип
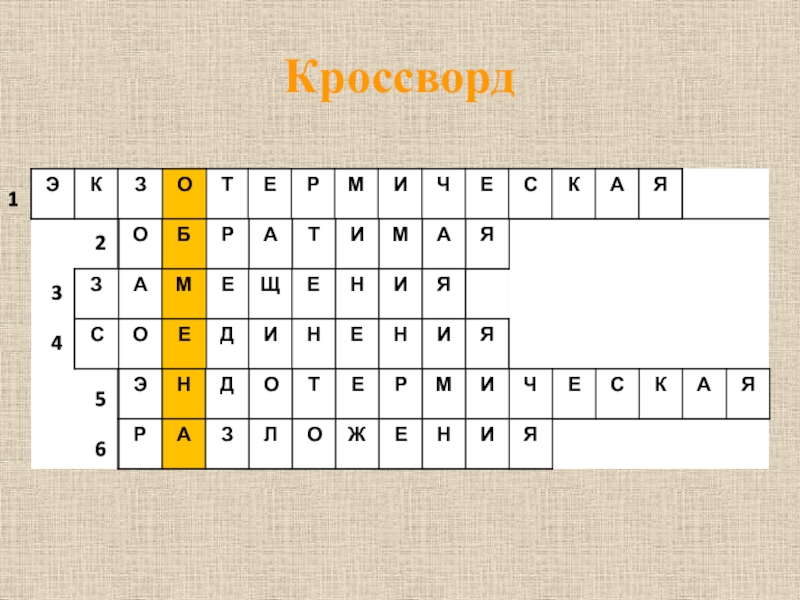
- 5. Кроссворд123456
- 6. Тема урока: "Реакции обмена". Цели урока: 1.Знать,
- 7. Слайд 7
- 8. Экспериментальное задание №1. Добавьте гидроксид натрия к
- 9. Экспериментальное задание №2. Добавьте к полученному осадку синего цвета, соляную кислоту, что наблюдаете? Cu(OH)2+2 HCl→ CuCl2+2H2O
- 10. NaOH + HCl → NaCl
- 11. Экспериментальное задание №3. Добавьте к соде соляную
- 12. Правило Бертолле:Реакции обмена, протекающие в растворах, идут
- 13. BaCl2 + 2AgNO3→Ba(NO3)2+2AgClCu(NO3)2 + NaCl→CuCl2+NaNO3Pb(NO3)2 + K2S→PbS
- 14. Я благодарность вам всем объявляю,Проверив работы, в
Слайд 1МОУ «Озерная основная общеобразовательная школа»
Реакции обмена
Автор: учитель химии Леонтьева Т.Е.
8 класс
Слайд 2Виды классификаций химических реакций:
- по числу и составу исходных веществ и
- по обратимости;
- по тепловому эффекту;
- по наличию катализатора.
Слайд 3 Задание 1.
Проклассифицируйте реакцию по различным признакам:
N2 + 3H3
kat.
- реакция соединения;
- реакция обратимая;
- реакция экзотермическая;
- реакция каталитическая.
Слайд 4Задание 2.
Расставьте коэффициенты и укажите тип химической реакции
по числу
KClO3→ KCl + O2↑
H2+ O2→ H2O
Zn+ HCl→ZnCl2+H2↑
2KClO3→2KCl+3O2↑
2H2+O2→2H2O
Zn+2HCl→ZnCl2+H2↑
Слайд 6Тема урока: "Реакции обмена".
Цели урока:
1.Знать, какие реакции называются реакциями
2. Познакомиться с реакциями нейтрализации.
3. Понять, когда реакции обмена идут до конца.
4. Научиться распознавать реакции обмена среди других реакций.
5. Использовать знания и умения в практической деятельности и повседневной жизни для безопасного обращения с веществами и материалами.
Слайд 7
Внимательным будь и не оплошай.
Тебе всегда поможет учитель,
Паники только не допускай!
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад.
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Слайд 8Экспериментальное задание №1.
Добавьте гидроксид натрия к раствору сульфата меди (II),
Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями.
CuSO4+2 NaOH →Cu(OH)2 + Na2SO4
Слайд 9Экспериментальное задание №2.
Добавьте к полученному осадку синего цвета, соляную кислоту,
Cu(OH)2+2 HCl→ CuCl2+2H2O
Слайд 10 NaOH + HCl → NaCl + H2O
Взаимодействие гидроксида натрия с соляной кислотой
Реакции обмена между щелочами и кислотами, идущие с образованием соли и воды, называют реакциями нейтрализации.
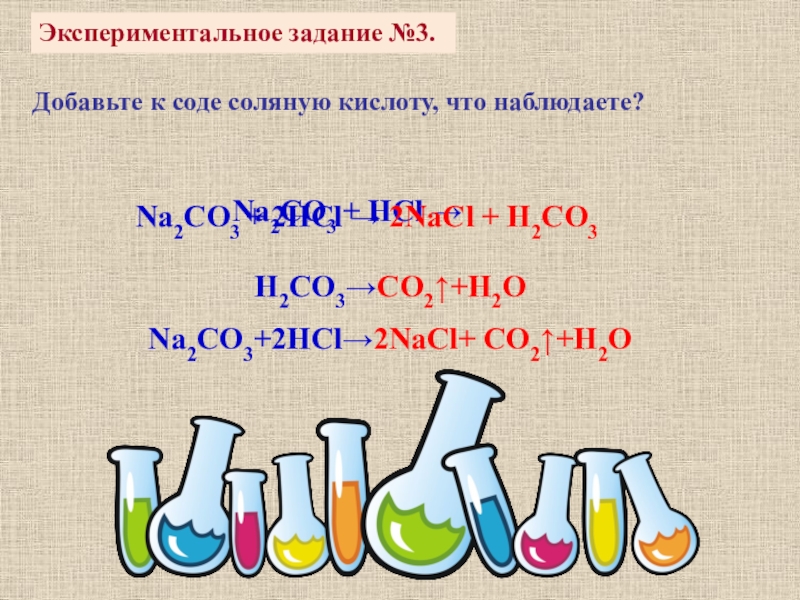
Слайд 11Экспериментальное задание №3.
Добавьте к соде соляную кислоту, что наблюдаете?
Na2CO3 +
Na2CO3 + 2HCl → 2NaCl + H2CO3
H2CO3→CO2↑+H2O
Na2CO3+2HCl→2NaCl+ CO2↑+H2O
Слайд 12Правило Бертолле:
Реакции обмена, протекающие в растворах, идут до конца, если:
1) ↓
2) ↑;
3) H2O
Если выделится газ - Это раз;
И получится вода - Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок" - говорим мы.
Это третий важный пункт.
Химик правила обмена
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок - Вот тогда - порядок!
Клод Луи Бертолле
Слайд 13BaCl2 + 2AgNO3→Ba(NO3)2+2AgCl
Cu(NO3)2 + NaCl→CuCl2+NaNO3
Pb(NO3)2 + K2S→PbS +2KNO3
MgCl2 + K2SO4→MgSO4+KCl
HNO3 +
3Ca(NO3)2 +2 H3PO4→Ca3(PO4)2+6HNO3
Ba(NO3)2 + Na2SO4→BaSO4+2NaNO3
Пользуясь таблицей растворимости, определите реакции обмена,
которые идут до конца:
Cu(NO3)2 + NaCl→CuCl2+NaNO3
MgCl2 + K2SO4→MgSO4+KCl
HNO3 + ZnSO4→H2SO4+Zn(NO3)2
Слайд 14Я благодарность вам всем объявляю,
Проверив работы, в журнал выставляю
Отметки все ваши,
Что будут они «хорошо» и «отлично»
Большое спасибо я вам говорю
Мы цели достигли. Благодарю!
Домашнее задание:
& 33, упр.4, стр.191